Ki-67增殖指数与胃间质瘤预后及危险度分级的相关性
张婧文,曹新广,刘靓,焦文云,郭长青
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是常见的胃肠道间叶源性肿瘤,约占胃肠道间叶源性肿瘤的70%,占胃肠道恶性肿瘤的0.1%~3.0%[1-2]。GIST可发生于消化道各个部位,最常发生于胃(60%~70%),其次为小肠(20%~30%)、结直肠(5%)、食管(<5%),网膜、腹膜等部位较少见[3]。GIST具有恶变可能,生物学行为从良性到恶性不等,手术切除为其唯一治愈手段[4]。Ki-67蛋白与细胞增殖密切相关,于细胞周期G1、S、G2及有丝分裂期表达增加,在G0期表达下降[5]。Ki-67增殖指数(Ki-67 proliferation index,Ki-67 PI)指在一个细胞群中Ki-67阳性细胞所占的比率,多项研究表明其高低与多种恶性肿瘤的进展、复发及耐药性相关,如乳腺癌及胃、肠、胰、神经、内分泌肿瘤等[5-8]。有研究表明,Ki-67 PI可作为预测GIST预后的因素之一[9]。胃为GIST最常发生部位,本研究着重探讨Ki-67 PI与胃间质瘤(gastric stromal tumor,GST)临床及病理特征的关系。
1 对象和方法
1.1 研究对象收集2012年7月至2021年1月在郑州大学第一附属医院接受内镜或外科治疗的225例原发性GST患者的临床及病理资料。其中男99例,女126例;年龄18~82岁,中位年龄60岁。纳入标准:于本院接受内镜下或外科手术切除,且术后病理证实为间质瘤。排除标准:合并其他恶性肿瘤;复发或转移性GST;术前接受其他治疗;病理资料不完整。
1.2 研究方法收集患者的年龄、性别、肿瘤直径、肿瘤发生部位、肿瘤生长方式、临床表现、核分裂象、危险度分级、Ki-67 PI、CD117阳性率、CD34阳性率、DOG-1阳性率、CT及内镜下表现以及肿瘤有无溃疡、出血、坏死及钙化等资料。其中肿瘤直径取CT下最大直径,危险度分级根据美国国立卫生研究院关于原发GIST切除术后危险度分级[10]标准划分。术后门诊或电话随访,随访时间截至2022年3月,记录患者术后至随访结束间质瘤复发情况。
1.3 统计学方法应用SPSS 22.0统计软件处理数据。不符合正态分布的计量资料用中位数及四分位数[M(P25,P75)]表示,组间比较采用Wilcoxon秩和检验;计数资料用频数和百分数(%)表示,组间比较采用χ2检验、Fisher精确概率法或Mann-WhitneyU检验;采用Spearman秩相关系数进行相关性分析;采用Kaplan-Meier方法绘制生存函数,生存率作log-rank检验;采用Kappa一致性检验评价一致性。P<0.05为差异有统计学意义。
2 结果
2.1 Ki-67最佳截断值确定应用受试者工作特征(receiver operating characteristic,ROC)曲线,以Ki-67 PI为检验变量,危险度分级标准为状态变量(依据极低、低危组及中、高危组划分二分类变量)[11],计算出曲线下面积(area under curve,AUC)为0.756。根据约登指数计算出Ki-67 PI最佳截断值为7.5%,敏感度为0.556,特异度为0.882。见图1。

图1 Ki-67 PI的ROC曲线
2.2 GST的临床资料及病理资料本研究225例GST患者,肿瘤直径[3(2.5,3.7)]cm,47例(20.9%)合并溃疡,11例(4.9%)存在出血,16例(7.1%)出现坏死,20例(8.8%)存在钙化。依据患者主诉及临床表现大致分为4类:腹痛、腹胀等腹部不适者98例(43.6%),呕血、黑便等消化道出血者55例(24.4%),体检发现34例(15.1%),其他症状38例(16.9%)。肿瘤生长方式为129例腔内型(57.3%),34例腔外型(15.1%),62例腔内外混合型(27.6%)。危险度分级中,极低危险度10例(4.4%),低危险度143例(63.6%),中危险度55例(24.4%),高危险度17例(7.6%)。核分裂象数≤5/50每高倍镜视野者159例(70.7%),>5/50每高倍镜视野者66例(29.3%)。
2.3 Ki-67 PI在GST临床及病理特征中的差异依据计算出的最佳截断值将Ki-67 PI分为低Ki-67 PI组(Ki-67≤7.5%)及高Ki-67 PI组(Ki-67>7.5%)。不同年龄、临床表现、肿瘤直径大小、肿瘤出现溃疡、出血、坏死、危险度分级及核分裂象GST患者的Ki-67 PI比较,差异有统计学意义(P<0.05);不同性别、肿瘤发生部位、肿瘤生长方式、肿瘤结节数量、肿瘤有无钙化、CD117阳性率、CD34阳性率、DOG-1阳性率GST患者的Ki-67 PI比较,差异无统计学意义(P>0.05)。中位随访时间为42.5个月,随访期间11例失访(失访率4.9%),3例复发(均在高Ki-67 PI组),1例死于其他疾病。见表1。
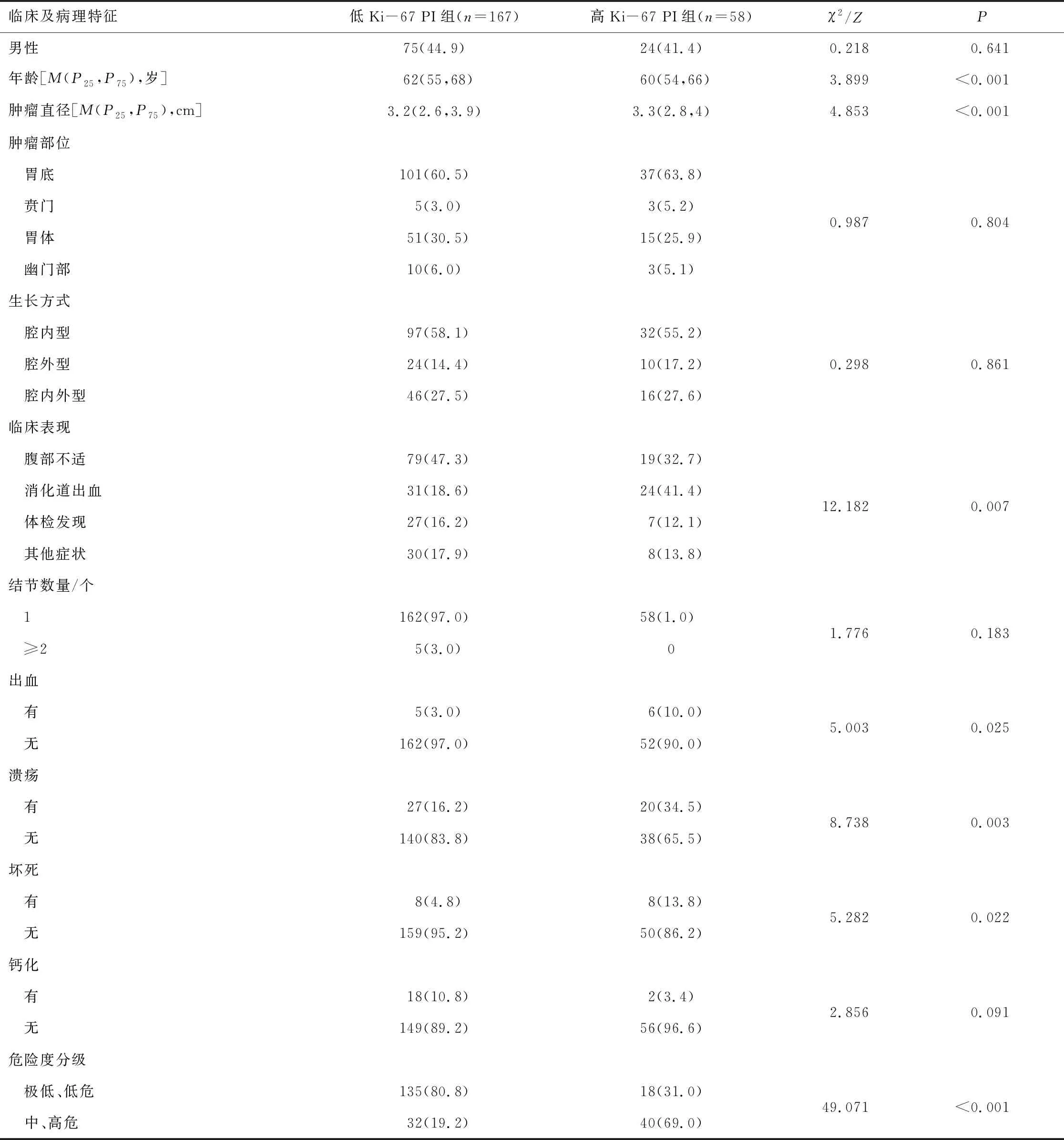
表1 不同临床及病理特征GST患者Ki-67 PI水平比较

表1(续)
2.4 Ki-67 PI与GST临床及病理特征的相关性分析Ki-67 PI与GST患者危险度分级、核分裂象数、肿瘤有无溃疡、出血、坏死及肿瘤直径大小存在相关性(P<0.05)。Ki-67 PI与患者性别、年龄、肿瘤结节数量、肿瘤发生部位、肿瘤生长方式、肿瘤有无钙化及CD117、CD34、DOG-1阳性率无相关性(P>0.05)。见表2。

表2 Ki-67 PI与临床及病理特征的相关性
2.5 一致性检验应用Ki-67 PI评价GST危险度分级的一致性。Ki-67 PI分组依据最佳截断值划分,危险度分组根据美国国立卫生研究院关于原发GIST切除术后危险度分级标准进行。见表3。
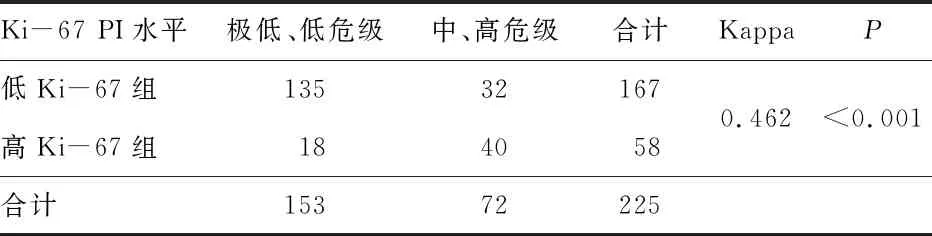
表3 Ki-67 PI水平与GST危险度分级的一致性检验(n)
2.6 生存分析本研究225例GST患者中有11例失访(失访率4.9%),中位随访时间42.5个月,3例复发。按Ki-67 PI水平分为高、低两组。3例复发者均为高Ki-67 PI组。两组以是否复发作为结局事件行生存分析,生存率作log-rank检验,高Ki-67 PI组无复发生存率低于低Ki-67 PI组(χ2=10.276,P=0.001)。
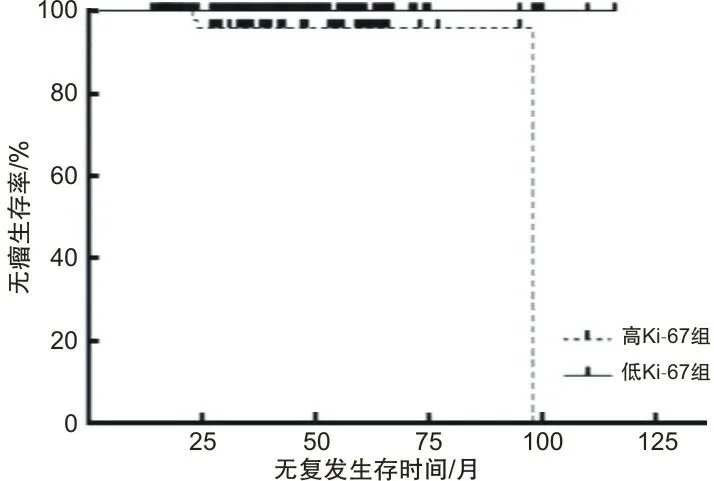
图2 根据Ki-67 PI分组的生存分析
3 讨论
GIST为潜在恶性肿瘤,起源于能向Cajal间质细胞分化的多潜能干细胞,目前评估其恶性潜能主要依靠危险度分级[12]。美国国立卫生研究院关于原发GIST切除术后危险度分级为常用的评判标准,其主要依据肿瘤部位、肿瘤直径、核分裂象数以及肿瘤是否破裂作为判断指标[13]。GIST生物学行为难以预测,从低侵袭性到高侵袭性不等,仅依靠美国国立卫生研究院关于原发GIST切除术后危险度分级标准评估恶性潜能并不全面[14]。Ki-67蛋白存在于细胞周期各活动阶段,是细胞增殖的标志物[5]。多项研究表明,Ki-67 PI与包括GIST在内的多种恶性肿瘤预后相关[5-6,8,15]。高表达Ki-67 PI与GIST恶性风险高、生存率低及复发率高相关,为GIST的独立危险因素[15-16]。
既往有研究指出,Ki-67 PI判断GIST良恶性及预后的临界值为3%,也有其他研究指出临界值可选择5%或10%[17-19],但目前尚无指南明确消化道不同部位间质瘤Ki-67 PI临界值的大小。本研究着重研究GST,其中Ki-67 PI取AUC最大时应用约登指数计算出的最佳截断值为7.5%,由此将Ki-67 PI分为高、低两组。高Ki-67 PI组GST患者的肿瘤直径更大,患者出现溃疡、出血及坏死的比率高,临床表现以消化道出血者多,肿瘤的危险度分级及核分裂象数也较高,患者复发率更高。行相关性分析,Ki-67 PI与肿瘤直径、肿瘤有无溃疡、出血及坏死、患者临床表现、危险度分级及核分裂象数具有相关性。采用Kappa一致性检验验证以Ki-67 PI分组评估GST患者危险度与以根据美国国立卫生研究院关于原发GIST切除术后危险度分级标准评估GST患者危险度的一致性,结果示两者具有一致性。已有研究指出,Ki-67 PI与GIST肿瘤大小、危险度分级、恶性潜能及预后相关[15,20-21]。本研究上述结果也表明对于GST,Ki-67 PI可辅助美国国立卫生研究院关于原发GIST切除术后危险度分级评估其恶性程度及预后的指标。两组GST患者的CD117、CD34、DOG-1阳性率无明显差异,也无相关性,表明这3种免疫组化指标虽为诊断GIST的特异性标志物,但与肿瘤的恶性程度及预后无关。此外,有研究表明Ki-67 PI与GIST的KIT及PDGFRA基因突变有关,高Ki-67 PI预示着较差的靶向治疗效果[20,22]。本研究中GST患者术后基因检测率较低,缺失数据较多,尚需大样本来验证。
综上所述,Ki-67 PI高低与GST临床表现、肿瘤大小、肿瘤有无出血、溃疡及坏死、危险度分级、核分裂象数及复发率相关,可与美国国立卫生研究院关于原发GIST切除术后危险度分级相辅相成,共同评判肿瘤的侵袭性及预后。

