高原缺氧环境对平原移居大鼠听觉传导和外周听神经髓鞘再生的影响
于姝媛,王 苹,王心蕊,龚嘎蓝孜,杨 丽
(1.吉林大学第一医院耳鼻咽喉-头颈外科,吉林 长春 130021;2.吉林大学动物医学学院教育部人兽共患病研究所,吉林 长春 130062;3.西藏大学医学院预防医学系,西藏 拉萨 850000)
从平原地区移居高原地区可诱导人体发生一系列代偿适应性变化,以适应高原缺氧环境,该病理生理过程涉及细胞应激、代谢重组、体液和免疫系统改变等多层次调控,如果低氧习服失败,可导致急慢性高原病[1-3]。任海龙等[4]对 200名高原青年人群进行调查问卷和纯音听力测试,结果发现:拉萨地区该年龄段人群听力损失的发病率高达13.0%,明显高于平原地区,提示高原环境对人的听力有一定的影响。动物实验研究[5-6]显示:以氯化钴作用于体外培养耳蜗基底膜模拟低氧模型可导致毛细胞肿胀死亡,但反复低氧刺激却能促使机体产生获得性适应性保护反应,提高机体高原声习服能力,减轻持续低氧导致的听觉损害。目前关于听觉低氧适应相关基因及其诱导调控机制尚未明确。本研究通过平原大鼠移居高原低氧环境,观察移居后不同时间点大鼠听力和外周听神经结构的改变,旨在阐明低氧诱导的声习服与外周神经髓鞘再生的关联性,为预防和干预移居高原人群可能出现的听觉损伤提供理论依据。
1 材料与方法
1.1 实验动物、试剂和主要仪器 随机选取生活在平原地区的清洁级Wistar大鼠72只,雌雄不拘,鼠龄2个月,体质量200~250 g,由北京市维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2012-0001,无噪声暴露和药物使用史,耳廓反射正常。平原大鼠饲养于吉林大学基础医学院无特殊病原体动物(specific pathogen free,SPF)级动物实验室内完成,高原大鼠饲养于西藏大学医学院动物中心。涉及的动物实验经吉林大学第一医院实验动物伦理委员会批准。生长相关蛋白 43(growth associated protein-43,GAP-43)和髓鞘碱性蛋白(myelin basic protein,MBP)抗体购于中国Abclonal公司,即用型免疫组织化学SP试剂盒(KIT-9710)购于福州迈新生物技术有限公司,总RNA提取试剂盒(Cat.LS1040)购于美国Promega公司,First Strand cDNA Synthesis Kit(Cat.04897030001)和PCR扩增试剂盒(Cat.06924204001)购于瑞士Roche公司。石蜡切片机(RM2245)、摊片机(HI1210)和超薄切片机(EM UC7)(德国Leica公司),正置生物显微镜(CX31)、激光共聚焦显微镜(FV 1000)和倒置研究型荧光显微镜(IX71)(日本Olympus公司),透射电子显微镜(H-7650,日本HITACHI公司)。
1.2 实验动物分组 按照时间对照的原则,72只Wistar大鼠随机分为4组,每组18只。移居高原组大鼠自海拔50 m的地区运输到海拔3 600 m地区,分别为移居高原2月组、移居高原4月组和移居高原10月组,对照组为平行饲养于平原的大鼠。分别在移居高原2、4和10个月时间点检测各组大鼠听力阈值。每组中6只大鼠用于形态学分析,取一侧耳蜗固定、脱钙进行免疫组织化学染色,另一侧耳蜗戊二醛固定,在透射电子显微镜下观察神经元和髓鞘结构的改变;12只大鼠用于实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)法和Western blotting法检测。
1.3 听觉脑干电位检测 采用短声(Click)给予大鼠声刺激,扬声器距外耳道口约2 cm。扬声器的给声强度通过声学校准器校准。将银针电极中的参考电极插入大鼠同侧耳后皮下,记录电极插在颅顶正中皮下,接地电极插在对侧耳后皮下。带通滤波为100~3 000 Hz。每个声刺激强度均通过512次叠加取平均值,以最小强度测试可以重复出现Ⅲ波判断测试耳听觉脑干诱发电位(auditory brainstem response,ABR)阈值,在80 dB声刺激条件下进行潜伏期记录。
1.4 大鼠耳蜗取材 大鼠麻醉后断头,逐一取出双侧听泡。在解剖显微镜下,暴露耳蜗组织。在蜗尖部位钻孔,同时将镫骨推入打开卵圆窗,从蜗尖小孔灌入4%多聚甲醛,连续灌注3次。然后将听泡浸入固定液固定48 h,固定后采用10%EDTA进行脱钙处理15 d。
1.5 透射电子显微镜下观察大鼠耳蜗组织中神经元和神经纤维髓鞘超微结构 耳蜗经2.5%的戊二醛固定液灌注,固定48 h,10%EDTA脱钙处理,用0.1 mol·L-1磷酸漂洗液漂洗3次。再用1% 锇酸固定液固定2 h,0.1 mol·L-1磷酸漂洗液漂洗3次,乙醇逐级脱水,纯丙酮+包埋液(2∶1)室温3 h,纯丙酮+包埋液(1∶2)室温过夜,纯包埋液37℃,2 h。37℃烘箱内过夜,45℃烘箱内12 h,60℃烘箱内24 h进行固化。采用切片机制备超薄切片,厚度为70 nm,3%醋酸铀-枸橼酸铅双染色,透射电子显微镜下观察大鼠耳蜗组织中髓鞘结构和亚细胞器的形态表现。
1.6 RT-qPCR法检测大鼠耳蜗组织中MBP和GAP-43 mRNA表达水平 使用Promega RNA提取试剂盒提取大鼠耳蜗组织总RNA,DNAase Ⅰ消化去除基因组DNA,测定RNA的浓度和纯度。逆转录采用cDNA第一链合成试剂盒,取2 μg总RNA进行逆转录反应,按说明书操作。PCR扩增引物:MBP,上游引物5′-CAAAGAGACCCACACTGGCA-3′, 下 游 引 物 5′-CAAGGTCGGTCGTTCAGTCA-3′; GAP-43, 上 游 引 物 5′-ACCACTGATAACTCGCCGTC-3′, 下 游 引 物 5′-ATGTTCTTGGTCAGCCTCGG-3′。 取 1 μL cDNA 进 行PCR扩增,20 μL反应体系中包括FastStart Universal SYBR Green Master 10 μL、上下游引物各 0.4 μL (10 μmol·L-1)、 cDNA 标 本 1.0 μL 和dH2O 7.8 μL。PCR反应条件:94℃预变性 5 min;94℃变性 30 s,55℃退火30 s,72℃延伸30 s,共35个循环。每个循环退火末期检测荧光信号,在延伸反应条件中加入熔解曲线分析,以GAPDH作为内参照,采用2-△△Ct法计算目的基因mRNA表达水平[7]。
1.7 Western blotting法检测大鼠耳蜗组织中MBP蛋白表达水平 大鼠双侧耳蜗加入组织裂解液 300 μL,超声破碎细胞。4 ℃、12 000 r·min-1离心15 min,取上清,采用BCA法进行蛋白定量,10%的SDS-PAGE,120 V低温电泳2 h,将凝胶上的蛋白带电转移至PVDF膜,5%脱脂牛奶封闭1 h,分别加入一抗(MBP,1∶1 000稀释;β-actin,1∶5 000稀释),4℃孵育过夜,TBST缓冲液洗PVDF膜,3×15 min,加入二抗(HRP标记山羊抗兔 IgG,1∶2 000稀释),孵育 1 h,TBST洗膜3次,然后加入ECL化学发光底物,采用化学发光检测仪进行检测。以β-actin作为内参照,采用Image J软件对图像中条带的灰度值进行相对定量分析,计算MBP蛋白表达水平。MBP蛋白表达水平=MBP蛋白条带灰度值/β-actin条带灰度值。
1.8 免疫组织化学染色法检测大鼠耳蜗组织中GAP-43蛋白表达水平 脱钙完成的耳蜗组织,梯度乙醇脱水,二甲苯透明,浸蜡,包埋,切片机切片,切片厚5 μm。二甲苯脱蜡,梯度乙醇至水,0.01 mol·L-1PBS 缓 冲 液 冲 洗 3×3 min;0.01 mol·L-1柠檬酸盐缓冲液中加热10 min进行抗原修复。PBS缓冲液冲洗3×3 min,滴加3%过氧化氢孵育20 min,除内源性过氧化物酶活性。滴加5%山羊血清孵育30 min,滴加一抗(GAP-43,1∶200),4℃过夜。PBS缓冲液冲洗3×5 min,滴加生物素化IgG室温孵育15 min,PBS缓冲液冲洗3×5 min,然后滴加辣根酶标记链霉卵白素室温孵育10 min。二甲基联苯胺显色剂显色,苏木精复染1 min,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。每个样本选取平行耳蜗中轴连续切片,间隔5片取1张,共取5张切片进行耳蜗神经节区域螺旋神经节细胞中GAP-43阳性表达细胞计数,GAP-43免疫组织化学染色结果根据细胞染色强度评分0、1、2、3和4及阳性细胞百分率进行计算。GAP-43蛋白表达水平=GAP-43阳性细胞百分率(%)×染色强度评分。
1.9 统计学分析 采用SPSS 18.0统计软件进行统计学分析。各组大鼠ABR阈值和潜伏期,大鼠耳蜗组织中MBP和GAP-43 mRNA及蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠ABR阈值和潜伏期 与对照组比较,移居高原各组大鼠ABR阈值增高5~13 dB,但差异均无统计学意义(P>0.05)。在声强度为80 dB SPL的Click声刺激下测定大鼠ABR各波潜伏期,与对照组比较,移居高原2和4月组大鼠Ⅰ波和Ⅲ波潜伏期明显延长(P<0.05),移居高原10月组大鼠Ⅰ波和Ⅲ波潜伏期差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠ABR阈值和潜伏期Tab.1 ABR thresholds and latencies of rats in various groups (n=18,±s)
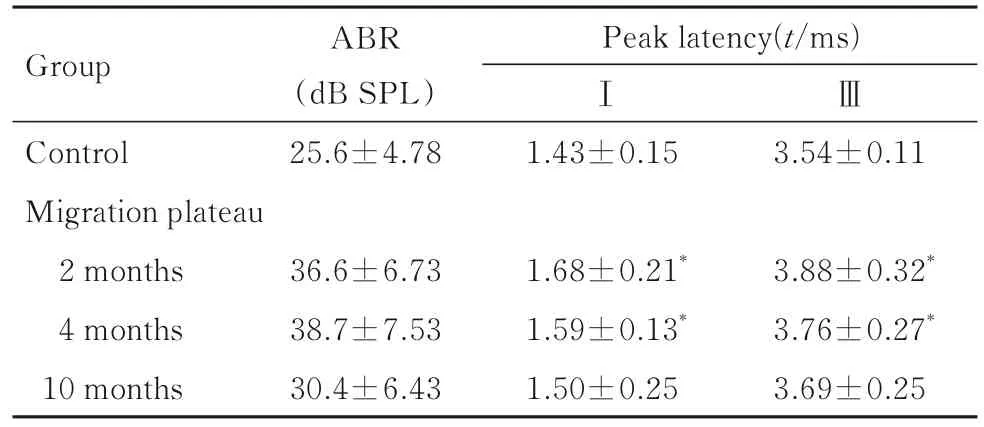
表1 各组大鼠ABR阈值和潜伏期Tab.1 ABR thresholds and latencies of rats in various groups (n=18,±s)
*P<0.05 vs control group.
GroupⅢControl Migration plateau 2 months 4 months 10 months ABR(dB SPL)25.6±4.78 Peak latency(t/ms)Ⅰ1.43±0.153.54±0.11 3.88±0.32*3.76±0.27*3.69±0.25 36.6±6.73 38.7±7.53 30.4±6.43 1.68±0.21*1.59±0.13*1.50±0.25
2.2 各组大鼠耳蜗组织中神经元和神经纤维髓鞘的超微结构 对照组大鼠耳蜗组织中神经元被微卫星胶质细胞组成的鞘膜连续包绕,神经元细胞直径10.0~12.1 μm;移居高原2月组大鼠耳蜗组织中神经元细胞明显水肿,细胞质减少,直径15.0~20.0 μm,鞘膜出现断裂,细胞膜与髓鞘之间出现较大缝隙;移居高原4月组大鼠耳蜗组织中髓鞘与神经元之间的缝隙变小,神经元包绕的髓鞘缺失明显少于移居高原2月组,直径12.5~14.0 μm;移居高原10月组大鼠耳蜗神经元鞘膜完整,与对照组比较无明显差异,细胞质中线粒体和内质网丰富,结构完整,核膜核仁清晰,与对照组比较胞质区空泡略多。见图1。
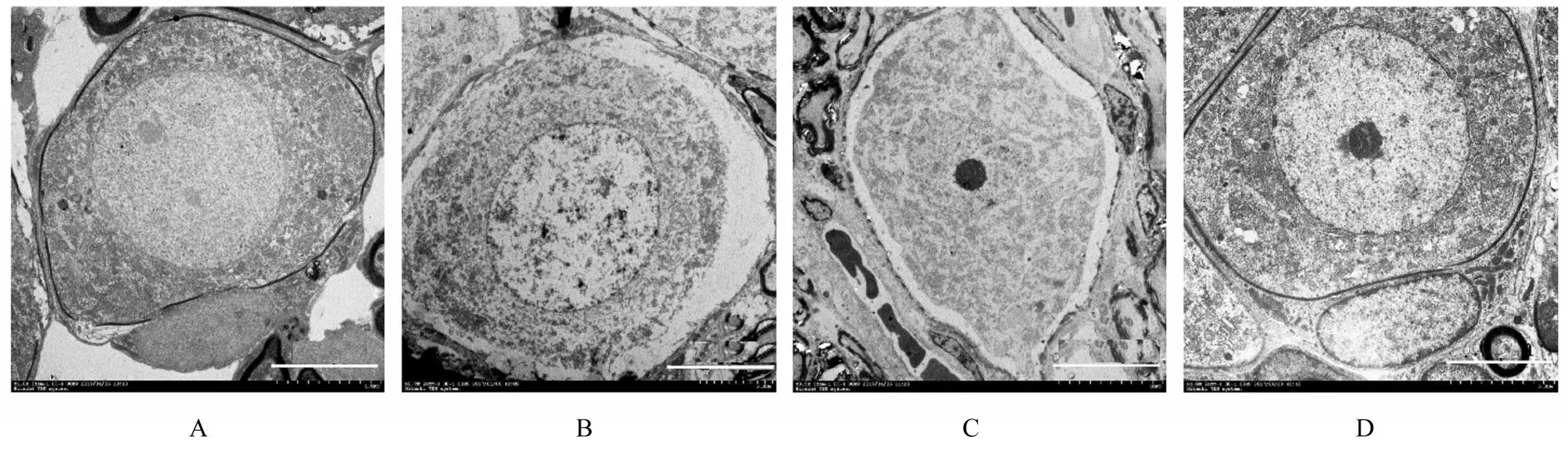
图1 各组大鼠耳蜗组织中神经元的超微结构Fig.1 Ultrastructures of cochlear neurons of rats in various groups
观察雪旺细胞对神经纤维包绕形成的髓鞘结构,对照组大鼠可见深染的髓鞘板层结构,连续且紧密包绕在神经纤维周围;移居高原2月组大鼠可见明显的脱髓鞘特征,神经纤维变性变形,出现空化,神经纤维与髓鞘分离,板层间出现裂隙;移居高原4月组大鼠神经脱髓鞘明显减轻;移居高原10月组大鼠神经纤维髓鞘完整,未见明显的板层分离,神经纤维内可见完整线粒体结构。见图2。

图2 各组大鼠耳蜗组织中神经纤维髓鞘的超微结构Fig.2 Ultrastructures of cochlear nerve fibers of rats in various groups
2.3 各组大鼠耳蜗组织中MBP和GAP-43 mRNA及蛋白表达水平 RT-qPCR和Western blotting法检测大鼠耳蜗组织中MBP mRNA及蛋白表达水平结果显示:与对照组比较,移居高原2和4月组大鼠耳蜗组织中MBP mRNA及蛋白表达水平明显降低(P<0.01),移居高原10月组大鼠耳蜗组织中MBP mRNA及蛋白表达水平差异无统计学意义(P>0.05)。见图3。
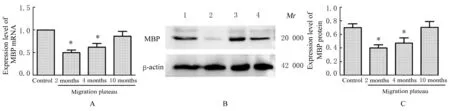
图3 各组大鼠耳蜗组织中MBP mRNA表达水平(A)、MBP蛋白表达电泳图(B)和直条图(C)Fig.3 Expression levels of MBP mRNA(A)and electrophoregram(B)and histogram(C)of MBP protein expression in cochlear tissue of rats in various groups
RT-qPCR法检测大鼠耳蜗组织中GAP-43 mRNA表达水平结果显示:与对照组比较,移居高原2月组大鼠耳蜗组织中GAP-43 mRNA表达水平明显降低(P<0.01),移居高原10月组大鼠耳蜗组织中GAP-43 mRNA表达水平差异无统计学意义(P>0.05);与移居高原2月组比较,移居高原4月组大鼠耳蜗组织中GAP-43 mRNA表达水平明显升高(P<0.05)。见图4。

图4 各组大鼠耳蜗组织中GAP-43 mRNA表达水平Fig.4 Expression levels of GAP-43 mRNA in cochlear tissue of rats in various groups
免疫组织化学染色结果显示:GAP-43表达于大鼠耳蜗神经元胞浆中。对照组大鼠耳蜗组织中GAP-43蛋白在神经元中分布均匀,中度表达;与对照组比较,移居高原2月组大鼠耳蜗神经元中GAP-43蛋白表达水平明显降低(P<0.01),移居高原10月组大鼠耳蜗组织中GAP-43蛋白表达水平差异无统计学意义(P>0.05);与移居高原2月组比较,移居高原4月组大鼠耳蜗神经元中有少量强表达的GAP-43阳性细胞,耳蜗组织中GAP-43蛋白表达水平明显升高(P<0.05)。见图5和6。
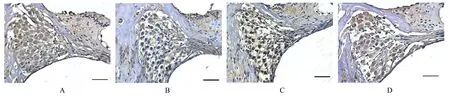
图5 免疫组织化学染色检测各组大鼠耳蜗组织中GAP-43蛋白表达情况(Bar=20 μm)Fig.5 Expressions of GAP-43 protein in cochlear tissue of rats in various groups detected by immunohistochemistry staining(Bar=20 μm)
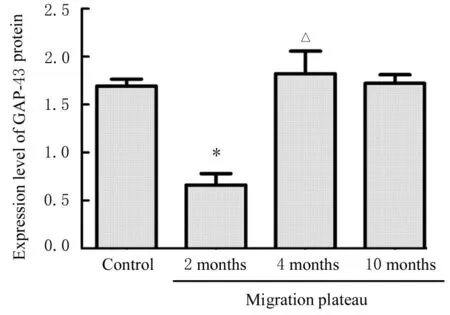
图6 各组大鼠耳蜗组织中GAP-43蛋白表达水平Fig.6 Expression levels of GAP-43 protein in cochlear tissue of rats in various groups
3 讨 论
慢性缺氧时机体可能出现诸多健康问题。对于新生儿,慢性产前缺氧影响胎儿听觉发育导致耳聋[8-9]。成年人慢性缺氧的一个常见的原因是睡眠呼吸暂停,可能会导致高血压、注意力缺陷和听力障碍[10]。高原独特的低压低氧环境对机体的影响也被广泛关注[11]。对移居高原人群的研究[12-14]显示:急进高原人群出现耳鸣头晕时,采用评价耳蜗外毛细胞功能的畸变产物耳声发射(distortion product otoacoustic emission, DPOAE)测试,低氧对耳蜗外毛细胞功能的影响并不明显[12],同时ABR Ⅰ~Ⅲ波间期及Ⅴ波潜伏期延长,说明听觉传导在蜗后阶段阻滞,表明急进高原所致听觉损伤与听神经的传导功能障碍有关。本研究结果显示:大鼠听力在高原移居2和4个月时间点的ABR阈值较对照组略有升高,但差异无统计学意义,但Ⅰ和Ⅲ波潜伏期明显延长,差异有统计学意义;在大鼠移居高原10个月后,与对照组比较,ABR阈值和波间潜伏期差异均无统计学意义,提示长期低氧环境可诱导听觉适应性反应。文献[15]报道:大鼠ABR的Ⅰ波代表近耳蜗端听神经的信号反射,Ⅱ波来自耳蜗核,Ⅲ波为耳蜗橄榄核,Ⅳ波以上为听神经中枢反射。对移居高原不同时间点大鼠的ABR检测结果分析,推测低氧诱导的听觉传导阻滞可能与听觉外周神经系统异常有关。
外周听神经系统主要涉及螺旋神经节细胞及周围包裹的微卫星胶质细胞、听神经纤维和其髓鞘化的雪旺细胞突起包裹组成的神经纤维束。耳蜗神经节细胞负责将毛细胞感知声信息从耳蜗传递到听中枢,体外培养的耳蜗神经节细胞在急性缺氧条件下通过激活神经元大电导钙激活钾通道(large conductance calcium-activated potassium channel,BKCa)引起K⁺流出增加,神经元细胞膜超极化,降低细胞兴奋性,影响耳蜗神经节细胞的传导功能[16]。此外,对新生大鼠的缺氧研究[17-19]显示:慢性缺氧可降低外周、中枢皮质和灰质区域的轴突密度和髓鞘厚度,导致长期的髓鞘形成障碍,并伴有功能损伤。本研究采用透射电子显微镜观察大鼠耳蜗听神经节区域神经元和其神经纤维的超微结构,结果显示:暴露于低氧环境2个月时大鼠外周听神经髓鞘结构损伤,神经节细胞肿胀,出现空泡样变性;2个月以后,大鼠听力逐渐恢复并且发现听神经髓鞘损伤后自我修复;而移居高原10个月后大鼠耳蜗神经元和髓鞘结构与对照组比较无明显差别,其ABR阈值和潜伏期与平行饲养于低海拔地区的对照组大鼠比较无明显差别,提示长期低氧环境对大鼠听力的影响首先是一个急性应激损伤,继而存在慢性适应修复的过程。
GAP-43在突触前终末的形成、突触可塑性以及轴突的生长和再生中起着关键作用[20-22]。在发育过程中,GAP-43存在于大多数神经元的轴突延伸中。而在成熟的大脑中,其表达仅限于少数突触前终末和分散的轴突生长锥[23]。本研究结果显示:对照组大鼠耳蜗螺旋神经节细胞中表达低、中水平的GAP-43蛋白,且分布均匀;移居高原2月组大鼠耳蜗螺旋神经节细胞中GAP-43蛋白表达水平明显降低,且可观察到神经元变性;随时间延长,移居高原4月组大鼠耳蜗神经节区域出现散在的强表达GAP-43的神经元,推测长期低氧激活GAP-43,促进损伤的神经元轴突及髓鞘的再生[24],也可能存在于耳蜗螺旋管中的静息神经干细胞被低氧激活,重新分化成神经元或髓鞘化的雪旺细胞[25]。本研究结果显示:MBP在移居高原大鼠不同时间点的动态表达规律与GAP-43蛋白一致,也进一步证实长期低氧环境下耳蜗神经元和髓鞘再生是大鼠低氧声习服的分子基础。
综上所述,高原低氧环境对听觉系统影响的主要靶点是听觉传导系统,本研究首次从组织形态学上证实了低氧能够导致大鼠部分耳蜗神经元变性和髓鞘结构破坏,但长期低氧时耳蜗神经元和神经纤维能够完全恢复正常结构。有关高原缺氧诱导听觉适应的规律和分子机制,尚需设计更多的时间节点进行系统分析。

