一测多评法同时测定虎杖中6种酚类成分的含量
王敏,王晶,杨娜,张天祺,朱怀军
作者单位:1南京大学医学院附属鼓楼医院药学部,江苏 南京 210008;
2南京临床药学中心,江苏 南京 210008;
3陕西中医药大学药学院,陕西 咸阳 712046
虎杖系蓼科植物虎杖Polygonum cuspidatum Sieb.et Zucc.的根和根茎,具有清热解毒、散瘀止痛、利湿化痰之功效[1]。虎杖化学成分种类繁多,药理活性研究最多的是虎杖苷和白藜芦醇等二苯乙烯类成分,其次是以大黄素为代表的蒽醌类成分[2-3]。现代药理学研究表明,虎杖中的酚类物质具有抗氧化[4]、降血脂[5]、抗肿瘤[6]、抗菌和抗病毒[7]等多种活性。
在虎杖药材质控方面,2020 版《中国药典》虎杖的含量测定项下仅对虎杖苷和大黄素的含量做出规定,且虎杖苷和大黄素分别采用不同的HPLC 方法[1]。由此可见,现行的虎杖质量控制标准存在质控指标少和测定繁琐的问题,多成分、多指标同时监控的质控方法对于完善虎杖的质量研究具有重要意义。
本研究采用一测多评法(multi-components by single maker,QAMS),以虎杖苷为内参物,同时测定虎杖中儿茶素、表儿茶素、虎杖苷、2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(TSHG)、白藜芦醇和大黄素6 种酚类成分,以期为虎杖药材质量标准的修订和完善提供参考。
1 材料与方法
1.1 仪器 Shimadzu LC-2030 型高效液相色谱仪(日本Shimadzu公司);Agilent-1100高效液相色谱仪(美国Agilent 公司),KH5200B 型超声波清洗器(昆山禾创超声仪器有限公司);5417R 型高速冷冻离心机(德国Eppendorf 公司);VORTEX-GENIE2 型旋涡混合器(美国Scientific Industries 公司)。Agilent ZORBAX SB C18色谱柱(150 mm×4.6 mm,5 µm);Phenomenex Kinetex C18色谱柱(150 mm ×4.6 mm,5µm);Waters Xbridge C18色谱柱(150 mm×4.6 mm,5µm)。
1.2 试剂 对照品虎杖苷(批号CHB190103)、白藜芦醇(批号CHB180228)、TSHG(批号CHB180810)、儿茶素(批号CHB180809)、表儿茶素(批号CHB180831)和大黄素(批号CHB181208)购自成都克洛玛生物科技有限公司。乙腈为色谱纯,购自德国默克公司;纯水由美国Millipore 公司的MILLI-Q超纯水器自制;其余试剂为分析纯。从四川、江苏和湖北采集10批虎杖药材,所有药材经均经陕西中医药大学副教授王晶鉴定为蓼科植物虎杖Polygonum cuspidatum Sieb.et Zucc.的根和根茎。
1.3 实验方法
1.3.1 色谱条件 Shimadzu LC-2030 型高效液相色谱仪;Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5µm);流动相为乙腈(A)-0.1%甲酸(B),梯度洗脱程序:0~20 min,15%~22%A;20~30 min,22%~95%A;30~35 min,95%A。检测波长为280 nm 和310 nm,柱温为40 ℃,流速为1.0 mL/min,进样体积为5µL。色谱图见图1。

图1 混合对照品和虎杖供试品溶液的高效液相色谱图:A为混合对照品(280 nm);B为混合对照品(310 nm);C为虎杖供试品溶液(280 nm);D为虎杖供试品溶液(310 nm)
1.3.2 对照品溶液的制备 精密称取儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素对照品适量,加甲醇至完全溶解制备各对照品溶液。取各对照品溶液适量混合,制备含TSHG 和大黄素100 mg/L 以及儿茶素、表儿茶素、虎杖苷和白藜芦醇300 mg/L混合对照品储备液。混合对照品储备液逐级稀释2、4、6、10、15 和25 倍后制成混合对照品工作液。
1.3.3 虎杖供试品溶液的制备 取虎杖粉末(过三号筛)约0.2 g,置具塞锥形瓶中,精密加入70%甲醇20 mL,密塞,称定重量,超声处理(功率250 W,频率40 kHz)1 h,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,离心(转速为每分钟14 000转)10 min,取上清液作为供试品溶液。
1.4 相对校正因子的确定 以虎杖苷为内参物(s),建立儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的相对校正因子(relative correlation factor,RCF)[8],RCF=fs/fi=(As/Cs)/(Ai/Ci),其中Ai 为某待测成分i 的峰面积,Ci 为某待测成分i 的浓度,As 为内参物s的峰面积,Cs为内参物s的浓度。
1.5 待测成分的色谱峰定位 记录各待测成分分别在Shimadzu LC-2030 型高效液相色谱仪和Agilent-1100 高效液相色谱仪上,经Agilent ZORBAX SB C18色谱柱、Phenomenex Kinetex C18色谱柱和Waters Xbridge-C18色谱柱分离后的保留时间。采用相对保留时间法,计算待测成分与内参物保留时间的比值,并以此作为待测成分色谱峰定位的依据。
2 结果
2.1 方法学考察
2.1.1 线性关系 取“1.3.2 对照品溶液的制备”项下系列浓度的混合对照品工作液各5µL,注入高效液相色谱仪,测定儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素的峰面积。以待测物浓度(X)对峰面积(Y)进行线性回归。测定结果如表1 所示,6种酚类物质在所考察的浓度范围内线性关系良好。

表1 6种酚类物质的线性回归方程
2.1.2 精密度 配制低、中、高浓度的混合对照品溶液,按照“1.3.1 色谱条件”项下条件,一个分析批内,连续测定6次,考察精密度。结果显示,儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素峰面积的RSD 分别为1.23%、1.76%、1.09%、3.12%、3.97%和0.98%,表明方法的精密度良好。
2.1.3 重复性 按照“1.3.3 虎杖供试品溶液的制备”项下平行制备6 份供试品溶液,按照“1.3.1 色谱条件”项下条件进行测定,结果显示虎杖供试品中儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素峰面积的RSD 分别为3.23%、2.31%、1.34%、4.09%、2.87%和2.17%,表明方法的重复性良好。
2.1.4 稳定性 取同一样品溶液分别于0、4、8、12和24 h进样,测定儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素的峰面积,计算RSD 进行稳定性考察。结果显示,儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素峰面积的RSD 分别为2.34%、3.23%、2.89%、3.45%、4.78%和2.69%,表明虎杖供试品溶液中待测定的6种酚类物质24 h内均有较好的稳定性。
2.1.5 加样回收率 取已知各待测成分含量的虎杖饮片粉末9 份,分别精密加入相当于供试品中各待测成分50%、100%和150%的混合对照品溶液[9],按“1.3.3 虎杖供试品溶液的制备”项下方法制备供试品溶液,按“1.3.1 色谱条件”进行测定。结果显示,儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素的平均加样回收率及RSD 分别为98.97%(3.63%)、102.37%(3.10%)、99.89%(3.27%)、100.85%(3.75%)、98.34%(3.58%)和101.04%(2.14%)。
2.2 相对校正因子的确定 取混合对照品溶液,按照“1.3.1 色谱条件”项下条件平行进样3 次分析,记录各对照品色谱峰的面积,取平均值,计算相对校正因子。虎杖苷做内参物,儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的相对校正因子的RSD均小于5%,符合试验要求。
2.3 相对校正因子的耐用性评价
2.3.1 不同色谱柱系统对RCF 的影响 采用Shimadzu LC-2030型高效液相色谱仪和Agilent-1100高效液相色谱仪,分别考察Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5 µm)、Phenomenex Kinetex C18色谱柱(250 mm ×4.6 mm,5 µm)和Waters Xbridge C18色谱柱(250 mm ×4.6 mm,5 µm)对各待测成分RCF 的影响。结果(表2)显示,儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的RCF 的RSD 均小于5%,表明RCF 在不同色谱系统和不同色谱柱上的稳定性和耐用性较好。
2.3.2 不同柱温对RCF 的影响 采用Shimadzu LC-2030 型高效液相色谱仪和Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5µm),考察不同柱温(38、40、42 ℃)对RCF的影响。结果(表2)显示,儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的RCF 的RSD均小于5%,表明RCF在不同柱温下的稳定性较好。
2.3.3 不同流动相体积流量对RCF 的影响 采用Shimadzu LC-2030 型高效液相色谱仪和Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5 µm),考察不同流动相体积流量(0.8、1.0、1.2 mL/min)对RCF 的影响。结果(表2)显示,儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素RCF 的RSD 均小于5%,表明流动相体积流量对待测成分RCF无显著影响。

表2 不同实验条件对相对校正因子的影响
2.4 待测成分的色谱峰定位 采用相对保留时间法,计算待测成分与内参物保留时间的比值,结果(表3)显示,以虎杖苷为内参物,儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的相对保留时间的RSD均小于5%,表明待测成分的相对保留时间波动较小,可用于待测成分的色谱峰定位。

表3 待测成分与内参物对相对保留时间的比较
2.5 QAMS 和外标法测定结果比较 10 批虎杖药材按照“1.3.3”项下制备供试品溶液,按照“1.3.1 色谱条件”进样分析,分别采用QAMS和外标法计算各成分的含量。在QAMS 方法应用时,除内参物虎杖苷按外标法计算浓度,其余待测成分按Ci= f×Cs×(Ai/As)计算浓度。将QAMS 和外标法所测得的待测物浓度采用配对t检验进行比较,结果(表4)显示各待测物P 值均大于0.05,表明QAMS 和外标法两种方法的检测结果差异无统计学意义。
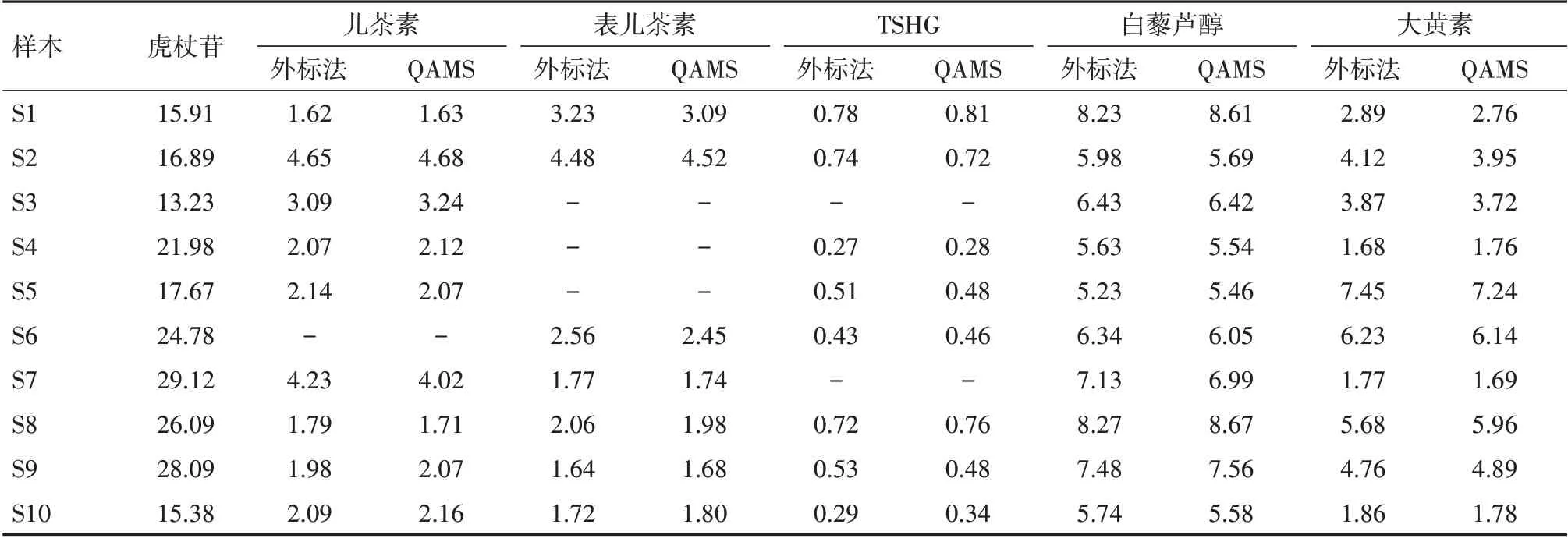
表4 虎杖中6种酚类物质的测定结果/(mg/g)
3 讨论
3.1 测定波长的选择 本研究所测定的化合物种类包含二苯乙烯类、蒽醌类和鞣质类。采用DAD 全波长扫描6 种待测成分,儿茶素和表儿茶素在202 nm和278 nm处有较大吸收,TSHG在317 nm处有较大吸收,虎杖苷和白藜芦醇在309 nm 处有较大吸收,而大黄素在254 nm和287 nm处有较大吸收。比较不同波长下的基线干扰、色谱峰峰形和分离度等信息,最终确定虎杖苷、白藜芦醇和TSHG 的检测波长为310 nm,儿茶素、表儿茶素和大黄素的检测波长为280 nm。
3.2 内标物和含量测定指标的选择 就虎杖药材的质量评价与控制而言,2020 版《中国药典》仅对其中的虎杖苷和大黄素的含量做出规定,且虎杖苷和大黄素分别采用不同的热回流提取方法和色谱分离检测方法,方法耗时长、操作繁琐。为解决这一问题,研究人员进行了不断的探索。陈黎等[10]采用超高效液相色谱-串联质谱(UPLC-MS/MS)法建立了同时测定虎杖中虎杖苷和白藜芦醇等11 种指标性成分含量的方法,并将该方法成功应用于3 批虎杖药材的质量评价。孔德暄等[11]采用高效液相色谱法比较分析了虎杖中虎杖苷、白藜芦醇和大黄素等5 种活性成分在其根木质部、根茎木质部和根表皮等不同根部位中的含量,为虎杖药材的采收和资源合理应用提供了一定的参考。多成分同步质量控制模式是现阶段中药质量控制的趋势。在传统的基于对照品的多成分同时定量的基础上,QAMS 法应运而生,并得到迅速发展,广泛应用于酸枣仁[12]、板蓝根[13]和红参[14]等多种中药的质量控制。QAMS法以中药材中某一指标性成分为内参物,根据各指标性成分间信号响应的内在关系,计算其他指标性成分与内参物之间的相对校正因子,通过内参物标准曲线和相对校正因子换算其他指标性成分的量。在无法提供所有指标性成分对照品的情况下,QAMS法可实现以一种成分为对照,同时测定多种成分的含量,在推广应用中可一定程度上解决中药对照品匮乏和实验成本高的问题。
在中药质量评价和控制领域,原则上应选择中药中药理作用比较明确的有效成分或与中药临床功效具有相关性的成分为指标性成分。除2020 版《中国药典》虎杖的含量测定项下规定的虎杖苷和大黄素外,多项研究显示虎杖中白藜芦醇具有抗肿瘤[6]、抗菌和抗病毒[7]功效,TSHG 具有抗炎、抗抑郁、抗氧化和抗动脉粥样硬化活性[15],而儿茶素和表儿茶素具有抗氧化、抗炎、改善心脑血管疾病症状以及保护神经系统的功能。综上所述,本论文选取药理作用明确的儿茶素、表儿茶素、虎杖苷、TSHG、白藜芦醇和大黄素6 种酚类成分作为含量测定指标。基于高效液相色谱仪建立了6种酚类成分同时定量分析的方法,并从线性关系、精密度、重复性、稳定性和加样回收率等方面进行方法学验证,结果显示所建立的方法满足中药成分含量测定要求[16],可用于虎杖药材中6种酚类成分的定量。
3.3 QAMS 法用于虎杖药材的质量评价 鉴于白藜芦醇[17]光稳定性差,本研究选取虎杖最具代表性的成分虎杖苷为内参物,建立儿茶素、表儿茶素、TSHG、白藜芦醇和大黄素的相对校正因子,并从不同仪器、色谱柱、流速和柱温等多个方面考察了相对校正因子的耐用性。结果显示,各种考察的因素对相对校正因子的影响RSD 均小于5%,可见各成分相对校正因子稳定性均较好。本研究采用t 检验比较QAMS 法和外标法的检测结果,结果显示两种方法所得虎杖中6 种酚类含量值之间无显著性差异。相比于质谱法[10]定量,本研究所采用的高效液相色谱紫外检测法具有经济适用、稳定性好和易于推广的优势;相比于传统的基于对照品的多成分同时定量方法[10-11],本研究所建立的QAMS 法以一种成分为内参物定量其他成分,具有分析成本低和分析效率高的优势[18]。
综上所述,QAMS 法稳定可靠,以一种指标性成分为内参物即可测定多种成分的含量,在节约标准品和实验成分的同时,增加了检测的便利性。QAMS 法可更加快速简便地实现虎杖药材的质量评价和控制。

