没食子酰芍药苷对白细胞介素8诱导的人脐静脉血管内皮细胞增殖和迁移的影响
孙贺军,孔永红,陈新蕾,张海龙,夏海清
作者单位:1驻马店市中心医院药学部,河南 驻马店 463000;
2南阳市中心医院西药科,河南 南阳 473009
血管内皮细胞(vascular endothelial cell,VEC)参与血栓形成与止血、动脉粥样硬化、炎症反应、免疫排斥反应及肿瘤转移等病理生理过程,VEC 迁移和增殖在组织损伤修复和血管新生等过程中发挥重要作用[1]。人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)具有干细胞的特性,是血管疾病的重要研究模型[2]。
白细胞介素8(interleukin 8,IL-8)能够促进炎性反应进程,刺激血管内皮细胞的形成,在肺腺癌中高表达,可能促进肺腺癌的发生与发展[3]。IL-8 可诱导卵巢癌细胞发生上皮间质转换(epithelial-mesenchymal transition,EMT),促进迁移和侵袭[4],并可诱导血管内皮细胞的迁移[5]。研究表明,没食子酰芍药苷(6'-O-Galloylpaeoniflorin,GPF)通过降低激活转录因子2(activating transcription factor 2,ATF2)表达抑制非小细胞肺癌的增殖和转移[6]。ATF2 在宫颈癌中高表达,与癌细胞的增殖和凋亡有关[7]。本研究通过Target Scan预测发现,ATF2可能是miR-212-3p 的靶基因。miR-212-3p 在骨肉瘤中低表达,促进骨肉瘤的发展[8],在类风湿性关节炎中,其也抑制成纤维滑膜细胞增殖并促进凋亡[9]。miR-212-3p和ATF2 对血管内皮细胞增殖和迁移的影响尚不清楚。
因此,本研究自2019 年6 月至2020 年1 月以HUVECs 为研究对象,研究GPF 是否通过miR-212-3p/ATF2 调控IL-8 诱导的血管内皮细胞增殖和迁移,以期为血管类疾病的研究提供新的思路。
1 材料与方法
1.1 材料 人脐静脉血管内皮细胞细胞株HUVECs 购自美国ATCC;没食子酰芍药苷(GPF)(HPLC≥98%)购自上海金穗生物科技有限公司;IL-8、肝素、内皮细胞生长添加剂(ECGS)、胰蛋白酶、牛血清白蛋白(BSA)、二甲基亚矾(DMSO)和四氮唑蓝(MTT)购自Sigma-Aldrich 公司;F-12K 培养基和胎牛血清(FBS)购自Gibco 公司;Transwell 板购自美国Corning 公司;引物、miR-212-3p mimics(miR-212-3p)、miR-212-3p 抑制物(anti-miR-212-3p)、ATF2 干扰物(si-ATF2)和阴性对照(miR-con、antimiR-con 和si-con)及含有miR-212-3p 结合位点的ATF2-3’UTR 野生型及突变型报告基因载体购自上海吉玛制药技术有限公司;双荧光素酶报告系统购自美国Promega 公司;Lipofectamine 2000 转染试剂、RNA 提取试剂TRIzol、反转录试剂盒(RT-PCR)和real-time PCR 试剂盒购自美国Invitrogen公司;ATF2抗体、增殖细胞核抗原(PCNA)抗体、基质金属蛋白酶-2(MMP-2)抗体和肌动蛋白(β-actin)抗体购自英国Abcam 公司;显微镜、发光仪、酶标仪及Real-time PCR 仪购自美国Bio-Rad 公司;流式细胞仪购自美国BD 公司;BCA 蛋白检测试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养、药物处理 细胞培养:将人脐静脉血管内皮细胞HUVECs 细胞培养于含10%FBS、1% 青-链霉素、0.1 g/L 肝素和0.05 g/L ECGS 的F-12K 培养基中,在湿度95%、37 ℃且5%二氧化碳培养箱中培养,消化传代。
药物处理:将IL-8 和GPF 分别配制并过滤除菌。根据文献[4]用100 µg/L IL-8 处理HUVECs 48 h,收集细胞进行后续实验。将IL-8 诱导后的HUVECs 细胞接种于96 孔板培养过夜,然后加入终浓度为100、200 和400 µmol/L 的GPF,对照组加入空白培养液,继续培养24~72 h,然后进行转染或后续实验[4,6]。
1.2.2 细胞转染 用培养液稀释对数生长期的HUVECs 细胞,以2×l05个细胞/孔接种于6 孔板中,培养细胞待细胞至融合度为80%~90%,根据转染试剂说明书操作进行HUVECs 转染,转染48 h,收集细胞,验证转染效果,进行后续实验。转染分组:miR-212-3p低表达组(转染anti-miR-con和anti-miR-212-3p)、miR-212-3p 过表达组(转染miR-con 和miR-212-3p)、miR-212-3p 和ATF2 低表达组(转染anti-miR-212-3p+si-con 和anti-miR-212-3p+si-ATF2)及双荧光素酶报告系统(转染miR-con+WT、miR-212-3p+WT、miR-con+MUT和miR-212-3p+MUT)。
1.2.3 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测RNA 的表达 收集各组转染和(或)IL-8及GPF 处理的HUVECs 细胞,用TRIzol 试剂提取细胞总RNA,合成cDNA,以cDNA 为模板按照realtime PCR 的说明书进行反应合成miR-212-3p 和AFT2 mRNA,反应程序为:95 ℃5 min;94 ℃30 s、58 ℃35 s、72 ℃45 s,35 个循环;72 ℃10 min。运用Bio-Rad PCR系统,用2-ΔΔCt方法进行数据分析。
1.2.4 MTT实验检测细胞存活率 收集转染或IL-8处理后的HUVECs 细胞,胰酶消化细胞并稀释,以2×103个/孔接种于96 微孔板中,培养液中加入GPF(终浓度分别为100、200 和400µmol/L),对照NC 组中添加等体积的空白培养液,待细胞培养至48 h 时进行MTT 实验,酶标仪测定490 nm 吸光度(A)值。存活率=(A 对照NC 组-A 实验组)/A 对照NC 组×100%。
1.2.5 Transwell 实验检测细胞迁移 收集对数生长期的转染或处理后的各组HUVECs 细胞,消化细胞,用含无血清F-12K 培养基将细胞稀释为2×105个/毫升。24 孔Transwell 下层小室加入500 µL 含10%FBS 的F-12K 培养基,上层小室中加入100 µL细胞同时加入实验浓度的GPF,对照中加入等体积的空白培养液,将上层小室放入下层小室中,培养24 h,取出上层小室,弃培养液,洗涤2 遍,用棉签拭去基质胶和上层小室未迁移的细胞,甲醛固定细胞,结晶紫染色,显微镜计数5个视野,取均值。
1.2.6 双荧光素酶报告实验 根据方法“1.2.2”在HUVECs 细胞中转染miR-212-3p 和ATF2 野生型(WT)及突变型(MUT)报告基因载体(含有miR-212-3p 结合位点),转染后培养48 h,收集细胞,室温裂解细胞30 min,离心收集上清,加入荧光素酶底物,发光仪检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
1.2.7 蛋白质印迹(Western blotting)实验 收集转染和(或)IL-8 处理48 h 及GPF 处理48 h 的各组HUVECs 细胞,室温裂解并超声冰浴破碎细胞,离心收集蛋白,BCA 试剂盒检测浓度。然后进行SDSPAGE,转PVDF 膜,脱脂奶粉室温封闭2 h,分别加入一抗,抗ATF2 抗体(1∶2 000)、增殖细胞核抗原(PCNA)抗体(1∶1 000)、基质金属蛋白酶-2(MMP-2)抗体(1∶2 000)和抗β-actin 抗体(1∶4 000),4 ℃孵育过夜。洗膜2次,然后加入稀释的酶标二抗,室温孵育2 h。以β-actin为内参照,分析蛋白水平。
1.3 统计学方法 使用SPSS 22.0 进行研究资料分析。观测资料中的计量数据,均通过正态性检验,以±s 描述。两组间的比较为成组t 检验或校正t检验。多组间的比较为单因素方差分析+两两比较LSD-t检验。检验水准α=0.05。
2 结果
2.1 不同浓度GPF抑制IL-8诱导的HUVECs增殖和迁移 结果表明,与对照0 µmol/L 组相比,GPF 100 µmol/L 组、200 µmol/L 组和400 µmol/L 组HUVECs 中PCNA 和MMP2 蛋白表达、细胞存活率和迁移细胞数均下降(P<0.05),且均呈现出剂量依赖趋势,见表1。说明GPF 可抑制HUVECs 的增殖和迁移。
表1 不同浓度没食子酰芍药苷(GPF)抑制人脐静脉血管内皮细胞(HUVECs)增殖和迁移/±s
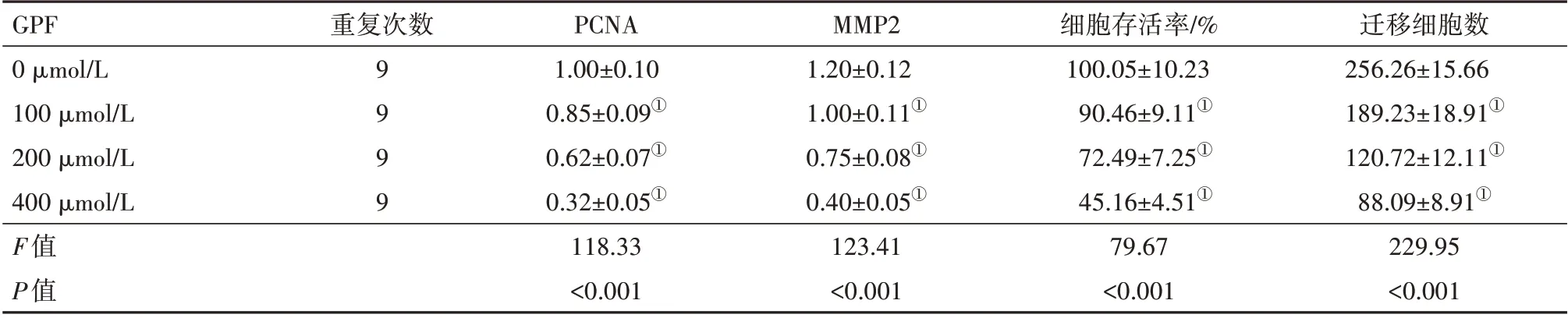
表1 不同浓度没食子酰芍药苷(GPF)抑制人脐静脉血管内皮细胞(HUVECs)增殖和迁移/±s
注:PCNA为增殖细胞核抗原,MMP-2为基质金属蛋白酶-2。①与0µmol/L细胞组比较,P<0.05。
GPF 0µmol/L 100µmol/L 200µmol/L 400µmol/L F值P值迁移细胞数256.26±15.66 189.23±18.91①120.72±12.11①88.09±8.91①229.95<0.001重复次数9999 PCNA 1.00±0.10 0.85±0.09①0.62±0.07①0.32±0.05①118.33<0.001 MMP2 1.20±0.12 1.00±0.11①0.75±0.08①0.40±0.05①123.41<0.001细胞存活率/%100.05±10.23 90.46±9.11①72.49±7.25①45.16±4.51①79.67<0.001
2.2 不同浓度GPF对HUVECs细胞中miR-212-3p和ATF2 表达的影响 与0µmol/L 组相比,GPF 100µmol/L 组、200 µmol/L 组和400 µmol/L 组HUVECs细胞中miR-212-3p的表达量上升(P<0.05),ATF2的mRNA 和蛋白表达量下降(P<0.05),且呈剂量依赖趋势,见表2。说明GPF 可以促进HUVECs 细胞中miR-212-3p 表达,抑制ATF2 表达,且剂量越高效果越好。据此选择GPF 浓度400 µmol/L 进行后续实验。
表2 不同浓度GPF对HUVECs中miR-212-3p和激活转录因子2(ATF2)mRNA及蛋白表达的影响/±s

表2 不同浓度GPF对HUVECs中miR-212-3p和激活转录因子2(ATF2)mRNA及蛋白表达的影响/±s
注:①与0µmol/L细胞组比较,P<0.05。
GPF 0µmol/L 100µmol/L 200µmol/L 400µmol/L F值P值重复次数ATF2 protein 1.00±0.10 0.85±0.08①0.60±0.06①0.25±0.03①173.04<0.001 9999 miR-212-3p 0.16±0.03 0.50±0.05①1.00±0.10①1.56±0.17①320.84<0.001 ATF2 mRNA 2.05±0.20 1.55±0.15①0.92±0.09①0.41±0.05①229.51<0.001
2.3 低表达miR-212-3p 消减400 μmol/L GPF 对HUVECs 增殖和迁移的影响 与GPF+anti-miR-con组相比,GPF+anti-miR-212-3p 组HUVECs 中miR-212-3p表达量降低(P<0.05),PCNA 和MMP2表达升高(P<0.05),细胞存活率上升(P<0.05),迁移细胞数上升(P<0.05),见表3。说明低表达miR-212-3p 可消减400µmol/L GPF对HUVECs细胞增殖和迁移的抑制作用。
表3 低表达miR-212-3p对GPF处理的HUVECs增殖和迁移的影响/±s
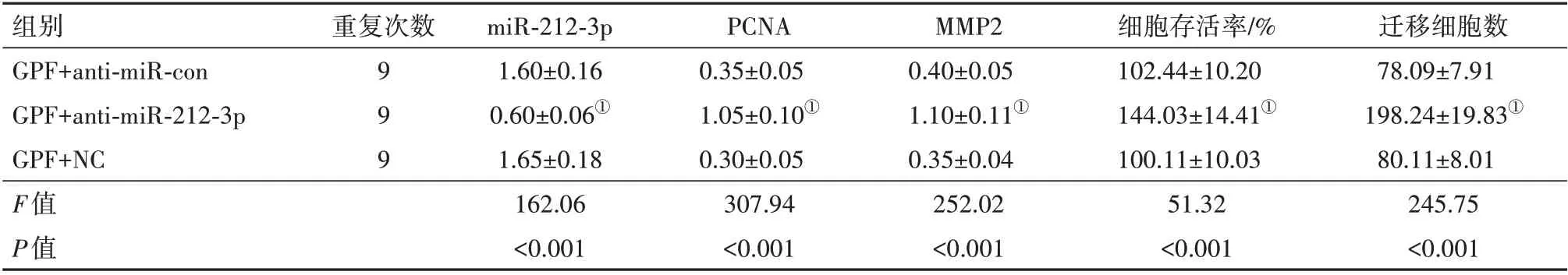
表3 低表达miR-212-3p对GPF处理的HUVECs增殖和迁移的影响/±s
注:PCNA为增殖细胞核抗原,MMP-2为基质金属蛋白酶-2。①与GPF+anti-miR-con组比较,P<0.05。
组别GPF+anti-miR-con GPF+anti-miR-212-3p GPF+NC F值P值迁移细胞数78.09±7.91 198.24±19.83①80.11±8.01 245.75<0.001重复次数999 miR-212-3p 1.60±0.16 0.60±0.06①1.65±0.18 162.06<0.001 PCNA 0.35±0.05 1.05±0.10①0.30±0.05 307.94<0.001 MMP2 0.40±0.05 1.10±0.11①0.35±0.04 252.02<0.001细胞存活率/%102.44±10.20 144.03±14.41①100.11±10.03 51.32<0.001
2.4 高表达ATF2 消减400 μmol/L GPF 对HU-VECs增殖和迁移的影响 与GPF+pcDNA-con组相比,GPF+pcDNA-ATF2 组HUVECs 中ATF2、PCNA和MMP2表达均升高(P<0.05),细胞存活率提高(P<0.05),迁移细胞数上升(P<0.05),见表4。说明高表达ATF2 可消减400 µmol/L GPF 对HUVECs 细胞增殖和迁移的作用。
表4 高表达激活转录因子2(ATF2)消减400µmol/L GPF对HUVECs增殖和迁移的影响/±s

表4 高表达激活转录因子2(ATF2)消减400µmol/L GPF对HUVECs增殖和迁移的影响/±s
注:PCNA为增殖细胞核抗原,MMP-2为基质金属蛋白酶-2。①与GPF+pcDNA-con比较,P<0.05。
组别GPF+pcDNA-con GPF+pcDNA-ATF2 GPF+NC F值P值迁移细胞数79.11±8.01 163.10±16.31①84.11±8.82 146.91<0.001重复次数999 ATF2 0.22±0.02 0.88±0.11①0.25±0.03 279.87<0.001 PCNA 0.35±0.06 1.13±0.12①0.33±0.05 274.13<0.001 MMP2 0.39±0.05 1.03±0.11①0.37±0.05 222.53<0.001细胞存活率/%103.48±10.35 161.11±16.10①100.38±10.04 67.62<0.001
2.5 miR-212-3p 靶向ATF2,调控ATF2 的表达通过Targetscan预测发现,ATF2的3’-UTR序列中含有与miR-212-3p互补的序列,见图1。

图1 通过TargetScan对miR-212-3p和ATF2结合进行预测示意图
双荧光素酶报告系统结果见表5,与miR-con 组相比,过表达miR-212-3p组ATF2野生型WT的荧光素酶相对活性下降(P<0.05);而ATF2 突变型MUT的荧光素酶相对活性没有变化。Western blotting 结果表明,与miR-con组(1.00±0.10)相比,过表达miR-212-3p 可使ATF2 蛋白表达量(0.30±0.03)下降(P<0.05);与anti-miR-con组(1.02±0.10)相比,抑制miR-212-3p 表达可使ATF2 表达量(1.60±0.16)上升(F=219.045,P<0.05),见图2。

图2 蛋白质印迹法检测ATF2蛋白表达
表5 miR-con或miR-212-3p与报告质粒共转染细胞后双荧光素酶活性检测/±s

表5 miR-con或miR-212-3p与报告质粒共转染细胞后双荧光素酶活性检测/±s
组别miR-con miR-212-3p t值P值重复次数99荧光素酶活性WT 1.00±0.10 0.30±0.03 20.11<0.001 MUT 1.00±0.10 1.01±0.10 0.21 0.835
2.6 低表达ATF2 可以部分逆转低表达miR-212-3p 对GPF 处理的HUVECs 增殖、迁移的影响 为了确认miR-212-3p 是否通过ATF2 对GPF 处理的HUVECs 细胞的增殖和迁移产生影响,在低表达miR-212-3p 的同时低表达ATF2。结果显示,抑制miR-212-3p 可促进GPF(400 µmol/L)处理的HUVECs 细胞中ATF2、PCNA 和MMP2 蛋白表达(P<0.05),细胞存活率和迁移细胞数均上升(P<0.05);与GPF+anti-miR-212-3p+si-con 组相比,GPF+antimiR-212-3p+si-ATF2 组的HUVECs 细胞ATF2、PCNA和MMP2蛋白表达量下降(P<0.05),细胞存活率和迁移细胞数均下降(P<0.05)。说明低表达ATF2 可部分逆转低表达miR-212-3p 对GPF 处理的HUVECs细胞增殖和迁移的促进作用。见表6。
表6 ATF2低表达可以部分逆转低表达miR-212-3p对GPF处理的HUVECs增殖、迁移的影响/±s

表6 ATF2低表达可以部分逆转低表达miR-212-3p对GPF处理的HUVECs增殖、迁移的影响/±s
注:ATF2为激活转录因子2,PCNA为增殖细胞核抗原,MMP-2为基质金属蛋白酶-2。①与GPF+anti-miR-con组比较P<0.05。②与GPF+anti-miR-212-3p+si-con组比较,P<0.05。
组别GPF+anti-miR-con GPF+anti-miR-212-3p GPF+anti-miR-212-3p+si-con GPF+anti-miR-212-3p+si-ATF2 F值P值细胞迁移数78.09±7.91 198.24±19.83①200.04±20.05 120.79±12.14②129.57<0.001重复次数9999 ATF2 0.20±0.10 0.80±0.08①0.82±0.08 0.35±0.09②115.60<0.001 PCNA 0.32±0.05 1.00±0.10①1.02±0.10 0.55±0.05②171.49<0.001 MMP2 0.38±0.05 1.05±0.10①1.10±0.10 0.48±0.05②202.69<0.001细胞存活率/%)102.44±10.20 144.03±14.41①145.02±14.51 112.25±11.22②26.50<0.001
3 讨论
白细胞介素8(IL-8)是趋化因子家族的一员,可直接提高内皮细胞的存活、增殖、调节血管生成[10]并促进内皮细胞迁移[11]。本研究采用IL-8诱导HUVECs 增殖和迁移,然后用GPF 处理诱导的HUVECs,检测没食子酰芍药苷(GPF)对HUVECs 细胞增殖和迁移的作用,以期为血管疾病的治疗提供新的方向。
没食子酰芍药苷(GPF)是白芍的化学成分之一[12],具有的抗氧化能力,可保护人角质形成细胞免受氧化应激[13]和紫外线B 辐射[14]诱导的细胞损伤,并可通过激活PI3K/Akt/Nrf2 通路减轻脑缺血再灌注诱导的神经炎症、氧化应激和凋亡[15]。研究表明,GPF 可通过AMPK/miR-299-5p/ATF2 途径调控非小细胞肺癌的增殖、转移和凋亡[6]。GPF 对内皮细胞增殖和迁移的作用尚不清楚。本研究通过用不同浓度的GPF 处理经IL-8 诱导的HUVECs 发现,100 µmol/L、200 µmol/L 和400 µmol/L 的GPF 可抑制IL-8 诱导的HUVECs 增殖和迁移,促进miR-212-3p 表达,抑制ATF2 表达,呈剂量依赖趋势,400µmol/L GPF 效果最好,说明GPF 可抑制内皮细胞迁移和增殖。但具体机制尚不清楚。根据温中梅[6]研究结果表明GPF 通过调节ATF2 表达进而调控非小细胞肺癌的增殖和转移,由此假设GPF 也可能通过ATF2 调控HUVECs 增殖和迁移,本研究通过Tar-getScan 预测发现,ATF2 的3’UTR 区含有与miR-212-3p 互补的区域,可能是miR-212-3p 的靶基因,因此假设GPF 可通过miR-212-3p/ATF2 调控IL-8 诱导的HUVECs增殖和迁移。miR-212-3p在胶质母细胞瘤[16]、肝细胞癌[17]和骨肉瘤[18]中表达异常,与肿瘤细胞的侵袭和增殖有关。激活转录因子(ATF2)基因编码一种对正常细胞发育和生存至关重要的转录因子,还在DNA 损伤反应中发挥作用[19],并可与JUN 形成JUN-ATF2 二聚体促进肿瘤发生[20]。ATF2 在H2O2诱导24 h 的HUVECs 中表达下调[21],ATF2的激活与HUVECs细胞形态发生有关[22],具体机制尚不清楚。
本研究发现,GPF 可促进IL-8 诱导的HUVECs中miR-212-3p的表达,抑制ATF2表达,在400µmol/L浓度内,具有剂量依赖性,低表达miR-212-3p可逆转400µmol/L GPF对HUVECs细胞增殖和迁移的抑制作用;通过双荧光素酶报告系统和Western blotting 实验发现,miR-212-3p 靶向ATF2 并调控ATF2的表达,低表达ATF2 可部分逆转低表达miR-212-3p 对GPF 处理及IL-8 诱导的HUVECs 细胞增殖和迁移的作用,GPF 通过miR-212-3p/ATF2 途径调控IL-8诱导的HUVECs细胞增殖和迁移。
综上所述,在HUVECs 细胞中,GPF 通过上调miR-212-3p 靶向抑制ATF2 的表达,进而抑制IL-8诱导的HUVECs细胞增殖和迁移。GPF在血管新生方面具有重要作用,对血管类疾病的研究具有指导意义。

