白花蛇舌草提取物对肝癌细胞JNK/p38MARK通路及细胞学行为的影响
刘皎皎,李粉萍,杨跃青,何瑾瑜,曹雪艳,薛敬东,叶苗青
作者单位:陕西省中医医院肝病科,陕西 西安 710003
肝癌是我国常见恶性肿瘤之一,近年来其发病率呈逐渐升高趋势,且在我国肿瘤致死原因中位居第二[1-2]。目前临床常用的抗肿瘤药物多是以传统的核酸和蛋白质为靶点的细胞毒性药物,具有选择性差、毒性作用强、作用机制单一、易产生耐药性等特点,因此在中药中寻找毒副作用小、疗效显著的抗肿瘤药物已然是国内外学者研究的热点[3-4]。白花蛇舌草属于茜草科耳草属植物,全草入药,研究表明,白花蛇舌草提取物(hedyotis diffusa extract,HDE)对肝癌HepG2 细胞有较好的生长抑制及凋亡诱导作用[5]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路与多种肿瘤(如肝癌)发生发展密切相关,其家族成员JNK、p38 与细胞分化、凋亡等有关[6]。然而,有关HDE 对肝癌细胞JNK/p38MARK通路的影响鲜有报道,因此本研究自2019 年8 月至2020 年4 月通过分析不同浓度HDE对肝癌细胞JNK/p38MARK 通路的影响,探讨HDE抗癌的可能作用机制。
1 材料与方法
1.1 材料 肝癌QGY 细胞株(购买于中国科学院上海生物科学研究所);白花蛇舌草提取物(HDE)(10∶1)购自陕西昊辰生物科技有限公司;全反式维甲 酸(all-transretinoic acid,AT-RA)( 批 号H20093943,纯度99.99%)购自成都恒瑞医药公司,二甲基亚砜(DMSO,批号Q2258)购自美国Sigma 公司,RPMI-1640培养基(批号NBC1255)购自美国Hyclone 公司,10%胎牛血清(批号42G5642)购自美国Gibco 公司,3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑蓝(MTT,批号M5176)购自美国Sigma 公司,胰蛋白酶(批号J1510032)购自广州Ruka公司生产;鼠抗人增殖细胞核抗原(PCNA)、凋亡相关蛋白B淋巴细胞瘤基因-2(Bcl-2)、Bcl-2 相关X 蛋白基因(Bax)、半胱氨酰天冬氨酸特异性蛋白酶3(caspase-3)、p-JNK、p-p38、β 肌动蛋白(β-actin)一抗及羊抗鼠二抗购自赛默飞世尔科技有限公司;AnnexinV-FITC/PI细胞凋亡双染试剂盒(货号HUDY03)购自上海碧云天公司。二氧化碳培养箱购自日本Sanyo 公司,Hochest33258 购自美国Sigma-Aldrich 公司;酶标仪(型号HBS-1096C)、凝胶成像系统(型号Gel Doc1000)购自美国Bio-Rad 公司;光学显微镜(型号WMSC-1037)购自上海无陌光学厂。
1.2 方法
1.2.1 细胞培养 复苏肝癌QGY 细胞,培养于含15%灭活胎牛血清、100 U/mL 青霉素、100 g/L 链霉素的RPMI-1640 培养基中,防止细菌污染,培养于37 ℃饱和湿度、5%二氧化碳、20%氧培养箱中,每2~3 天更换一次培养液,无菌操作,待细胞生长良好,且达对数生长期时进行后续实验。
1.2.2 药物处理及分组 取“1.2.1”中对数生长期的肝癌QGY 细胞,以密度为1×104个/孔接种于接种在96孔板中,分为对照组、阳性对照组、低中高HDE组。(1)对照组:RPMI-1640 培养基组;(2)阳性对照组:AT-RA(5µmol/L);(3)HDE 低、中、高剂量组:分别给予20、40、80 g/L HDE[7]。继续培养48 h。
1.2.3 MTT 法检测HDE 对QGY 细胞增殖能力的影响 取“1.2.2”各组QGY 细胞接种于96 孔板进行培养,每个孔细胞密度为1×104个,每组设6个复孔,分别于培养12、24、48 h 后向各孔加入MTT 20 µL,继续培养4 h 后,弃去上清,加入150 µL DMSO,振荡10 min,使蓝紫色结晶充分溶解。全自动酶标仪测定570 nm 波长处吸光度A 值。细胞增殖抑制率=[1-药物组A值/对照组A值]×100%。
1.2.4 Hoechest33258 荧光染色法检测细胞凋亡形态 收集“1.2.2”中各组细胞,按照Hoechest33258荧光染色法说明进行操作,置于荧光显微镜下观察48 h时的细胞凋亡形态并拍照。
1.2.5 流式AnnexinV-FITC/PI 双染法检测各组
QGY 细胞凋亡情况 取“1.2.2”中各组细胞,严格按照AnnexinV-FITC/PI 细胞凋亡双染试剂盒说明书,胰酶消化细胞后生理盐水洗涤后制成1×109个/升单细胞悬液,取其中100 µL 后加入5 µL AnnexinVFITC 与5µL PI 混合均匀,室温避光孵育15 min,上流式细胞仪进行检测培养48 h 各组QGY 细胞凋亡情况,并通过Modfir LT 软件分析试验结果。每组设置三个重复。
1.2.6 蛋白质印迹法(Western blotting)检测增殖、凋亡及JNK/p38MARK 通路相关蛋白表达变化 取“1.2.2”各组细胞,每组均设3个重复,PBS洗涤2遍,冰上加裂解液,裂解30 min,离心取上清,通过蛋白提取试剂盒提取细胞总蛋白,BCA 试剂盒测定细胞总蛋白浓度,经电泳、转模、封闭后,添加(1∶500)鼠抗人PCNA、Bcl-2、caspase-3、JNK、p-JNK、p-p38、p38一抗,以β-actin为内参,4 ℃过夜后,TBST洗膜3次,添加羊抗鼠二抗(1∶5 000)稀释液孵育2 h,TBST 洗膜,ECL化学发光法显色后,于凝胶成像仪中观察蛋白表达并保存图像。
1.3 统计学方法 运用SPSS 20.0 统计软件对数据进行分析,计量资料以± s 表示,多组数据比较采用单因素方差分析,进行方差齐性检验,组间有差异采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HDE 对肝癌QGY 细胞增殖的影响 与对照组比较,24 h 时HDE 组、阳性对照组QGY 细胞增殖增殖抑制率差异无统计学意义(P>0.05),48、72 h时20、40、80 g/L HDE 组、阳性对照组QGY 细胞增殖抑制率均显著升高(P<0.05);与阳性对照组比较,80 g/L HDE组QGY细胞增殖抑制率差异无统计学意义(P>0.05)。随着培养时间的延长,20、40、80 g/L HDE组、阳性对照组QGY细胞增殖抑制率显著升高(P<0.05)。见表1。
表1 QGY细胞增殖抑制率变化/(%,±s)

表1 QGY细胞增殖抑制率变化/(%,±s)
注:①与对照组比较,P<0.05。②与HDE(20 g/L)组比较,P<0.05。③与HDE(40 g/L)组比较,P<0.05。④与24 h 比较,P<0.05。⑤与48 h比较,P<0.05。
组别对照组阳性对照组HDE组6 20 g/L 40 g/L 80 g/L F值P值重复次数66 12 h 12.23±3.10 14.45±3.62 24 h48 h 16.56±3.15④19.27±3.33 60.43±17.09①②③④⑤64.63±17.15①②③④⑤36.56±10.03①④⑤50.59±13.87①②④⑤63.61±16.99①②③⑤12.50 0.000 12.36±3.13 13.15±3.17 13.78±3.33 0.50 0.739 33.37±11.36①④47.57±13.62①②④59.37±16.95①②③④11.48 0.000
2.2 细胞形态学观察 对照组QGY 细胞呈浅蓝色荧光,颜色分布均匀。经不同浓度的HDE 处理后的QGY 细胞72 h 后均呈现出明显的凋亡特征,随着浓度的增加,细胞数量逐渐减少,呈现浓缩致密的固缩形态或颗粒状态的凋亡细胞数增加,细胞核染色质聚集,断裂成块状,并伴有明显的细胞碎片形成。见图1。
2.3 不同浓度HDE 对肝癌QGY 细胞凋亡率的影响 与对照组(4.65±0.91)%相比,不同浓度HDE 组细胞凋亡率显著升高(P<0.05),且随HDE 浓度(20、40、80 g/L)升高细胞凋亡率逐渐升高[(15.83±3.11)%、(17.27±3.25)%、(20.69±4.03)%,P<0.05];与阳性对照组(20.73±4.05)%相比,HDE 为80 g/L时,细胞凋亡率差异无统计学意义(P>0.05)。
2.4 不同浓度HDE 处理对肝癌QGY 细胞增殖、凋亡相关蛋白表达影响 与对照组相比,HDE 组PCNA、Bcl-2 蛋白表达降低(P<0.05),Bax、caspase-3 蛋白表达升高(P<0.05),且呈剂量依赖性;与阳性对照组相比,HDE 为80 g/L 时,PCNA、Bcl-2、Bax、caspase-3 蛋白表达差异无统计学意义(P>0.05)。见图2,表2。
表2 不同浓度HDE处理对肝癌QGY细胞增殖、凋亡相关蛋白表达影响/±s
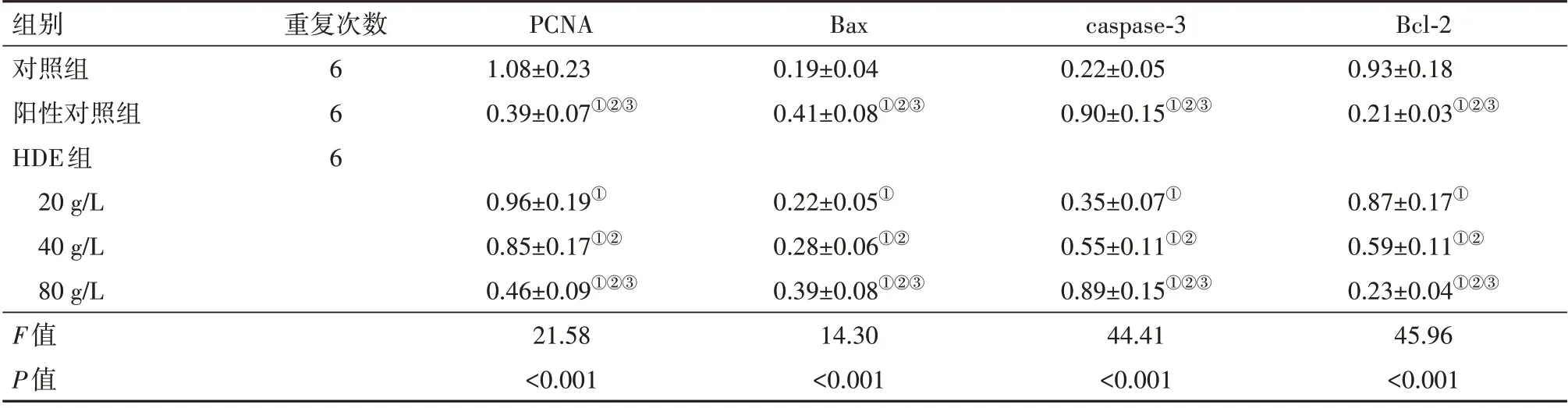
表2 不同浓度HDE处理对肝癌QGY细胞增殖、凋亡相关蛋白表达影响/±s
注:PCNA为增殖细胞核抗原,Bax为Bcl-2相关X蛋白基因,caspase-3为半胱氨酰天冬氨酸特异性蛋白酶3,Bcl-2为B淋巴细胞瘤基因-2。①与对照组比较,P<0.05。②与HDE(20 g/L)组比较,P<0.05。③与HDE(40 g/L)组比较,P<0.05。
组别对照组阳性对照组HDE组20 g/L 40 g/L 80 g/L值F P值重复次数666 PCNA 1.08±0.23 0.39±0.07①②③Bax 0.19±0.04 0.41±0.08①②③caspase-3 0.22±0.05 0.90±0.15①②③Bcl-2 0.93±0.18 0.21±0.03①②③0.87±0.17①0.59±0.11①②0.23±0.04①②③45.96<0.001 0.96±0.19①0.85±0.17①②0.46±0.09①②③21.58<0.001 0.22±0.05①0.28±0.06①②0.39±0.08①②③14.30<0.001 0.35±0.07①0.55±0.11①②0.89±0.15①②③44.41<0.001
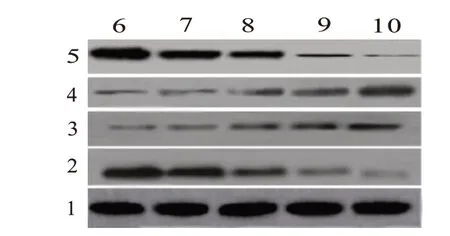
图2 不同浓度HDE处理对肝癌QGY细胞增殖、凋亡相关蛋白表达
2.5 不同浓度HDE处理对JNK/p38MARK通路相关蛋白表达影响 与对照组相比,HDE 组p-JNK、pp38 蛋白表达水平均显著降低(P<0.05),且呈剂量依赖;与阳性对照组相比,HDE 浓度为80 g/L 时,p-JNK、p-p38 蛋白表达差异无统计学意义(P>0.05)。见图3、表3。

表3 不同浓度HDE处理对JNK/p38MARK通路相关蛋白表达影响
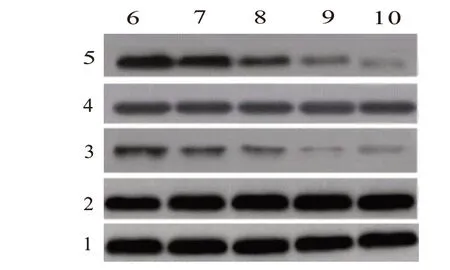
图3 不同浓度HDE处理对JNK/p38MARK通路相关蛋白表达影响
3 讨论
我国是肝癌高发国家之一,肝癌死亡率占我国全部恶性肿瘤死亡率的19%左右[8]。肝癌发病确切分子机制尚不清楚,多认为是多因素(如多基因突变、多条细胞信号传导通路、肿瘤新生血管生成异常等)、多环节过程[9-10]。目前,分子靶向治疗肝癌取得了一定成效,但化学抗肿瘤药物研发成本昂贵且有较大的毒副作用[11-12],因此从天然产物及中草药中挖掘低毒、高效抗肿瘤药物意义重大。
白花蛇舌草是茜草科植物,具有清热解毒、利尿消肿等作用,研究表明其对多种肿瘤细胞株具有诱导凋亡作用[13]。本研究发现当不同浓度HDE 作用于肝癌细胞株QGY,处12 h 时,细胞增殖抑制率与对照组差异无统计学意义,可能此时药物还未发生作用,当处理24 h、48 h 时,细胞增殖抑制率随浓度升高而增高,提示HDE 可抑制肝癌QGY 细胞增殖,且随HDE 浓度的增加增殖抑制率升高。细胞凋亡是一个错综复杂过程,有较多蛋白、基因参与细胞凋亡启动及执行过程,在肿瘤进展中发挥重要作用[14]。本研究通过Hoechest33258 荧光染色法观察得到,各浓度HDE 处理细胞48 h后均呈现出明显的凋亡特征,随着浓度增加,细胞数量逐渐减少,呈现浓缩致密的固缩形态或颗粒状态的凋亡细胞数增加,细胞核染色质聚集,断裂成块状,并伴有明显的细胞碎片形成。双染试验中不同浓度HDE 处理后QGY 细胞凋亡率均显著升高,且呈浓度依赖性,80 g/L HDE对QGY细胞凋亡率的影响与阳性对照组相当,提示HDE 可诱导HDE 细胞凋亡。PCNA 是一种酸性核蛋白,对调节DNA 的复制意义重大,其与细胞增殖密切相关,表达水平可在肿瘤癌变组织中显著上升[15]。Bcl-2 是一种原癌基因,能抑制细胞凋亡[16]。Bax 是Bcl-2 家族中最主要的促进凋亡蛋白[17]。caspase3 是凋亡途径关键执行者[18]。本研究进一步探究显示,HDE 处理组PCNA、Bcl-2 蛋白表达降低,Bax、caspase-3 蛋白表达升高,且呈剂量依赖性,提示HDE 可抑制肝癌QGY 细胞增殖、诱导凋亡。
MAPK 通路是一种重要的肿瘤信号转导通路,通常由JNK、p38 通路和细胞外信号调节激酶等通路组成[19-20]。贾蕾蕾、王爱玲[21]研究结果显示,棉子酚可能通过MARK 信号通路中ERK、p38 的激活,缓解再灌注心肌组织氧化应激损伤及凋亡损伤。本研究HDE 处理后,p-JNK、p-p38 蛋白表达水平均显著降低,且随HDE 浓度的增加而降低,猜测HDE 能显著抑制JNK、p38 蛋白磷酸化,抑制JNK、p38 信号通路激活,进而发挥抑制QGY 细胞细胞增殖、促进QGY细胞细胞凋亡的抗肿瘤作用。
综上所述,HDE能抑制人肝癌细胞株QGY细胞增殖,促进QGY 细胞凋亡,可能是通抑制JNK、p38MAPK 信号通路活化实现的。但本研究也存在一定不足,肝癌是多途径过程,抑制MAPK通路激活可能仅为其中一条途径,对HDE 抑制QGY 细胞增殖,促进凋亡的潜在机制尚有待进一步探索。
(本文图1见插图8-1)

