羊栖菜多糖对3T3-L1前脂肪细胞增殖的影响及其机制
杨旭东 石 杰 杨骄霞 王桂云 宋高臣 张 杰*
随着生活水平的提高,肥胖的发病率急剧增高,肥胖导致的代谢紊乱进一步引起的冠状动脉粥样硬化性心脏病、糖尿病、动脉粥样硬化、脂代谢紊乱等疾病增多[1]。脂肪组织不仅是重要的能量储存库,也是重要的内分泌器官,因此控制脂肪细胞的数目,抑制脂肪细胞过度分化,诱导脂肪细胞凋亡成为治疗相关疾病的靶点。食用海藻羊栖菜隶属于褐藻门、马尾藻属。羊栖菜多糖(sargassum fusiforme polysaccha- ride,SFPS)是羊栖菜主要成分之一,研究发现SFPS具有降血糖、降血脂、抗肿瘤、抗衰老、抗凝血、抗疲劳等作用[2-4],但SFPS 对脂肪细胞增殖活性的影响及其机制未见报道。本研究就羊栖菜中多糖成分SFPS 对3T3-L1 前脂肪细胞的抑制作用进行分析,并初步探讨其作用机制,为SFPS 进一步应用提供一定的实验依据。
1 材料与方法
1.1 材料
细胞株:3T3-L1 前脂肪细胞购买于美国ATCC公司,在液氮中保存备用。
药品及试剂:DMEM 高糖培养液、Trizol 和胰蛋白酶购买于美国Gibco 公司,MTT 试剂盒购买于索莱宝有限公司;核苷酸引物购买于上海生工生物技术有限公司;Hoechst33258 试剂盒购买于百浩生物科技有限公司。
仪器:CO2恒温培养箱为德国Thermo 公司,酶标仪为美国Biotek 公司,倒置显微镜为德国Leica公司,凝胶成像系统为美国Bio-Rad 公司。
1.2 方法
1.2.1SFPS的制备用水煮醇沉法提取羊栖菜粗多糖[5],200 目粉碎羊栖菜,水煮3 次,95%乙醇沉淀,得到深褐色粗多糖,Sevag 法去除蛋白成分,经过SephadexG200 凝胶柱双蒸水洗脱纯化。苯酚-硫酸法测定多糖含量,测得提取的多糖含量为55.13%。
1.2.2 细胞培养根据参考文献[6],3T3-L1 前脂肪细胞37 ℃ 5% CO2培养于DMEM 高糖培养基(100 mg/L链霉素、100 IU/L 青霉素、10%胎牛血清)。
1.2.3MTT实验对数生长期3T3-L1 前脂肪细胞以2×104/ml 的浓度接种于96 孔板,培养12 h 后,将细胞分为对照组和不同剂量SFPS 组,对照组加入细胞培养液,不同剂量SFPS 组分别加入400、600、800 mg/L 的SFPS 细胞培养液,每组6 个平行孔。继续培养24、48、72 h 后,各组细胞加入5 g/L MTT(10 μl/孔),培养4 h 后,弃上清,每孔加入150 μl二甲基亚砜(DMSO),轻微振荡15 min,完全溶解结晶物。酶标仪测定490 nm 处光密度值(OD)值,计算细胞相对活力。细胞相对活力(%)=实验组 OD 值/对照组OD 值×100%。
1.2.4 细胞凋亡率的测定3T3-L1 前脂肪细胞以5×104/ml 的浓度接种于24 孔板,培养24 h 后,每孔加入不同浓度的SFPS,每组6 个复孔,继续培养48 h,各组细胞吸弃培养液,加入固定液4 ℃固定10 min,吸弃固定液,磷酸盐缓冲液(PBS)冲洗2 遍,加入5 mg/L Hoechst 33258 染色液37 ℃染色15 min,吸弃染色液,PBS 冲洗2 遍。荧光显微镜下观察凋亡细胞,荧光标记的凋亡细胞呈蓝色深染。凋亡率(%)=[凋亡细胞/(凋亡细胞+正常细胞)]×100%。
1.2.5 实时荧光定量逆转录一聚合酶链反应(RT-PCR)测定Bcl-2、Bax 和Caspase-3 表达各组细胞分别加入0、400、600、800 mg/L 的SFPS,每组6 个复孔,培养24 h 后,吸弃细胞培养液后清洗细胞,提取细胞RNA。按逆转录试剂盒操作,提取各组RNA 逆转录合成cDNA。PCR 反应条件,95 ℃预变性30 s,进入PCR 循环,95 ℃变性10 s,60 ℃退火30 s,共35 个循环。β-actin 为内参基因,计算Bcl-2/β-actin、Bax/β-actin 和Caspase-3/β-actin 的灰度比值为目的基因mRNA 相对表达量。Bcl-2、Bax 和Caspase-3 的引物序列见表1。
1.3 统计学分析
采用SPSS 18.0 统计软件进行数据分析,计量资料以±s表示,组间差异比较采用方差分析,两两比较采用LSD 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SFPS 对3T3-L1 前脂肪细胞活力的影响
SFPS 分别处理3T3-L1 前脂肪细胞24 h、48 h和72 h 后,MTT 法测定细胞活力。与对照组比较,SFPS 处理3T3-L1 细胞24 h 和48 h,SFPS 600 mg/L组和SFPS 800 mg/L 组细胞活力显著降低,且SFPS 800 mg/L 组细胞活力明显低于其他各组,差异有统计学意义(P<0.05);与对照组比较,SFPS 处理3T3-L1 前脂肪细胞72 h 后,SFPS 400 mg/L 组、SFPS 600 mg/L 组和SFPS 800 mg/L 组细胞活力显著降低(P<0.05),且SFPS 800 mg/L 组细胞活力明显低于其他各组(P<0.05)。见表1。
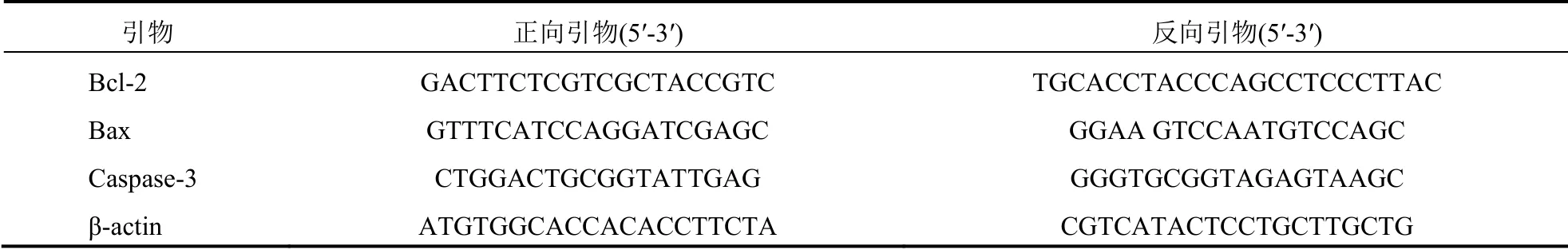
表1 Bcl-2、Bax 和Caspase-3 的引物序列
表1 SFPS 对3T3-L1 前脂肪细胞活力的影响(n=6,±s)
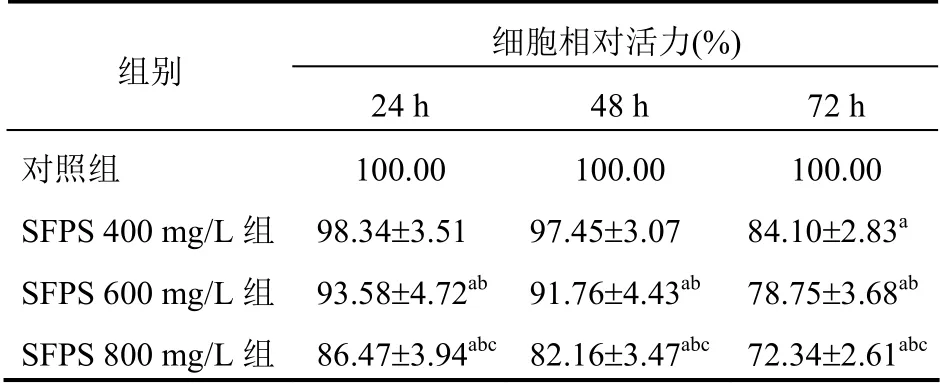
表1 SFPS 对3T3-L1 前脂肪细胞活力的影响(n=6,±s)
注:与对照组比较,aP<0.05;与SFPS 400 mg/L 组比较,bP<0.05;与SFPS 600 mg/L 组比较,cP<0.05
组别 细胞相对活力(%) 24 h 48 h 72 h 对照组 SFPS 400 mg/L 组 SFPS 600 mg/L 组 SFPS 800 mg/L 组 100.00 98.34±3.51 100.00 97.45±3.07 93.58±4.72ab 86.47±3.94abc 91.76±4.43ab 82.16±3.47abc 100.00 84.10±2.83a 78.75±3.68ab 72.34±2.61abc
2.2 SFPS 对3T3-L1 前脂肪细胞凋亡的影响
不同浓度的SFPS 作用于3T3-L1 前脂肪细胞48 h 后,荧光显微镜下可见蓝色深染体积缩小的凋亡细胞。SFPS 400、600、800 mg/L 组凋亡率分别为2.92%,6.34%,10.27%;对照组细胞凋亡率为1.35%。不同剂量SFPS 组与对照组比较差异有统计学意义(P<0.05)。见图1~4。

图1 对照组凋亡情况

图2 SFPS 400 mg/L 组凋亡情况

图3 SFPS 600 mg/L 组凋亡情况

图4 SFPS 800 mg/L 组凋亡情况
2.3 SFPS 对各组细胞中Bcl-2、Bax 和Caspase-3 mRNA 表达的影响
与对照组比较,SFPS 400 mg/L 组、SFPS 600 mg/L组和SFPS 800 mg/L 组Bcl-2 mRNA 表达显著降低(P<0.05),且SFPS 800 mg/L 组的Bcl-2 mRNA 表达明显低于其他各组,差异有统计学意义(P<0.05);与对照组比较,SFPS 400 mg/L 组、SFPS 600 mg/L组和SFPS 800 mg/L 组Bax 和Caspase-3 mRNA 的表达显著增加(P<0.05),且SFPS 800 mg/L 组的Bax和Caspase-3 mRNA 表达明显高于其他各组(P<0.05)。见表2。
表2 SFPS 对各组细胞中Bcl-2、Bax 和Caspase-3 mRNA表达的影响(n=6,±s)
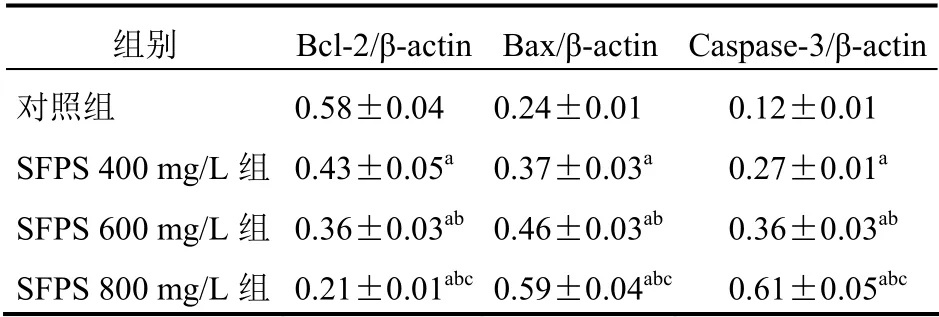
表2 SFPS 对各组细胞中Bcl-2、Bax 和Caspase-3 mRNA表达的影响(n=6,±s)
注:与对照组比较,aP<0.05;与SFPS 400 mg/L 组比较,bP<0.05;与SFPS 600 mg/L 组比较,cP<0.05
组别 Bcl-2/β-actin Bax/β-actin Caspase-3/β-actin对照组 SFPS 400 mg/L 组SFPS 600 mg/L 组SFPS 800 mg/L 组0.58±0.04 0.43±0.05a 0.36±0.03ab 0.21±0.01abc 0.24±0.01 0.12±0.01 0.37±0.03a 0.46±0.03ab 0.27±0.01a 0.36±0.03ab 0.59±0.04abc 0.61±0.05abc
3 讨论
SFPS 是从马尾藻科海藻羊栖菜中提取的水溶性多糖,主要由羊栖菜多糖硫酸酯、褐藻淀粉、褐藻酸和褐藻胶等组成。SFPS 具有抗菌、抑制肿瘤、增强免疫力和降脂等作用,本课题组前期实验也证实SFPS可降低3T3-L1 前脂肪细胞中游离脂肪酸和三酰甘油水平[7]。肥胖、糖脂代谢紊乱及脂肪细胞的过度增殖与一系列慢性疾病密切相关[8-9]。因此,本实验进一步研究SFPS 对3T3-L1 前脂肪细胞增殖的抑制作用,并初步探讨其作用机制。脂肪细胞数量增加是肥胖的原因之一,脂肪细胞数量受细胞凋亡和增殖等多方调控,在其病理生理过程中,细胞凋亡发挥重要的作用。细胞凋亡又称为程序性细胞死亡,是在精密调节下细胞自主有序的死亡过程,是一个主动过程,涉及一系列基因调控。本研究结果显示,与对照组比较,600、800 mg/L SFPS 可显著降低3T3-L1 前脂肪细胞增殖活力,显著升高其凋亡率,表明SFPS 可通过诱导3T3-L1前脂肪细胞凋亡,从而抑制增殖。
真核细胞的凋亡分为内源性、外源性和内质网应激途径,Caspase 蛋白酶家族在此过程中发挥重要作用,活化Caspase 家族,引起级联反应,从而进入凋亡程序。Caspase 家族中的Caspase-3 是激活内外源凋亡通路的启动因子,活化的Caspase-3 激活下游信号转导,启动凋亡。Bcl-2 家族是重要的调控凋亡基因家族,包括促凋亡基因Bax 和抑凋亡基因bcl-2[10]。Bcl-2 与Bax 是一对作用相互拮抗的同源性蛋白调控因子,可共同调控Caspase-3 活性,诱导或抑制细胞凋亡[11-12]。Bax 过表达时,通过同源二聚体Bax/Bax 增多,异源二聚体Bax/Bcl-2 比率上升[13-14],激活Caspase-3 活性,发挥促凋亡作用,Bax 是活化Caspase-3 的关键蛋白调节因子。抗凋亡基因Bcl-2可抑制Bax 的促凋亡作用,Bcl-2 与Bax 的比率决定其作用,如果异源二聚体Bcl-2/Bax 比率上升,则抑制细胞凋亡。本研究结果显示,与对照组比较,SFPS各剂量组能降低3T3-L1 前脂肪细胞中Bcl-2 的表达量,升高3T3-L1 前脂肪细胞中Bax、Caspase-3 的表达量,提示SFPS 通过改变Bcl-2 和Bax 相对比率,激活Caspase-3,引起级联反应,诱导3T3-L1 前脂肪细胞凋亡。
综上所述,SFPS 能够抑制3T3-L1 前脂肪细胞增殖,诱导其凋亡,并可以明显下调Bcl-2 基因的表达,上调Bax 和Caspase-3 基因的表达。体外实验结果提示,SFPS 抑制3T3-L1 前脂肪细胞增殖的分子机制可能与通过调控Bcl-2、Bax 和Caspase-3 表达,诱导启动细胞凋亡有关,为SFPS 进一步开发提供了理论依据。

