厘清来源 洞察关键 轻松突破
——以沉淀溶解平衡的三种图像为例
重庆 王 明
(作者单位:重庆市育才中学校)
化学实验题能充分体现化学的宏观(宏观实验现象)、微观(微观粒子反应过程)和符号(模型化的反应方程式)三重表征。除了上述的“三重表征”外,教师借助于手持技术和数学运算,还可以引入第四重表征,即函数图像。沉淀滴定的内容在教材正文中并未涉及,但人教版2019版高中化学选择性必修1第88页里已经出现沉淀滴定的课后习题,再结合近几年的高考试题命题特点,可以预见“沉淀滴定”和“沉淀溶解平衡”这两部分内容将继续成为命题的重要素材。在实际教学过程中,教师应该有意识地将酸碱中和滴定部分的知识特别是函数图像相关知识进行迁移。教师通过设计一系列的问题链,让学生建立认知模型,落实核心素养,达到将学生的能力和素养迁移并能创造性地去解决新问题的目的。
1.滴定过程中的图像
【图像来源】已知Ksp(AgI)=9×10-17,将0.1 mol·L-1的硝酸银溶液逐滴加入到10 mL 0.1 mol·L-1的KI溶液中。
(1)加入10 mL硝酸银溶液时,溶液中c(I-)是多少?
(2)加入9.98 mL硝酸银溶液时,溶液中c(I-)是多少?
(3)加入10.02 mL硝酸银溶液时,溶液中c(I-)是多少?
(4)绘制出将AgNO3溶液加入后混合溶液中-lgc(I-) 的变化示意图。
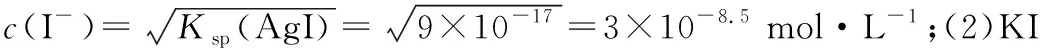

图1
【解题关键】曲线上的点应全部达到了溶解平衡状态(难溶电解质的Ksp通常较小,所以AgNO3溶液一加入通常会立即生成沉淀,溶液变为难溶电解质的饱和溶液);滴定终点就是按照化学计量数完全反应的点,c(I-)=c(Ag+);相同类型的离子沉淀,其他情况相同时,Ksp越小,滴定达到终点时对应的纵坐标越大(阴离子浓度负对数为纵坐标),具体图示如图2所示。
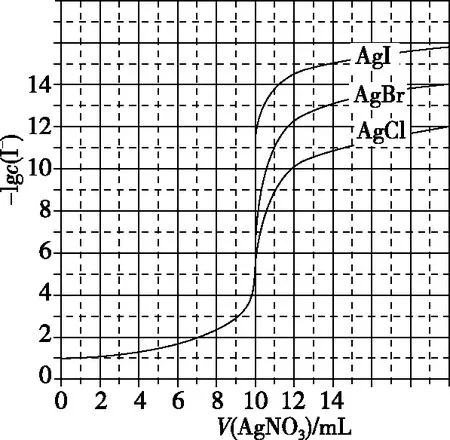
图2
【迁移应用】
【例1】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图3所示。下列有关描述错误的是

图3
( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动
【参考答案及分析】根据前文的分析可推知,滴定终点时c(Ag+)=c(Cl-)≈10-5mol·L-1,故A正确;选项B也明显正确;滴定达到终点时可列出计算式50.0 mL×0.040 0 mol·L-1=V(AgNO3)×0.1 mol·L-1,得出V(AgNO3)=20 mL,故C错误;AgBr溶度积比AgCl溶度积小,滴定达到终点时对应的纵坐标大,故D正确。综上所述,本题正确答案为C。
【拓展运用】用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图4所示。下列有关描述错误的是

图4
( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.06 mol·L-1Cl-,反应终点c向a方向移动
D.相同实验条件下,若改为0.06 mol·L-1Cl-,滴定终点前可能变为b曲线
【参考答案及分析】此题为2018年高考化学试题的改编,将图像上纵坐标换为了-lgc(Ag+)。通过计算,c点仍然为滴定的终点。结合前面的分析A、B均正确;达到滴定终点时,根据50.0 mL×0.060 0 mol·L-1=V(AgNO3)×0.1 mol·L-1,计算可得V(AgNO3)=30 mL,所以选项C正确;当改为滴定50 mL 0.06 mol·L-1Cl-时,加入等量的AgNO3溶液,混合溶液中c(Cl-)更大,曲线上的任意点状态均为AgCl的饱和溶液,根据Ksp(AgCl)=c(Ag+)·c(Cl-),能得出c(Ag+) 更小,-lgc(Ag+)更大,纵坐标上移,选项D错误。综上,本题正确答案为D。
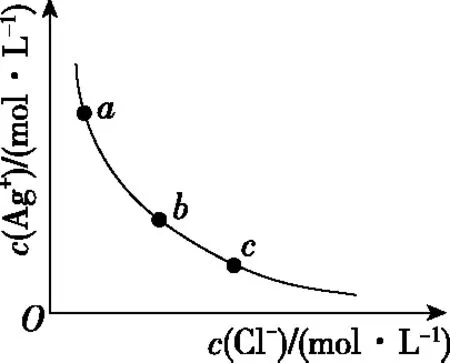
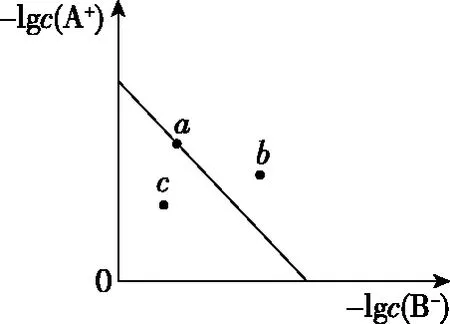
2.利用溶度积常数(Ksp)直接作图


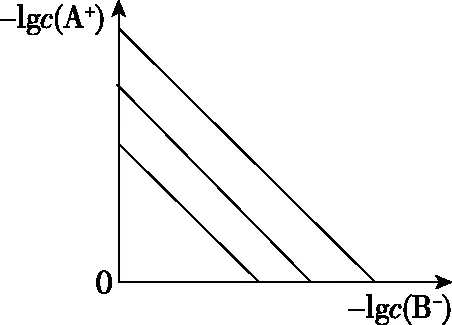
图5
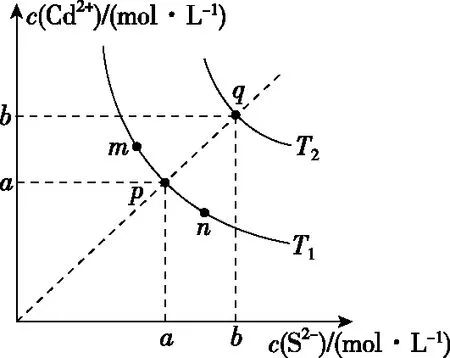
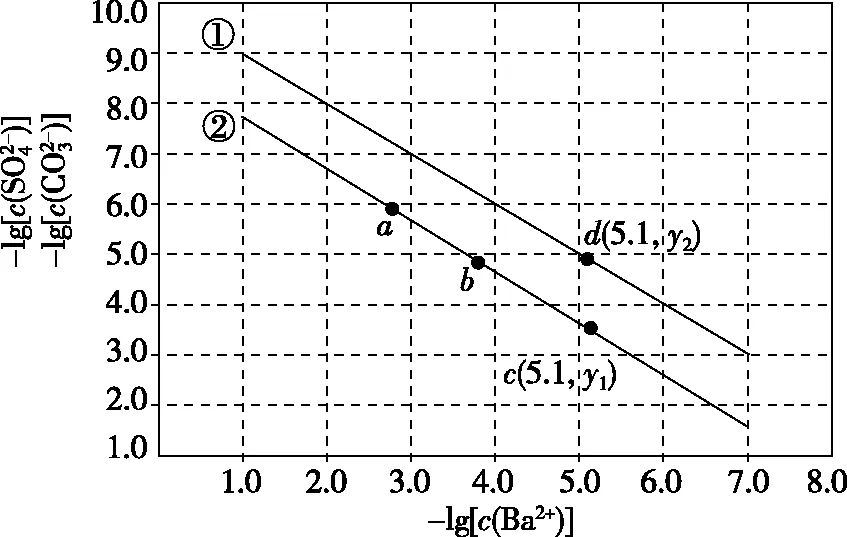
【解题关键】曲线上的点(如a)表示此时溶液的离子积等于溶度积,全部达到了同一温度下的平衡状态;b点溶液的离子积>溶度积,溶液过饱和,有晶体析出;c点溶液的离子积<溶度积,溶液未饱和;同一类型的离子沉淀,Ksp越大,曲线距纵轴越远,如图6(从左往右依次是AgI、AgBr、AgCl);温度越高,溶解度越大,Ksp越大,曲线距纵轴越远,如图6(从左往右依次是T1 图6 【迁移应用】 图7 ( ) A.a、b、c三点对应的Ksp相等 B.AgCl在c点的溶解度比b点的大 C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-) D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化 【参考答案及分析】曲线上的点都处于该温度下的平衡状态,Ksp为沉淀溶解平衡的平衡常数,只和温度有关,a、b、c三点对应的Ksp相等,A正确;b、c点对应的温度相同,Ksp相同,由b到c氯离子浓度增大,使AgCl的沉淀溶解平衡左移,故c点氯化银的溶解度比b点的小,B错误;AgCl溶于水形成的饱和溶液中c(Ag+)=c(Cl-),C正确;b点的溶液中加入AgNO3固体,相当于增大c(Ag+),溶解平衡逆向移动,c(Cl-)减小,故D错误。综上,本题正确答案为AC。 【拓展运用】(2019·全国卷Ⅱ·12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图8所示。下列说法错误的是 图8 ( ) A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n) C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 【参考答案及分析】结合前面的分析,容易得出选项A正确(物质的量浓度也能表示溶解度);m、n、p三点在同一条曲线上,所以Ksp(m)=Ksp(n)=Ksp(p),选项B错误;向m点的溶液中加入少量Na2S固体后,c(S2-)增大,Ksp不变,导致c(Cd2+)减小,所以溶液组成由m沿mpn线向p方向移动,选项C正确;温度降低,溶解度降低,所以q点的饱和溶液的组成由q沿qp线向p方向移动,选项D正确。综上,本题正确答案为B。 图9 【解题关键】直线上的点(如a)表示该点时溶液的离子积等于溶度积,全部达到了平衡状态;b点离子积<溶度积,溶液未饱和;c点离子积>溶度积,溶液过饱和,有晶体析出;同一类型的离子沉淀,Ksp越大,曲线越靠近坐标轴左边,如图10所示,若表示不同物质的Ksp曲线,从左往右三条直线依次表示AgCl、AgBr、AgI;温度越高,溶解度越大,Ksp越大,曲线越靠近坐标轴左边,如图10所示,若表示温度对Ksp的影响,三条直线对应的温度从左往右依次是T1>T2>T3。 图10 【迁移应用】 图11 ( ) A.曲线①表示BaCO3的沉淀溶解曲线 B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10 C.加适量BaCl2固体可使溶液由a点变到b点 【拓展运用】AgX为白色难溶物质,Ksp(AgX)=1.0×10-10;Ag2Y为砖红色难溶物。AgX和Ag2Y溶液中平衡时相关离子浓度的关系如图12所示,下列说法正确的是 图12 ( ) A.曲线②代表难溶物AgX溶液中平衡时相关离子浓度关系曲线 B.该温度下,Ag2Y的Ksp(Ag2Y)=1.0×10-14 D.用标准Ag+溶液滴定未知浓度的X-溶液时,可用K2Y溶液为指示剂 想要真正解决图像问题,首先需要“厘清来源”——落实核心素养,在此基础上才能“洞察关键”——创新应用。上述两方面的达成,需要化学与数学学科的深度融合,教学中教师应该对此有充分认识,并付诸于平时的教学活动中。这既是高考的考查要求,也是时代赋予化学教师的重任。

3.溶度积(Ksp)相关的对数图像



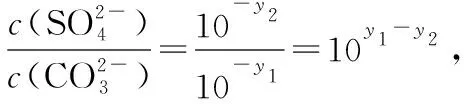



——饱和溶液与不饱和溶液

