二氢杨梅素对杂交鲟幼鱼的生长性能、肌肉品质及血清指标的影响
印双红,张先姝,朱 志,张孟琴,张俊波,3,毛 宏,易 萌,易彩霞,蔡春连
(1.铜仁学院大健康学院,贵州铜仁 554300;2.铜仁学院农林工程与规划学院,贵州铜仁 554300;3.铜仁学院,贵州省梵净山地区生物多样性保护与利用重点实验室,贵州铜仁 554300;4.铜仁学院材料与化学工程学院,贵州铜仁 554300;5.铜仁学院大数据学院,贵州铜仁 554300)
鲟是软骨硬鳞鱼,有“水中活化石”之称,全球现存2科6属27种,均处于不同程度的濒危状态。杂交鲟(♀×)是亚冷性鱼类,具有生长快、肉质鲜美和营养丰富等优点,是我国主要的鲟鱼养殖品种,深受消费者喜爱,养殖前景广阔。
天然中草药中的有效成分复杂,除含有抗菌、免疫物质外,还含有一些未知的促生长的活性物质及一定量的蛋白质、氨基酸、糖类等营养物质,这些成分可以增强食欲、促进机体代谢和消化酶分泌、提高营养物质利用率和降低水产动物的饲料系数。二氢杨梅素也称双氢杨梅素,是藤茶中的主要活性成分,化学名为苯并二氢吡喃-4-酮,分子式为CHO。研究表明二氢杨梅素具有消炎、镇痛、增强免疫力、抗氧化和抑菌等作用。二氢杨梅素在畜禽生长方面有较多的研究,而对杂交鲟生长性能、血清指标、肌肉品质等方面的影响尚未见报道。因此,本实验以杂交鲟幼鱼为研究对象,研究二氢杨梅素对杂交鲟幼鱼生长性能、血清生化及免疫指标、肌肉常规成分及氨基酸组成、肠道消化酶活性及微生物多样性的影响,为开发杂交鲟高效绿色环保饲料和二氢杨梅素在水产养殖上的应用提供依据。
1 材料与方法
1.1 实验设计及饲养管理
二氢杨梅素(含量98%)购于贵州苗药生物技术有限公司。配制4种饲料(表1):基础饲料组(D0)、0.15%二氢杨梅素组(D1)、0.3%二氢杨梅素组(D2)和0.6%二氢杨梅素组(D3)。原料粉碎过60目筛,逐级混匀,制成粒径为1.5 mm的颗粒饲料,室温通风干燥后,在-20 ℃冰柜存放。
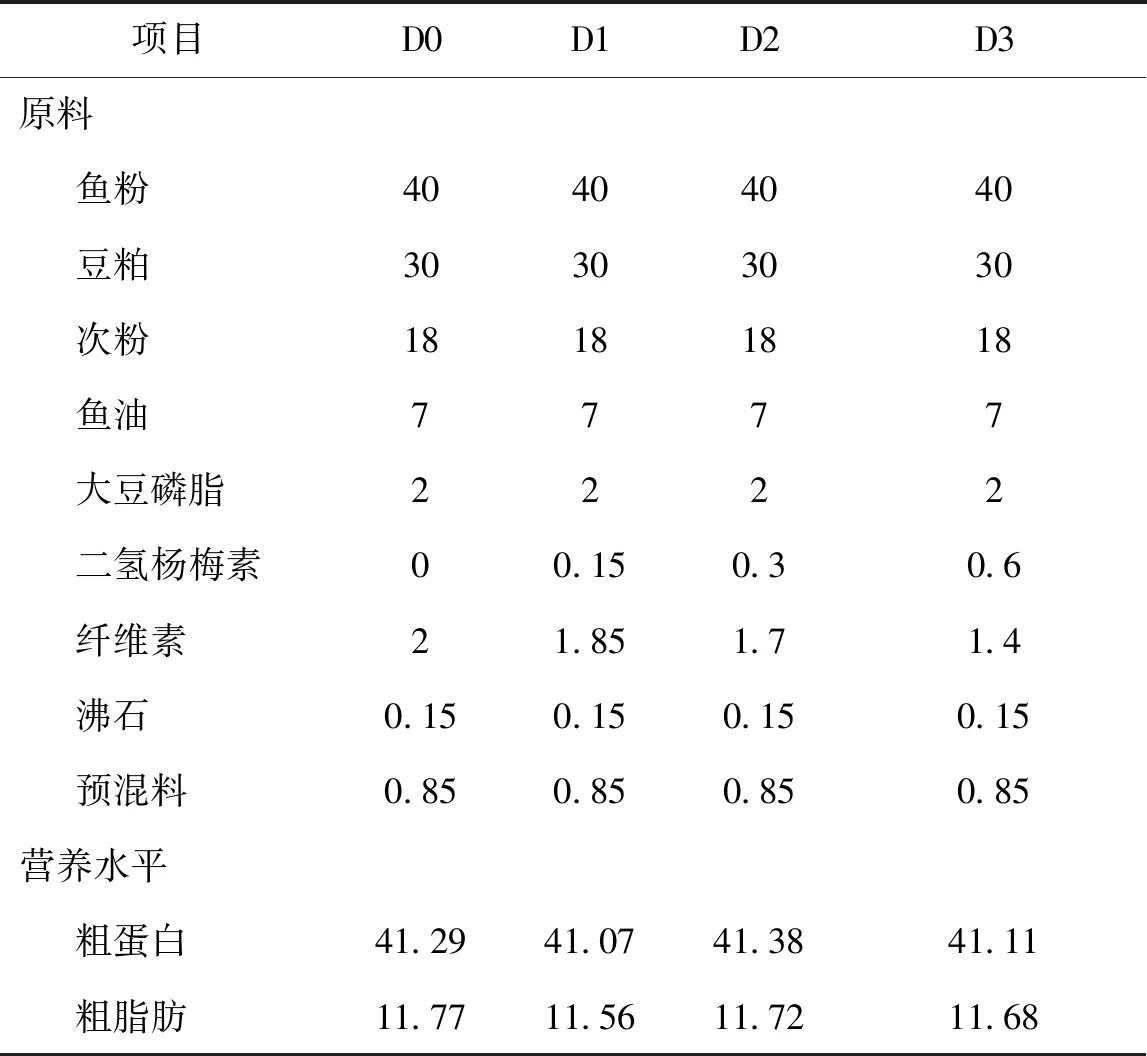
表1 实验饲料配方及营养组成Tab.1 Formula and nutritional composition of experimental diets %
杂交鲟幼鱼购于贵州省松桃吉光农业发展有限责任公司。实验前将杂交鲟幼鱼在水箱中驯养7 d。挑选(33.02±1.39)g/尾的180尾杂交鲟随机分配到12个水箱(120 cm×40 cm×40 cm)中,每组3个重复,每个重复15尾鱼。日投饵量为鱼体质量的2.0%~4.0%,投喂时间分别为08:00、14:00和20:00,每天换水1次,换水量为1/3,从2020年10月5日开始,养殖周期为60 d,实验期间溶解氧大于5 mg/L,氨氮小于0.05 mg/L,pH 7.5~8.0,水温为18.1~21.7 ℃;换水前后温差小于1 ℃。
1.2 样品的采集
实验鱼禁食24 h后,统计鱼的数量和体重,以计算生长指标。每箱随机取3尾鱼,用间氨基苯甲酸乙酯甲磺酸盐(120 mg /L)进行麻醉,从尾静脉采血,将血样置于试管中,于4 ℃条件下放置1 h,以3 500 r/min离心10 min,将上层血清分装于离心管中,用于测定血清的生化和免疫指标;取其背部肌肉用以测定肌肉常规成分及氨基酸组成;取其前肠,PBS冲洗,截取中间部分0.5 cm左右放入Bouin固定液中,制作肠道切片。为测定消化酶的活性,每箱随机取3尾鱼,取其整个肠道,称重,再加入9倍体积0.86%的预冷生理盐水,用匀浆机磨成匀浆,4 ℃、3 000 r/min离心10 min,取上清液,即得待测样品。为研究肠道菌群,每箱随机取3尾鱼,取其肠道内容物,迅速将样品放入液氮中保存。
1.3 生长指标的测定
生长指标计算公式为:
增重率(WGR)=100%×(-);
特定生长率(SGR)=100%×(ln-ln)/t;
成活率(SR)=(/)×100%,
式中,为终末体质量(g);为初始体质量(g);为实验时间(d);为终末尾数;为初始尾数。
1.4 肌肉常规成分的测定
粗蛋白质、粗脂肪、粗灰分、水分含量分别采用凯氏定氮法(GB/T 6432-1994)、索氏抽提法(GB/T 6433-1994)、550 ℃灼烧法(GB/T6438-1992)、105 ℃烘箱干燥法(GB/T 6435-2006)进行测定。
1.5 肠道消化酶、血清生化及免疫指标的测定
蛋白酶活力采用福林-酚试剂法测定,脂肪酶、淀粉酶、血清生化及免疫指标均采用南京建成试剂盒测定。
1.6 肠道组织切片制备及观察
制作肠道组织切片,利用Image pro plus 6.0软件统计分析皱襞高度和肌层厚度。
1.7 氨基酸组成的测定
酸水解法处理肌肉,氨基酸分析参照国家标准(GB/T 5009.124-2003),由日立L-8900型全自动氨基酸分析仪测定17种氨基酸的组成。
1.8 肠道微生物菌群分析
提取样品总DNA并送北京百迈客生物科技有限公司进行建库和高通量测序。
1.9 数据处理
实验结果采用统计软件SPSS25.0中的单因素方差分析(ANOVA)、最小显著极差法(LSD)和Duncan′s多重比较法进行差异显著性分析,所有结果均以平均值±标准差(mean±SD)表示,<0.05为差异显著。
2 结果
2.1 饲料二氢杨梅素水平对杂交鲟生长性能的影响
如表2所示,与D0相比,D3杂交鲟的增重率和特定生长率均显著降低,其它各组间无显著性差异;各组杂交鲟的成活率无显著性差异。
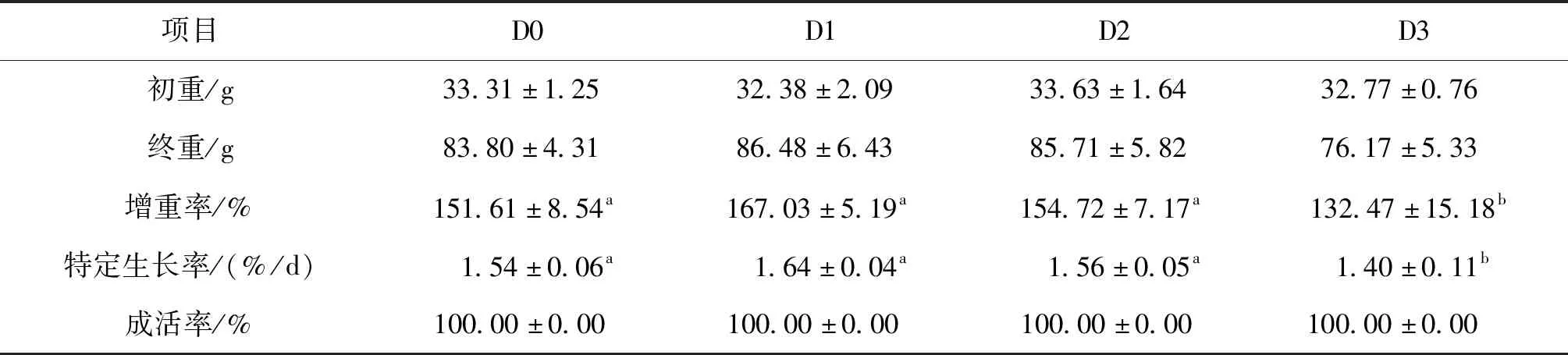
表2 饲料二氢杨梅素水平对杂交鲟生长性能的影响Tab.2 Effects of dietary dihydromyricetin levels on the growth of hybrid sturgeon
2.2 饲料二氢杨梅素水平对杂交鲟血清生化及免疫指标的影响
2.2.1 血清生化指标的测定
如表3所示,D1血清中总胆固醇、白蛋白和葡萄糖水平均显著高于D0;D2血清中谷草转氨酶水平显著低于D0,而白蛋白和葡萄糖水平均显著高于D0;D3血清中谷草转氨酶、白蛋白和甘油三酯水平均显著高于D0。
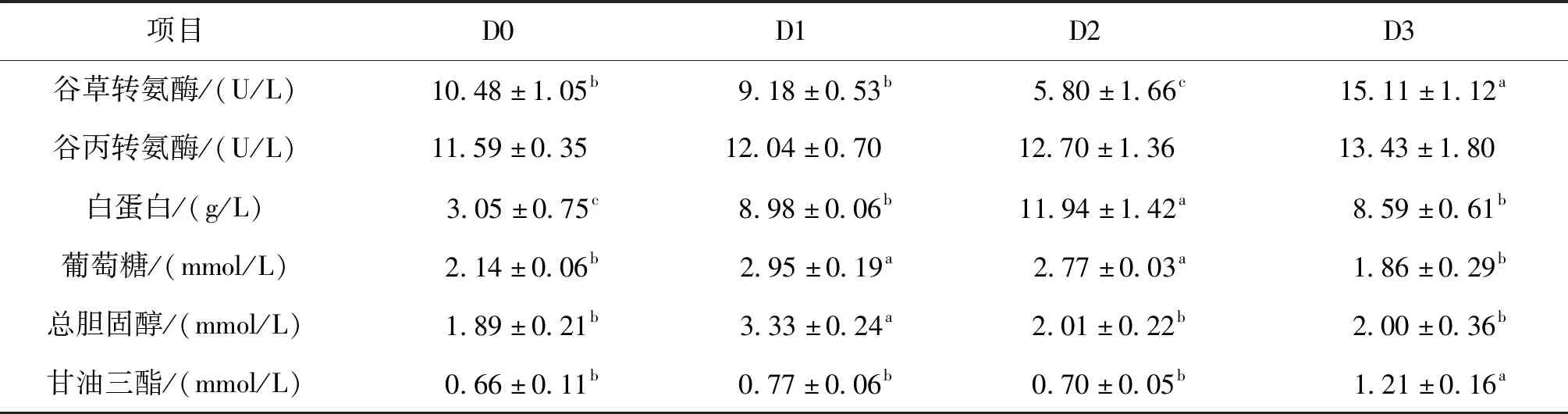
表3 饲料二氢杨梅素水平对杂交鲟血清生化指标的影响Tab.3 Effects of dietary dihydromyricetin levels on serum biochemical indexes of hybrid sturgeon
2.2.2 血清免疫指标的测定
如表4所示,各实验组血清中碱性磷酸酶、过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶和总抗氧化能力均显著高于D0;并且,D3血清中碱性磷酸酶活性显著高于D2,D1和D2血清中谷胱甘肽过氧化物酶活性显著高于D3,D2血清中超氧化物歧化酶活性显著均高于D1和D3。D2和D3血清中溶菌酶活性均显著高于D1和D0。
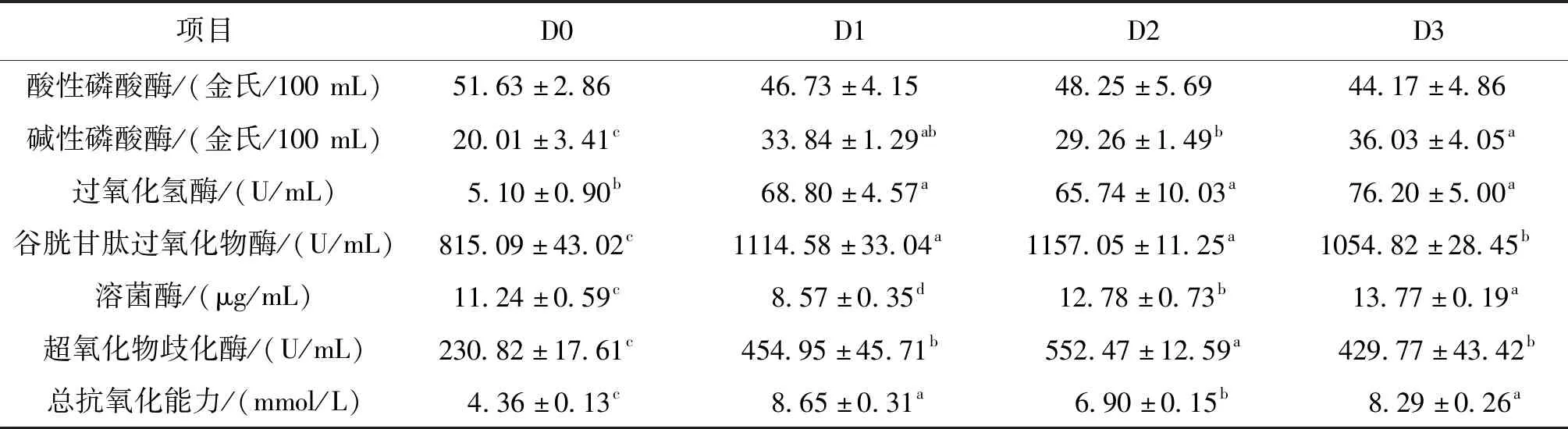
表4 饲料二氢杨梅素水平对血清免疫指标的影响Tab.4 Effects of dietary dihydromyricetin levels on serum immune indexes of hybrid sturgeon
2.3 饲料二氢杨梅素水平对杂交鲟肠道消化酶活性的影响
如表5所示,D1和D2肠道中蛋白酶、淀粉酶和脂肪酶活性均显著高于D0;D3肠道中蛋白酶活性显著高于D0。D2肠道中蛋白酶、淀粉酶和脂肪酶活性均显著高于D1和D3。

表5 饲料二氢杨梅素水平对杂交鲟肠道消化酶的影响Tab.5 Effects of dietary dihydromyricetin levels on digestive enzymes in the intestine of hybrid sturgeon
2.4 饲料二氢杨梅素水平对杂交鲟肠道形态的影响
如表6所示,D1肠道皱襞高度显著高于对照组,而D2和D3相对于D0无显著性差异;各实验组肠道肌层厚度均无显著性差异。

表6 饲料二氢杨梅素水平对杂交鲟肠道形态的影响Tab.6 Effects of dietary dihydromyricetin levels on the intestinal morphology of hybrid sturgeon μm
2.5 饲料二氢杨梅素水平对杂交鲟肌肉常规成分及氨基酸组成的影响
2.5.1 肌肉常规成分的测定
如表7所示,各组间肌肉中水分、粗脂肪、粗蛋白和粗灰分的含量均无显著性差异。

表7 饲料二氢杨梅素水平对杂交鲟肌肉常规成分的影响Tab.7 Effects of dietary dihydromyricetin levels on the muscle components of hybrid sturgeon %
2.5.2 氨基酸组成的测定
如表8所示,各组杂交鲟肌肉中所含氨基酸种类齐全,均检测到17种氨基酸,其中含有人体必需氨基酸7种,包括苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸,总氨基酸含量为211.37~224.23 mg/g,其中D1含量最高;必需氨基酸含量为5.45~22.35 mg/g,其中赖氨酸含量最高;鲜味氨基酸含量为11.50~34.43 mg/g,其中谷氨酸含量最高;各组间肌肉中总氨基酸、必需氨基酸和鲜味氨基酸的含量均无显著性差异。
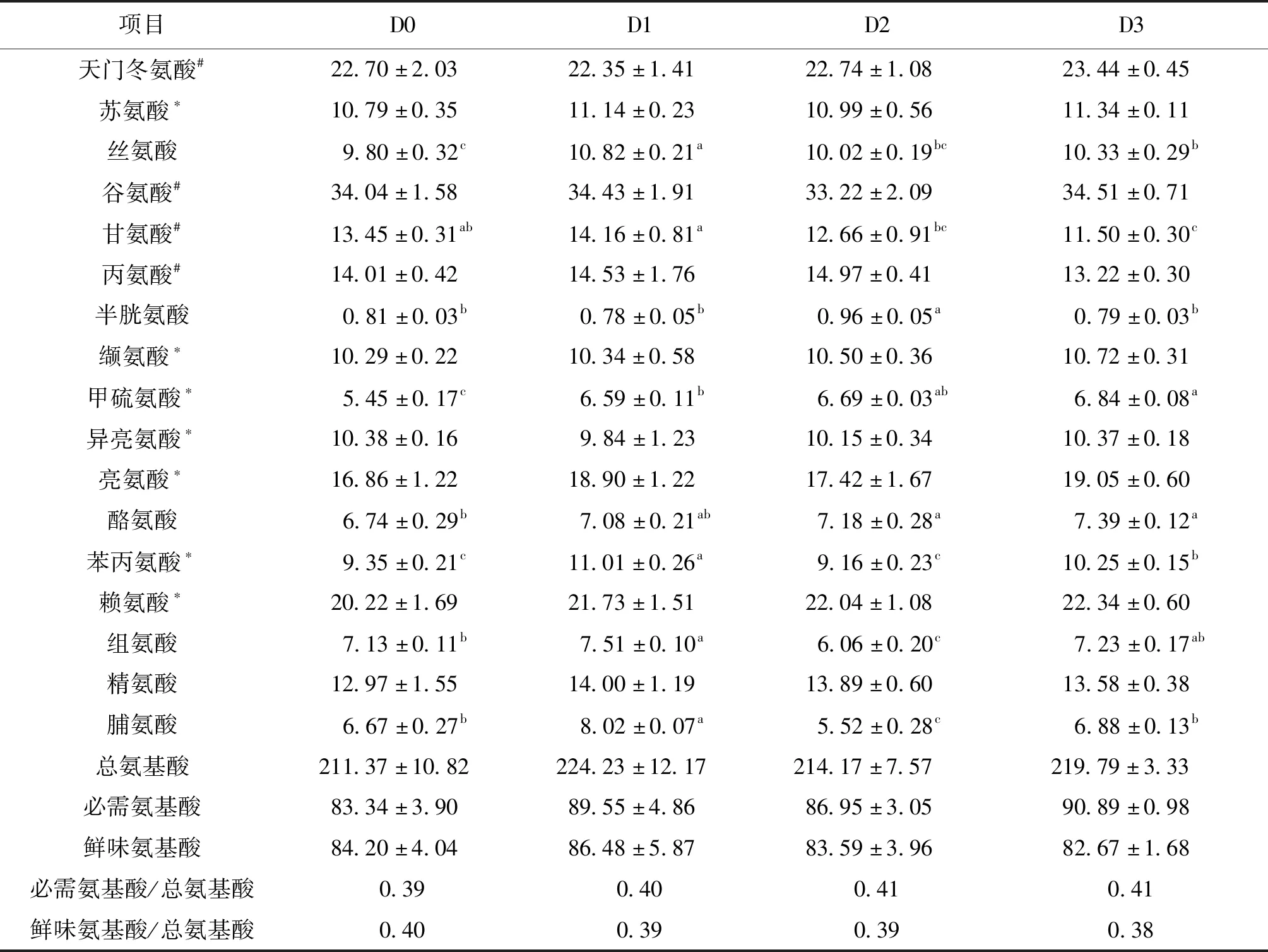
表8 饲料二氢杨梅素水平对杂交鲟肌肉氨基酸组成的影响Tab.8 Effects of dietary dihydromyricetin levels on the amino acid composition of the muscle of hybrid sturgeon mg/g
2.6 饲料二氢杨梅素水平对杂交鲟肠道微生物多样性的影响
2.6.1 肠道样本测序数据统计
如表9和图1所示,各组肠道内容物样本共获得825 863条序列,1 216个OTUs,其中有重叠OTUs 684个,占该总数的56.25%,因此,饲喂不同水平二氢杨梅素的杂交鲟肠道细菌群落具有一个核心的微生物菌群。
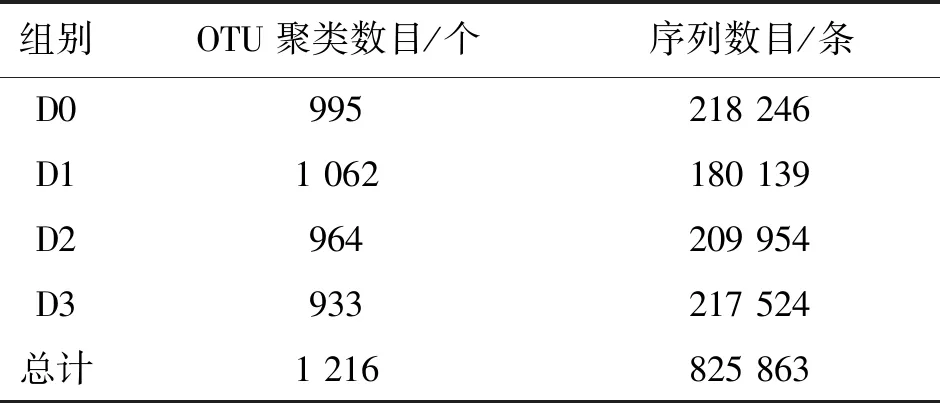
表9 样本16S rDNA测序数据统计Tab.9 Statistics of 16S rDNA sequencing data of samples
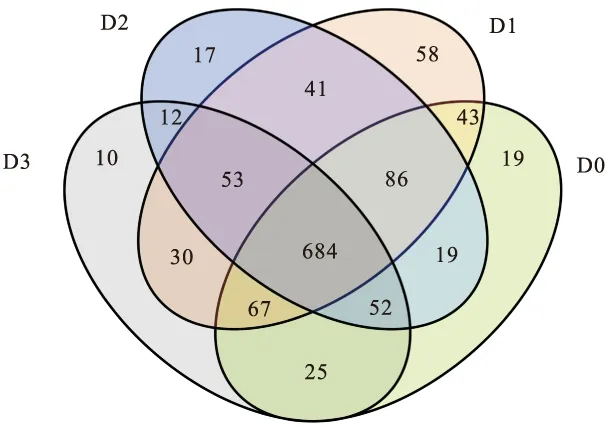
图1 肠道菌群OTU韦恩图Fig.1 OTU Venn diagram of intestinal flora
2.6.2 肠道菌群Alpha多样性分析
如表10所示,各组间的Ace指数、Chao1指数、香农指数和辛普森指数均无显著性差异;各组的覆盖率均在99%以上,表明已覆盖到样品中所有的物种。
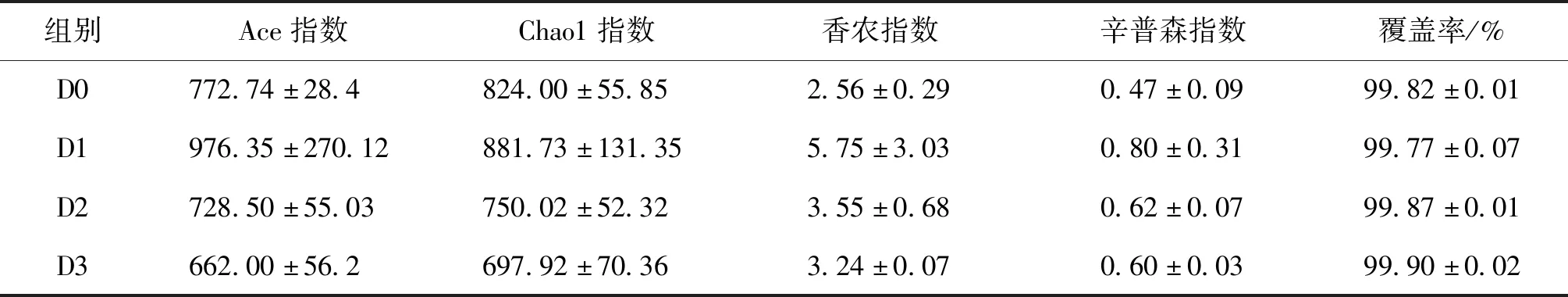
表10 样品的菌群多样性指数Tab.10 Alpha-diversity of samples
2.6.3 门分类水平上肠道菌群结构分析
如图2所示,各组肠道菌群在分类学上主要归属于9个门,分别是蓝细菌门(Cyanobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)、衣原体门(Chlamydiae)、螺旋体门(Spirochaetes)、放线菌门(Acidobacteria)和梭杆菌门(Fusobacteria);D0(Control)的优势菌门为蓝细菌门和软壁菌门,D1(TCC1)的优势菌门为蓝细菌门和厚壁菌门,D2(TCC2)和D3(TCC3)的优势菌门均为蓝细菌门和变形菌门;各组间优势菌门的组成比例存在差异。
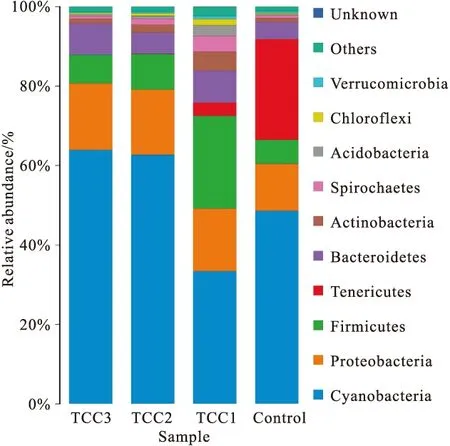
图2 门水平进行肠道菌群结构分析Fig.2 Structural analysis of phylum levels of intestinal flora
3 讨论
二氢杨梅素可提高畜禽生长和生产性能和饲料转化率,研究表明,日粮中添加0.05%二氢杨梅素显著提高肉鸡饲料转化率;饲料中添加0.075%~0.25%二氢杨梅素对鲤(L.)生长性能及形态指标均有促进作用。本实验发现,0.15%和0.3%组不影响杂交鲟生长指标,而0.6%组抑制杂交鲟的生长指标。
饲料中粗脂肪水平或能量水平与粗蛋白水平的关系决定着鱼类的生长。饲料中脂肪含量过高会造成鱼体内脂肪蓄积,对鱼体的增重产生负作用。机体氨基酸平衡状况决定了蛋白质的生物学价值,被食用肌肉中氨基酸组成比例和人体蛋白质氨基酸组成比例越接近,它的生物学价值越高。饲料的差异会影响鱼类氨基酸的组成和蛋白质的合成。研究表明,不同浓度的二氢杨梅素不影响鲤肌肉品质中的水分、粗蛋白、粗脂肪、灰分、总氨基酸含量,与本次实验得到的结果一致,表明二氢杨梅素也不影响杂交鲟的肌肉品质。
水产动物消化酶的活力与养殖动物的品种、生长阶段、环境、饲料组成等因素密切相关。日粮中添加二氢杨梅素0.025%、0.05%和0.1%可提高肉仔鸡()的消化酶(胰蛋白酶、糜蛋白酶、淀粉酶)的活性,并以添加0.1%二氢杨梅素的提高效果最佳。饲料中添加0.25%二氢杨梅素可以极显著提高鲤鱼肠道蛋白酶活性。本实验发现,0.15%和0.3%组肠道蛋白酶、淀粉酶和脂肪酶活性均显著升高,表明二氢杨梅素可显著提高杂交鲟消化酶活性。
血液生化指标的改变可反映动物机体的生理变化情况。血清甘油三酯和胆固醇水平能够反映出机体对脂类代谢状况,其含量的升高说明机体脂质代谢出现紊乱,甘油三酯和胆固醇水平升高是肝功能损伤的标志。本实验发现,0.3%组甘油三酯和总胆固醇水平无显著性变化,表明0.3%二氢杨梅素对杂交鲟幼鱼肝脏无损伤。谷草转氨酶和谷丙转氨酶是肝脏细胞中活性最强、分布最广的转氨酶,如果肝脏出现病变,肝细胞通透性会增大,酶即释放于血清中,因此血浆中谷草转氨酶和谷丙转氨酶含量可以作为肝功能的检测指标。日料中添加不同剂量的二氢杨梅素可提高瑶山鸡血清白蛋白含量,降低血清谷丙转氨酶和谷草转氨酶活性,提高溶菌酶活性。本实验发现,0.15%组谷草转氨酶和谷丙转氨酶活性无显著性变化;0.3%组的谷草转氨酶活性显著降低,同时谷丙转氨酶活性无显著性变化,表明0.15%和0.3%二氢杨梅素对杂交鲟幼鱼肝脏无损伤。
动物体内的酸性磷酸酶和碱性磷酸酶主要来源于肝脏,是机体代谢过程中重要的调控酶,常作为评价非特异性免疫性能的重要指标,其活性降低会导致非特异性免疫性能下降。本实验发现,各实验组血清中碱性磷酸酶均显著升高,表明二氢杨梅素可提高杂交鲟的非特异性免疫性能。超氧化物歧化酶和过氧化氢酶是存在生物体内非常重要的抗氧化防御性功能酶,保护机体免受氧化伤害。本实验发现,各实验组血清中超氧化物歧化酶活性均显著升高,表明二氢杨梅素可提高杂交鲟幼鱼的抗过氧化损伤能力。
肠道菌群既可以代谢机体的营养物质,又可以与机体相互作用产生各种代谢物质,其产生的代谢产物既能影响饲料营养素的高效利用,又能调控宿主的正常生理功能。研究表明,二氢杨梅素可不同程度改变小鼠()肠道菌群结构多样性,二氢杨梅素可提高小鼠体内拟杆菌门与厚壁菌门的相对丰度比值。本实验发现,不同水平的二氢杨梅素对杂交鲟肠道优势菌门有一定的影响。
综上所述,0.3%组的杂交鲟免疫水平增加且肝脏无损伤,因此,杂交鲟饲料中二氢杨梅素的建议添加量为0.3%。

