多线盘 精卵生物学特性及几种因子对精子活力的影响
杨 洋,李 林,白冠星,毕建启,万正平,陈 锋,梁银铨,张志明
(1.水利部中国科学院水工程生态研究所,水利部水工程生态效应与生态修复重点实验室,湖北省水生态保护与修复工程技术研究中心,武汉 430079;2.广西大藤峡水利枢纽开发有限责任公司,南宁 530000;3.广州珠江水资源保护科技发展有限公司,广州 510000)


1 材料和方法
1.1 试验鱼

1.2 精液采集
用干净的毛巾擦干雄鱼生殖孔附近及体表的水分后,将雄鱼包裹在毛巾内,暴露出生殖孔,轻轻从前往后挤压雄鱼腹部,使精子流出。采集精液要求无水、尿、血和粪便,精液呈乳白色,入水立即散开。每次采集的精液在20 min内完成相关检测,避免保存时间过长影响实验结果。从50尾雄鱼中随机挑选10尾,用无菌移液枪收集雄鱼精子置于灭菌烧杯中混匀,显微镜下立即观察,每次试验观测30次,结果用平均数±标准差表示。
1.3 精子形态观察及密度和pH测定
将精液用0.9% NaCl溶液分化10 min后用无水乙醇固定,HE染色,在Nikon Eclipse 80i显微镜(400×)下观察精子形态,测量精子头长、头宽和鞭毛长等指标。
用0.9% NaCl溶液稀释精液400倍,用血球计数板(上海求精生化试剂仪器有限公司XB.K.25.0.1 mm)在上光XSP-BM-8CA生物显微镜(100×)下计数,求出精子密度。

1.4 试验液的配置



1.5 精子活力观察
将精子运动状态划分为5个等级,分别为:激烈运动、快速运动、慢速运动、摇摆运动和死亡,以同一个视野内70%精子进入下一个时期来划分每个时期。从精子被激活到死亡的全部时间为精子寿命,在摇摆运动之前精子均能够使卵子受精,故将前三个运动总时间称为有效运动时间。
采集到的精液立即送至实验室,用移液枪吸取部分精液(<5 μL)于载玻片上,涂布均匀,放置于显微镜下,将显微镜调至可以观察到精子的合适位置(100×),用移液枪加适量实验液激活精子,记录时间并观察精子运动情况。本次实验仅记录有效运动时间、寿命和激活率(被激活精子数量占精子总数的比值称为激活率),观察结果以一个视野下精子为准。
由同一实验员进行精子活力、寿命及激活率的观测,并由另外一名实验员随机提供精子和实验液,避免观测实验员主观误差。
1.6 不同保存条件下多线盘 精子活力观察
采集到的精液立即送至实验室,各取1 mL原液分装于5个10 mL无菌离心管中。将其中4个分别存放于-20、-4、4 ℃和室温(18 ℃),另外一个添加9 mL蒸馏水配置的0.9% NaCl溶液(配置方法同上)混匀后也存放于室温(18 ℃)。每隔1 h观察各组精子活力(观察方法同上)并记录,直至每组精子活力均显著下降。
1.7 卵子的采集和形态学

1.8 繁殖力测定

1.9 统计分析
采用SPSS 17.0对本次试验的数据进行统计分析,采用Graph pad对处理后的数据进行图片的绘制。每组均测量30组数据,结果用平均数±标准差表示,<0.05判定为具有显著差异。
2 试验结果
2.1 精子密度、pH和形态学指标


图1 多线盘 精子形态Fig.1 The sperm morphology of D.multilineatus Cui
2.2 不同水体对精子活力和寿命的影响


图2 不同水体对多线盘 精子活力和寿命的影响(温度18 ℃)Fig.2 Effects of different water on sperm motility and sperm life span of D.multilineatus Cui(temperature 18 ℃)图标上方不同小写字母,表示存在显著性差异(P<0.05),下图同。
2.3 不同盐度对精子活力和寿命的影响


图3 不同盐度对多线盘 精子活力和寿命的影响(温度18 ℃)Fig.3 Effects of different salinity on sperm motility and sperm life span of D.multilineatus Cui(temperature 18 ℃)
2.4 不同pH对精子活力和寿命的影响

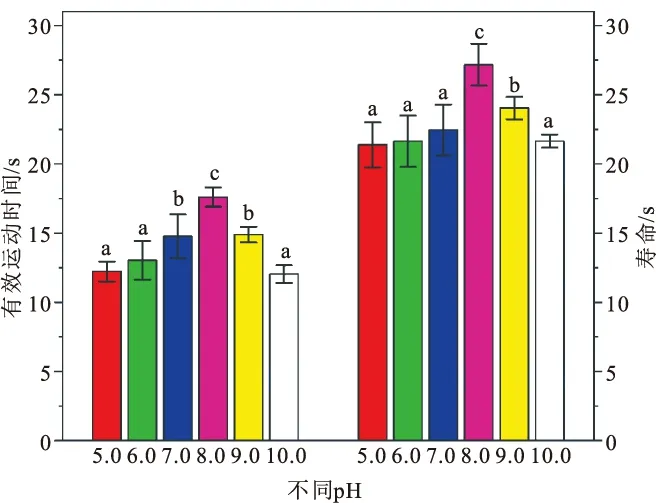
图4 不同pH对多线盘 精子活力和寿命的影响(温度18 ℃)Fig.4 Effects of different pH on sperm motility and sperm life span of D.multilineatus Cui(temperature 18 ℃)
2.5 不同保存条件下多线盘 精子活力和寿命


表1 不同保存方式下多线盘 精子活力和寿命Tab.1 Sperm motility and sperm life span of D.multilineatus Cui under different preservation methods
2.6 多线盘 卵的形态

2.7 多线盘 繁殖力



图5 多线盘 AF与SL、BW和OW的关系Fig.5 Regressions between AF and SL,BW,and OW in D.multilineatus Cui
3 讨论
3.1 多线盘 精卵生物学特性


3.2 多线盘 精子的适宜保存条件

3.3 多线盘 精子的适宜激活条件
鱼类精子释放至体外后,须遇水激活才具备使卵子受精的能力。大多数淡水鱼类精子被激活后寿命不足2 min,精子高度活跃具备受精能力的时间在30 s以内,精子激活后寿命和活跃时间与各种环境因子(盐度、pH、温度和水质等)密切相关,适宜环境条件下激活,可使精子具备更高的活力,从而能显著提高受精率。




