反硝化细菌的分离筛选及反硝化作用影响因素研究
宋玫滢,孙晓莉,王豆豆,林雅琪 ,刘 洋,2,3
(1.湖州师范学院生命科学学院,浙江湖州 31300;2.浙江省水生生物资源养护与开发技术研究重点实验室,浙江湖州 313000;3.新疆第二医学院基础医学部,新疆克拉玛依 834000)
从1986年到2016年,我国养殖业发展迅速,水产品产量从445万吨猛增加到5 142万吨。然而,随着水产养殖业的快速发展,水体中的残饵、粪便、水生动物尸体、渔药等物质大量增加,造成氮、磷以及其他有机物大量积累,导致水环境的污染,生态环境日趋恶化。水产动物的排泄物、残饵、尸体中,含有大量的蛋白质,被微生物分解后形成氨基酸,再进一步分解成氨氮,造成水体富营养化,同时亚硝酸盐大量积累,严重危害水生动物的健康养殖。这些问题已经成为制约水产养殖业健康可持续发展的重要因素。如何去除水体中的氨氮和亚硝酸盐,对于水产养殖业健康可持续发展和水环境保护意义重大。

目前发现的反硝化细菌分布于10个不同的科,且属于假单胞杆菌属、产碱杆菌属的较多。一直以来,厌氧反硝化细菌被认为是唯一能够进行反硝化作用的细菌。直到1983年,ROBERSTON等分离出了在有氧条件下能够进行反硝化作用的细菌()。NAOKI等研究检测到在有氧的环境下,有两株细菌能将硝酸盐还原,经鉴定后,属于有氧反硝化细菌。有氧反硝化细菌的发现有特殊意义,对其后续的研究也受到越来越广泛的关注。尽管已发现部分反硝化细菌,具有较好的反硝化作用,然而,寻找适应一些特殊环境条件的高效反硝化能力的菌株,对于解决水体富营养化和亚硝酸盐对水生动物的毒害,仍然具有十分重要的理论和实际研究意义。本研究通过采集活性污泥样品,并从中分离反硝化细菌,研究影响菌株反硝化作用的主要环境因素,为反硝化细菌在养殖废水处理应用中提供理论指导,具并有一定实际应用价值。
2 材料与方法
2.1 样品采集
用于分离反硝化细菌的活性污泥样品分别采自湖州凤凰污水处理厂、美欣达印染厂、大港印染厂生化池。
2.2 培养基和试剂
富集培养基Buhospgckud(g/L):(NH)SO2 g,FeSO0.2 g,KHPO1.0 g,MgSO0.5 g,NaCl2 g,CaCO5 g,pH 7.2,121 ℃灭菌20 min。
反硝化细菌分离培养基:采用Giltay培养基,具体配方详见参考文献[16]。
2.2 反硝化细菌的分离筛选
2.2.1 活性污泥预处理
将采集的活性污泥样品1 mL加入到装有9 mL、pH 7.2的磷酸盐缓冲液的100 mL烧杯中,用超声波发生器超声振荡1 min。
2.2.2 富集培养
将预处理过的活性污泥,用pH 7.2的磷酸盐缓冲液从10逐级稀释至10,取不同稀释度的样品液各1 mL,分别接种于含10 mL Buhospgckud培养基的试管中,每一稀释度重复接种3管,28 ℃培养20 d(不接种的对照管同时培养)。每隔3 d取样0.5 mL进行硝化和反硝化定性检测和稀释涂布。
2.2.3 硝化和反硝化细菌检测
用无菌移液管吸取不同浓度的试管培养液并加入到白色瓷板凹窝中,然后在其中分别加入Griess试剂(Ⅰ液和Ⅱ液各2滴)和二苯胺试剂(2滴)。出现红色为亚硝化细菌阳性管,出现蓝色为硝化细菌阳性管。在实验前,需先测定空白对照管液体中是否含亚硝酸盐或者硝酸盐。
2.2.4 稀释涂布
将富集后的样品,涂布在Giltay培养基上,每个稀释度涂布3个平皿。将涂布好的平板倒置在30 ℃恒温培养箱中培养3~5 d。观察菌落周围是否变蓝,挑取菌落周围变蓝的菌落进行划线纯化。刮取1~2环菌体细胞,放入已灭菌的装有800 μL的15%(v/v)甘油的Giltay液体培养基的菌种保藏管中,并将其放入-80 ℃冰箱进行菌株保藏。
2.2.5 产气实验
将10 mL Giltay液体培养基加入大试管(20 mm×200 mm)中,将杜氏小试管(5 mm×20 mm)倒立放入大试管中,小试管中的气体排净,121℃灭菌20 min后,冷却至室温后接入活化后的菌株,30 ℃恒温培养5~7 d,观察小管内是否有气泡产生。
2.2.6 菌株脱氮能力比较
将分离纯化的反硝化菌株按1%接种量,接种至100 mL新鲜的Giltay培养基中,30 ℃黑暗条件,静止(震荡)培养14 d,每隔2 d取样1 mL,测定菌体浓度OD和NO-N,NO-N浓度。每个实验3次重复。选取脱氮能力最高的菌株进行菌种鉴定。
2.3 菌种鉴定
菌株接种于Giltay培养基30 ℃培养72 h,观察菌落形态,进行革兰氏染色,在显微镜下观察菌体细胞的形态学特征。利用磁珠法快速提取基因组DNA,具体方法参考文献[17]。用16S rDNA引物进行扩增,PCR产物利用DNA试剂盒纯化后,送至上海生物工程公司进行测序。对已测得的序列提交GenBank进行序列比对,下载与目标菌株亲缘关系比较近的菌株的16S rDNA序列。利用Clustal W 1.81进行多序列比对,并用软件Mega 4.0进行分析,采用NJ法构建系统发育树。
2.4 反硝化细菌脱氮影响因素研究
2.4.1 温度对脱氮的影响
将该菌株接种于装有50 mL灭菌Giltay培养基的250 mL锥形瓶中,将培养温度分别设置为4、20、30、37、45 ℃,培养72 h后,测定菌体OD和样品中NO-N和NO-N浓度。每组实验设置3个重复,以未接菌的培养基做空白对照。
2.4.2 pH对脱氮的影响
将培养基初始pH分别设置为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。菌株接种后,放置于30 ℃培养120 h,分别于培养72 h后取样,测定菌体OD和样品中NO-N和NO-N浓度。每组实验设置3个重复,以未接菌的培养基做空白对照。
2.4.3 溶氧对脱氮的影响
将该菌株接种于Giltay培养基中,在最适培养温度30 ℃和pH培养,摇床转速设置为0、50、100、150、200 r/min,培养72 h后取样,测定菌体OD和样品中NO-N和NO-N浓度。每组实验设置3个重复,以未接菌的培养基做空白对照。
2.4.4 不同C源和硝酸盐浓度对脱氮的影响
将该菌株接种于Giltay培养基中,分别添加1%(w/v)的不同种类的碳源(乙酸钠、丁二酸钠、柠檬酸钠和葡萄糖)和不同浓度的NO-N(0.1,10,100,500,1 000 L),在最适培养温度30 ℃、pH和转速下培养72 h后进行取样,测定菌体OD和样品中NO-N和NO-N浓度。每组实验设置3个重复,以未接菌的培养基做空白对照。
2.5 分析方法
菌体浓度的测定采用移液枪吸取200 μL培养液样品放入酶标板中,再将酶标板放入酶标仪中,调整波长为600 nm,记录测量结果(每个样品取3个重复)。亚硝酸盐和硝酸盐含量的测定参照文献[18],分别采用N-1萘基-乙二胺光度法和紫外分光光度法。
3 结果与分析
3.1 反硝化细菌的分离筛选
从活性污泥中分离纯化得到44株反硝化细菌菌株,对其进行脱氮能力检测,挑选出四株脱氮能力较强的菌株,分别命名为A、B、G、H,其中菌株A和H脱氮能力最强,分别为67.04%,84.67%。将这四株菌株接种于10 mL Giltay液体培养基上进行产气试验,发现这四株菌株可以在杜氏小管内产气,在管顶部形成明显气泡。将这四株菌株保藏用于后续实验。
3.2 菌种鉴定
A、B、G、H四株菌株在含Giltay固体培养基的平板中的菌落形态见图1。A菌株为土黄色菌落,菌落较大,表面粗糙,边缘呈波浪型。B菌株菌落大小中等,呈白色,光滑,中间有凸起,边缘整齐。G菌株大小中等,圆形,呈蓝色,光滑,中间有凸起。H菌株菌落较小,圆形,白色,光滑,菌落中间有凸起。对脱氮能力最强的菌株A和H进行了16S rDNA扩增和测序,并在GenBank上进行序列比对分析,发现A菌株与的同源性高达99.65%(图2A),H菌株与的同源性高达99.72%(图2B)。因此这两株菌分别鉴定为A和H。

图1 反硝化细菌的分离筛选Fig 1 Screening and isolation of denitrifying bacteria

图2 反硝化细菌A菌株(A)和H菌株(B)的遗传进化树Fig.2 The phylogenetic tree of denitrifying bacteria strain A(A) and strain H(B)
3.3 反硝化细菌的脱氮影响因素研究
3.3.1 温度对脱氮的影响
由图3可知,A、B、G三株菌株在30 ℃条件下NO-N的浓度最低,表明去除率最高,分别为67.04%、50.14%、33.99%,H菌株在37 ℃条件下,NO-N的浓度最低,表明对NO-N的去除率最高,为84.67%(图3B)。A、B、G三株菌株在30 ℃条件下的菌体浓度最高,表明这三株菌株的最适生长温度为30 ℃;H菌株在37 ℃条件下的菌体浓度最高,表明其最适生长温度为37 ℃(图3A)。
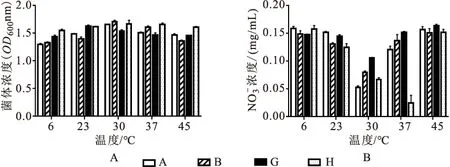
图3 菌株在不同温度的生长情况和对的去除效果Fig.3 The effects of nitrate removal on different temperatures by the strain
3.3.2 pH对脱氮的影响
有图4可知,在pH 6.0的情况下A、B、G、H四株菌株对培养基中NO-N的浓度最低,表明去除率最高,分别为57.10%,42.21%,33.79%,64.31%(图4B),其菌体浓度也最大(图4A)。菌株的最适培养温度和最适pH条件下,H菌株的去除率高于其他菌株,为64.31%。

图4 菌株在不同pH的生长情况和对的去除效果Fig.4 The effects of nitrate removal at different pH by the strain
3.3.3 溶氧对脱氮的影响
由图5可见,A、B两株菌株在静止情况下培养基中NO-N的浓度最低,表明去除率最高,分别为36.17%,33.43%;G菌株在转速为100 r/min的情况下,NO-N的浓度最低,表明去除率最高,为29.23%;H菌株在转速为50 r/min的情况下,NO-的浓度最低,表明去除率最高,为42.91%(图5B)。菌株A、B在静止情况下,菌体浓度最高,菌株G在转速为100 r/min条件下,菌体浓度最高(图5A)。表明A、B两株菌株需要在厌氧条件下进行反硝化作用,G、H两株菌株可以在有氧条件下脱氮,H菌株在有氧条件下的脱氮能力高于其他三株菌株。
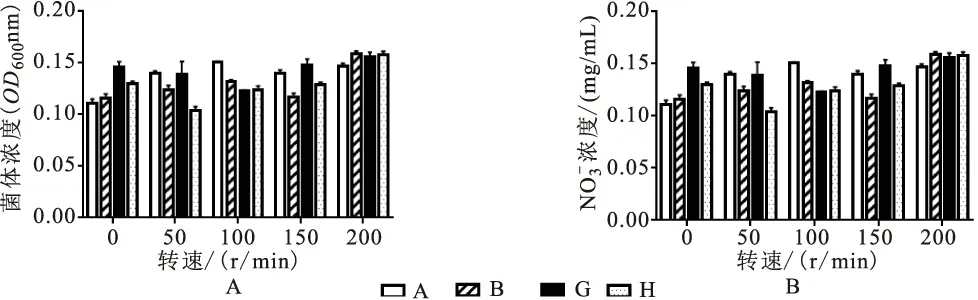
图5 转速对菌株去除效果Fig.5 The effects of rotation speed on nitrate removal
3.3.4 碳源对脱氮的影响
由图6可知,A、B、G、H四株菌株均在柠檬酸钠的环境下对培养基中NO-N的浓度最低,表明去除率最高,分别为31.76%、31.49%、24.18%、41.15%,H菌株培养基NO-N浓度最低,表明去除率高于其他菌株(图6B)。菌株A、H在以柠檬酸钠和丁二酸钠为碳源的培养基上,菌体浓度明显高于其他两株菌株,在这两种碳源的培养基上菌体浓度高于其他碳源(图6A)。
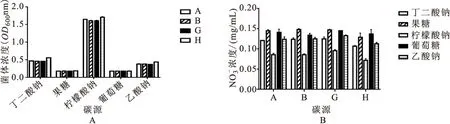
图6 碳源对菌株生长和去除效果Fig.6 The effects of carbon resources on stain growth and nitrate removal
3.3.5 硝酸盐浓度对脱氮的影响:
研究了菌株H在不同硝酸盐浓度情况下的菌株脱氮情况,结果发现随着培养基中硝酸钾的浓度升高,高于1 g/L时,菌株脱氮速率在提高为71.78%,随着培养基中硝酸盐浓度上升,菌株的脱氮能力下降较快。这可能是过高的硝酸盐浓度对菌株生长造成毒害,使得其脱氮效率下降(图7)。

图7 硝酸盐浓度对菌株去除硝酸盐影响Fig.7 The effects of nitrate concentrations on nitrate removal
4 讨论
本研究从污水处理厂的活性污泥中分离筛选得到两株具有高效反硝化细菌,其中菌株H为,该属的微生物菌种被发现在土壤中广泛存在,有耐盐性和生长pH宽等特点。反硝化作用会受到环境因子(温度、pH、溶氧、碳源和氮源浓度)影响,如何发挥反硝化细菌的性能,需要对反硝化细菌的反硝化特性进行深入研究。
本研究进一步研究了环境因子、C/N源种类和浓度对于菌株反硝化作用的影响,发现A、B、G三株菌株在30℃下培养脱氮能力最强,H菌株在37℃下培养脱氮能力最强。温度对于菌株脱氮能力有重要影响,这与前人报道的研究结果一致。A、B、G、H四株菌株在培养基pH值为6.0的条件下脱氮能力最强,pH高于或低于6.0都会显著影响菌体生长和菌株对硝酸盐的利用。pH对于菌株的反硝化作用有重要影响。大多数反硝化作用发生在厌氧环境中,有少部分细菌可以在有氧条件下进行反硝化作用。本研究发现反硝化细菌G菌株和H菌株分别在转速为100 r/min和50 r/min的条件下脱氮能力最强,属于好氧反硝化细菌。菌株A和B在静止条件下,反硝化能力较强。反硝化细菌脱氮能力受到溶氧浓度影响,过高或者过低的溶氧浓度影响菌株的脱氮能力。
碳源对于菌株的脱氮有重要影响,部分反硝化细菌需要在一定碳源浓度条件下,进行反硝化作用,碳源的种类对于反硝化作用影响明显。本研究发现A、B、G、H四株菌株均在以柠檬酸钠为碳源的环境下,脱氮能力最强,与周梦娟等报道的结果一致,也有其他研究报道以葡萄糖、琥珀酸为碳源时菌株脱氮能力最强。不同的菌株所需利用碳源种类不同,说明碳源能为异养型反硝化细菌提供生长所需的能量,以及反硝化过程中的电子供体,能影响反硝化细菌的生长和脱氮能力。
本研究发现H菌株在硝酸盐浓度高于50 g/L的环境下,脱氮速率下降,菌体生长缓慢,与李文甫报道的结果有些不同。但是本实验设置的硝酸盐浓度最低为1g/L,而大于500 mg/L,李文甫报道的菌株在500 mg/L最低硝酸盐浓度的条件下脱氮能力最强。硝酸盐浓度也会影响菌株的反硝化速度,不同反硝化细菌脱氮能力有差异,适宜的硝酸盐浓度环境下脱氮才能取得较好效果。
反硝化细菌高效的脱氮效率不仅需要反硝化细菌的活性强,生长速度快,还要求反硝化细菌在合适的环境条件下。本实验分离筛选获得的反硝化细菌与商品化反硝化菌剂相比,反硝化效率略低。商品化的反硝化菌剂其菌种成分一般不是单一菌株,复合菌剂的反硝化效果可能优于单一菌种。由于课题研究时间所限,本研究分离筛选到的反硝化细菌应用于实际养殖废水的净化处理还在进行之中。另外,关于H 菌种的反硝化代谢途径研究还需进一步深入研究。
感谢张荣飞老师对本课题研究提供仪器培训方面的资助。感谢参与课题研究的朱佳娜同学。

