帕博丽珠单抗联合化疗致骨转移完全缓解1例并文献复习
沈若怡 沈旦 黄建安
帕博丽珠单抗是一种针对PD-1的单克隆抗体,作为免疫检查点抑制剂,广泛应用于恶性肿瘤,尤其是非小细胞肺癌的免疫治疗。本文报道一例晚期肺腺癌患者在苏州大学附属第一医院呼吸与危重症医学科接受培美曲塞+卡铂联合帕博丽珠单抗治疗后,骨转移完全缓解,原发病灶无进展间期为16个月,并结合国内外文献进行复习。
资料与方法
患者,男性,64岁,因“肩背部不适1月余”于2019年4月28日就诊于我院,既往有吸烟史,40余年,20支/日。查胸腹盆增强CT提示:左肺尖后段占位伴左侧第1肋骨质破坏(见图1)。骨扫描:胸骨、肋骨多处、脊柱多处、骨盆骨、左侧股骨上段等处反应性骨形成活跃,诊断为多发骨转移。头颅增强MRI未见异常。肿瘤指标:糖类抗原CA125 46.80U/mL(0~35)。查体:左侧颈部可触及质硬肿块,不易推动,超声提示左侧锁骨上淋巴结肿大伴结构异常,行超声下穿刺活检,病理提示:转移性低分化腺癌伴坏死,结合临床,考虑肺来源。免疫病理:癌细胞CK(+),CK7(散在+),Napsin A(灶性+),TTF-1(-),CK5/6(-),P63(-),P40(-),Ki-67(40%+),PD-L1(22C3)(+,比例>1%<50%)。基因检测:EGFR、ALK、ROS1、c-MET、HER2均为阴性。确诊为肺腺癌ⅣB期(T3N3M1c)。
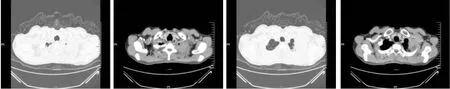
图1 患者初诊时CT(2019-04-28):左肺尖后段占位伴左侧第1肋骨质破坏
患者自2019年5月23日起行培美曲塞+卡铂+帕博丽珠单抗治疗并辅以骨保护剂。患者治疗期间复查CT提示左肺尖肿瘤逐渐缩小,左侧第一肋骨逐渐显现(见图2),至2019年9月25日复查CT提示:左肺尖软组织占位明显缩小,余两肺小结节较前大致相仿,经评估该患者达部分缓解;左侧第1肋骨质破坏消失,达完全缓解(见图3)。遂将治疗方案改为培美曲塞+帕博丽珠单抗维持治疗(见图4)。于2020年8月查胸部CT提示:双肺多发小结节,较前明显增大,考虑转移灶。

图2 患者接受2个周期的治疗后CT(2019-07-03):左肺尖软组织占位较前缩小,左侧第1肋骨质较前显影

图3 患者接受6个周期治疗后CT(2019-09-25):左肺尖软组织占位明显缩小,左侧第1肋骨质破坏消失

图4 患者接受12个周期维持治疗后CT(2020-07-05):左肺尖软组织占位及左侧第1肋骨较(2019-09-25)大致相仿
同年10月,患者因腹胀至我院急诊就诊,查CT提示:腹腔游离气体,考虑消化道穿孔可能;腹膜后及肠系膜根部多发稍大及小淋巴结。因患者无明显急腹症,与家属沟通后,其选择保守治疗。
讨 论
肺癌是目前世界上发病率和死亡率最高的癌症,仍是全球公共健康的一大挑战[1]。根据其病理类型,可以分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)。许多肺癌患者早期症状不典型,往往在就诊时已出现转移。常见的转移部位有脑、骨、肾上腺。肺癌的骨转移率仅次于前列腺癌及乳腺癌[2-4]。一项针对晚期肺癌(Ⅲ期和Ⅳ期)的前瞻性队列研究显示,48%的Ⅳ期NSCLC患者和40%的广泛期SCLC患者在初次诊断时已发生骨转移[5]。
阻断程序性死亡1 (block the programmed death 1, PD-1) 通路的免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)已被广泛用于治疗晚期恶性肿瘤。帕博丽珠单抗(Pembrolizumab)是高选择性人源化免疫球蛋白G4/κ单克隆抗体,通过与PD-1受体结合直接抑制PD-1受体与PD-L1/PD-L2相互作用,在恶性肿瘤的治疗中,尤其是晚期NSCLC患者,取得了较好的疗效[6-9]。本文报道的患者为联合用药,无进展生存期为16个月。
对于ICIs对骨转移治疗的作用,目前共有4例相关报道,均为使用了帕博丽珠单抗治疗。Sidhu等人报道了一例由低分化腺癌引起的肩胛骨转移性骨肿瘤[10]。 该患者在接受300 cGy的放疗后开始使用免疫治疗。4个月后CT显示肩胛骨完全恢复正常。 Tang等人报道了一例低分化肺腺癌伴第五腰椎转移[11]。该患者的采用新辅助免疫治疗方案,两个周期后CT显示肺肿瘤和转移性肿瘤部分缓解,在转移的椎体中也观察到骨质硬化改变。Asano等人报道了两名患者接受免疫治疗联合骨保护剂后,下肢长骨的骨质破坏得以恢复[12]。本病例中,患者在接受了培美曲塞+卡铂联合帕博丽珠单抗治疗6个周期后,骨转移完全缓解。然而ICIs在非小细胞肺癌骨转移中的具体作用及机制有待进一步研究。
在本例患者停药随访过程中,突发腹腔游离气体,伴多发肠系膜淋巴结增大。针对这一现象,我们对国内外文献进行调研,发现帕博丽珠单抗治疗晚期肺癌导致肠穿孔仅有1例报道[13],该患者在接受免疫治疗后突发腹痛,接受了外科手术,术中病理证实发生肠系膜转移并发小肠穿孔。但本例患者因家属拒绝行外科手术干预治疗,无法取得病理佐证明确诊断,不能排除免疫治疗后副反应或肿瘤转移病灶的可能。
ICIs的疗效因肿瘤类型和个体而产生巨大差异,随着基因组测序技术的发展,越来越多的驱动基因将被开发出来,因此,确定预测性的生物标志物用于精确的癌症免疫治疗是迫切需要的。有研究表明,DNA损伤修复(DNA damage response and repair,DDR)基因在膀胱癌中与免疫抑制剂的疗效有着密切联系[14]。我们设想,是否存在一种特殊的基因能够成为免疫治疗疗效的预测标志物,通过检测其表达,为患者选择更适合的治疗方案,规避不良反应的发生,从而达到更好的治疗效果。

