免疫联合化疗及抗血管生成致PD-L1高表达伴多发脑转移的肺母细胞瘤完全缓解1例
宋忠全 庄大洁 郭涛 秦琦 郭桂芳
肺母细胞瘤(pulmonary blastoma,PB)是来源于原始间叶成分的、非常罕见的、具有高度侵袭性的、影像表现微妙、组织学变化大的恶性肿瘤。早期阶段采取手术为主的综合性治疗;对于晚期失去手术机会的患者一直局限于化疗方案,具有轻度生存获益,但预后极差。在这里,我们对一位经组织学诊断为ⅣB期(T2aN0M1c、多发性脑转移)伴PD-L1高表达的29岁男性PB患者的临床资料进行分析,并证实免疫联合化疗及安罗替尼的有效性。
病例资料
患者男性,29岁,因“咳嗽、痰血、胸痛7天”入院。患者入院前7天无明显原因及诱因出现阵发性咳嗽、咳痰,咳少量白黏痰,伴痰血,量少,色鲜红,感胸部隐痛,咳嗽、深呼吸时为著,胸闷、憋气,活动后明显,偶感头痛,余无明显不适,患者曾自行口服药物治疗(具体不详),症状缓解不著,后就诊于当地医院行胸部CT示:右肺中叶占位性病变。为求明确诊治,遂于2021年5月8日以“肺肿物”入住我科。发病以来,饮食、睡眠可,3月来体重下降约10kg。既往体健,吸烟约12年,平均20支/日;婚育史、家族史无特殊。入院查体:体温:36.6℃,血压:127/73mmHg,神志清,精神可,胸廓对称,双肺听诊呼吸音粗,未闻及明显干湿性啰音;心、腹查体无异常。初步诊断:肺肿物性质待诊:肺恶性肿瘤?阻塞性肺炎。积极完善相关辅助检查,结果回示:血常规:RBC 3.63×1012/L,Hb 113g/L;CRP 45.8mg/L(参考范围:0~8mg/L);呼吸道病原体核酸检测:肺炎克雷菌DNA阳性,余肿瘤标志物(CY211 、NSE、CEA、CA72-4)、肝功、肾功、电解质、血脂、血糖、PCT、凝血常规、心脏彩超等均未见明显异常,治疗上暂给予抗感染、化痰、止咳、解痉治疗。并积极完善颈+胸+腹+盆腔CT平扫+强化,结果回示:右肺中叶占位并阻塞性肺炎,恶性不除外,必要时穿刺活检;双肺微小结节;右肾囊肿(图1)。颅脑MR平扫:颅内多发占位性病变,考虑转移瘤(图2);全身骨扫描未见异常。排除禁忌症,于2021年5月12日完善支气管镜示:右肺中叶开口息肉样突起阻塞管腔,给予活检及毛刷(图3),后病理(图4)结果回示:肺母细胞瘤(PD-L1<肿瘤细胞+,85%>)。患者诊断明确,临床分期T2aN0M1cⅣB期,无手术机会,经院内多学科讨论,可试行免疫联合化疗及抗血管生成治疗,家属表示同意,完善免疫前检查:皮质醇、TSPOT、甲功、BNP、ACTH均未见明显异常,于2021-05-15给予“紫杉醇脂质体 240mg+顺铂70mg+帕博利珠单抗 200mg+安罗替尼8mg”治疗,无明显不适出院。院外一般情况可,恶心、呕吐不著,无发热、腹泻等不适,并于2021-06-05完成第2周期全身治疗。后患者于2021-06-25再次入院,完善胸部CT评估示:病灶完全消失(图5),颅脑MRI示转移瘤明显吸收(图6),考虑治疗有效。
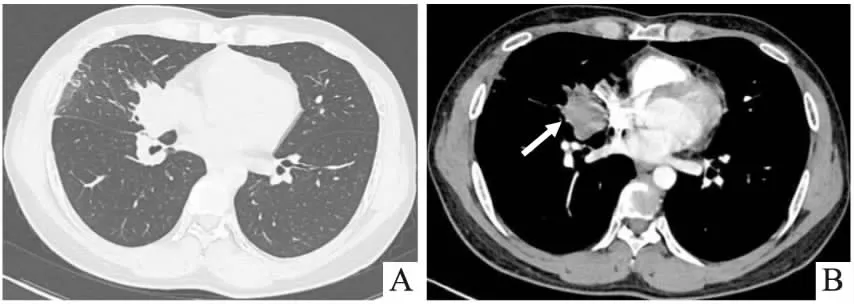
图1 胸部CT平扫+强化。(A)肺窗:右肺中叶近肺门处见软组织肿块影,可见分叶,大小约4.2cm×3.2cm,部分支气管截断,远端见片状密度增高影;(B)纵隔窗:增强扫描轻度强化,未见肿大淋巴结影。(2021年5月11日)
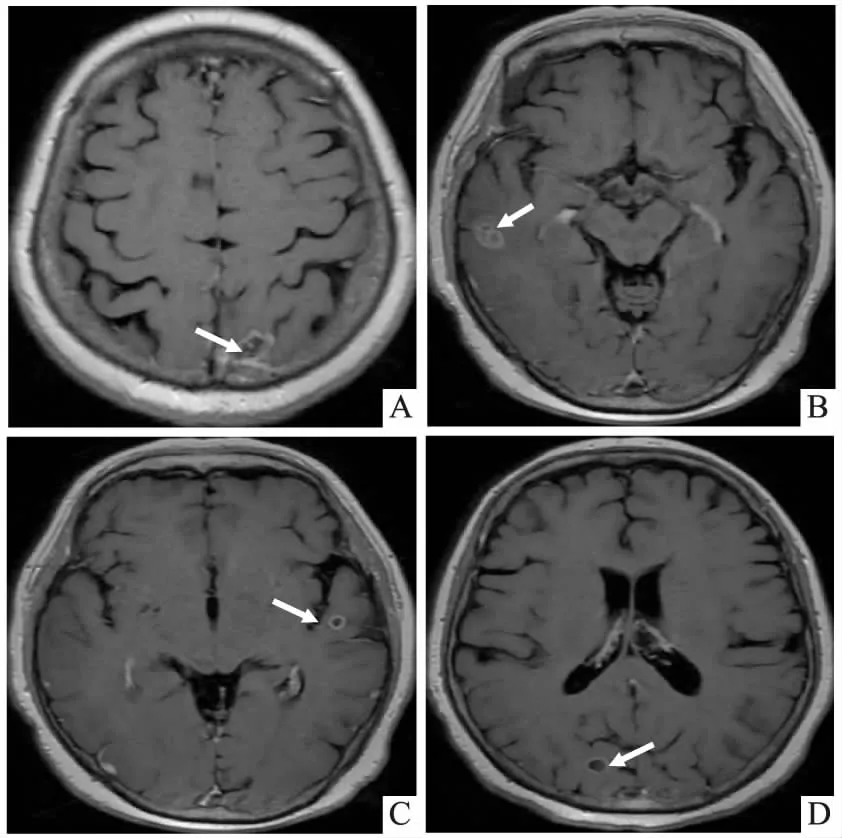
图2 颅脑磁共振。(A)左侧顶叶结节样长T1长T2信号,弥散受限不明显,长径约2.0cm,增强后可见环形强化,周围水肿无强化;(B)右侧颞叶占位性病变;(C)左侧颞叶占位性病变;(D)右侧枕叶可见环形强化的转移灶。(2021年5月11日)
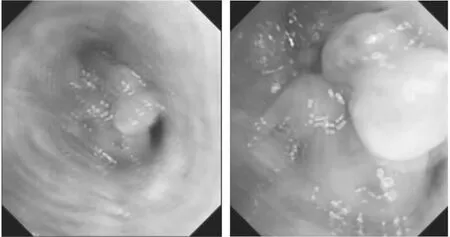
图3 纤维支气管镜。右肺中叶开口息肉样突起阻塞管腔。(2021年5月12日)
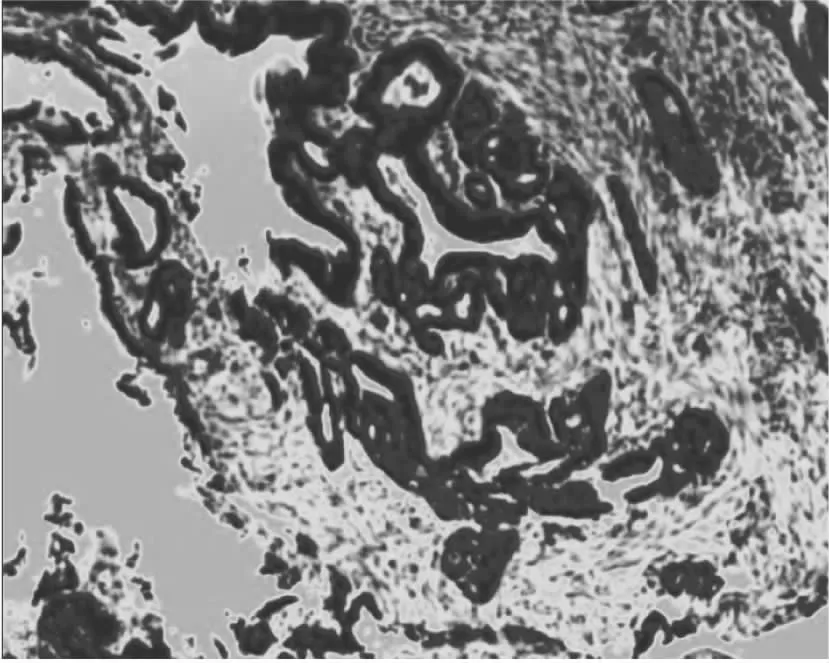
图4 气管镜病理。(右肺中叶新生物)恶性肿瘤,结合免疫组化符合肺母细胞瘤。免疫组化结果:CK广(+)、TTF-1(+)、Syn(局部+)、CgA(少许+)、CD56(少许+)、Beta-catenin(细胞核及细胞浆+)、ACTH(-)、CK7(-)、P40(-)、CK5/6(少许+)、Vimentin(+)、CK20(-)、CDX2(-)、ALK(-)、PD-1(-)、PD-L1(肿瘤细胞+,85%)、Ki-67指数(45%)。(备注:HE染色,10×40倍)
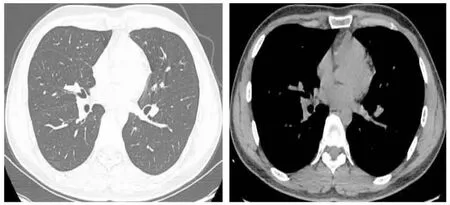
图5 胸部CT平扫。(A)肺窗:右肺中叶未再见占位性病变,远端片状影消失;(B)纵隔窗:原右肺中叶恶性肿瘤完全缓解。(2021年6月25日)
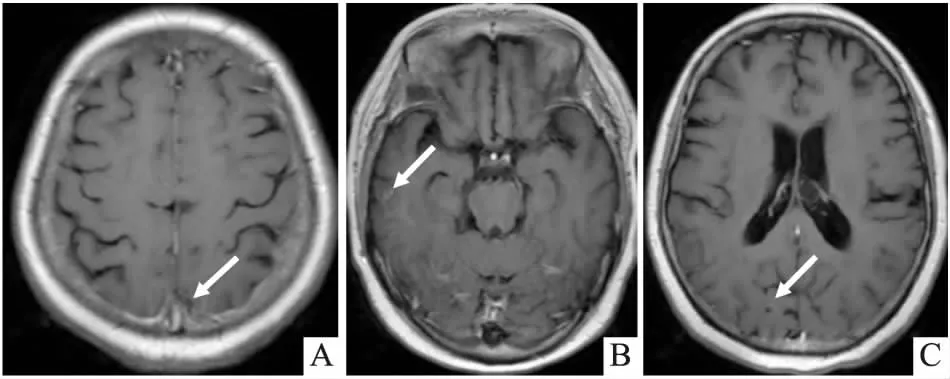
图6 颅脑磁共振。(A)左侧顶叶结节样病灶较前明显吸收;(B)原左侧颞叶转移灶消失,右侧颞叶转移灶较前明显吸收;(C)右侧枕叶转移灶明显减小。(2021年6月26日)
讨论及文献复习
肺母细胞瘤(PB)是十分罕见的恶性肿瘤,好发于30~50岁的吸烟男性[1],具有进展迅速、侵袭性强、预后差、影像多变等特点,症状无特异性,可表现为咳嗽、咳痰、咯血、胸痛、胸闷等。影像学及血液学检查可辅助PB诊断,但最终需要病理组织学确诊。其影像学常表现为密度均匀、圆形或类圆形、单发或多发的位于肺外周的软组织影,少数可见钙化灶,增强扫描示轻中度强化,其间可见大血管穿行,伴或不伴肺不张、阻塞性肺炎、胸腔及心包积液[2]。对于PB无特异性的肿瘤标志物,早期研究表明[3]此类患者可出现CEA、NSE、AFP升高,尤其是AFP升高。本例患者表现为右肺中叶单发的类圆形伴轻度强化的软组织影,AFP未查,CEA、NSE未见升高。
PB患者早期采取手术为主的综合治疗,术后可辅助放化疗;对于失去手术机会的晚期患者,目前治疗受限于化疗,多数患者对化疗不敏感。目前尚无标准的化疗方案,可选的药物包括:依托泊苷、铂类、阿霉素、多西他赛、环磷酰胺、长春新碱、紫杉醇等,早期已进行了多种联合方案的试验,但均未见明显的生存获益。随着靶向治疗、抗血管治疗及免疫治疗的发展,逐渐改变了NSCLC的治疗格局,大大提高了NSCLC的生存,基于此,PB的靶向、抗血管、免疫治疗逐渐显现,但多为个案报道,缺乏大规模的循证医学证据。
一项回顾性研究[4]显示了,在16名PB患者中可见ERBB4、ALK、MET、BRAF、RAF1、PTEN、EGFR和PiK3CA阳性表达,前期的临床研究[5]也提示携带EGFR突变的患者能从EGFR-TKI中获益。也有报道[6],1例携带ROS1融合基因的患者经克唑替尼治疗后获得7个月的无进展生存期。同时相关研究表明[2,7],PB肿瘤组织中有大量血管走形,说明新生的血管在其发生发展中起重要作用,也提示了抗血管治疗的可能。最近的一则报道[8],安罗替尼联合化疗使术后复发的肿瘤病灶明显缩小,提示PB患者可获益于安罗替尼。
随着肿瘤免疫治疗的兴起,及对PD-1/PD-L1通路在肿瘤发生发展中作用的不断认识,Bosch-Barrera等[9]率先报道了1例伴PD-L1高表达的肺母细胞瘤,提示该患者可能从免疫检查点抑制剂中获益,遗憾的是限于当时的条件并未接受免疫治疗。最新研究指出[10],抗血管药物既能使肿瘤血管正常化,又可通过多种途径来激活针对肿瘤的免疫应答,而免疫检查点抑制剂不仅可以去除免疫耐受及逃逸,还能促进血管正常化,二者在作用上相得益彰。安罗替尼是我国自主研发一种新型口服小分子多靶点酪氨酸激酶抑制剂,能通过多种通路抑制肿瘤血管生成和肿瘤生长[11];帕博丽珠单抗是一种抗PD-1的单克隆抗体,通过抑制T细胞表面PD-1与肿瘤细胞表面PD-L1/PD-L2的结合,从而恢复抗肿瘤免疫[12],二者联合相辅相成。基于以上证据,本例患者选择“化疗+免疫+抗血管”治疗方案,并证明此种联合的有效性。
综上所述,本文为1例PD-L1高表达伴多发脑转移的肺母细胞瘤患者,经“紫杉醇脂质体+顺铂+帕博丽珠单抗+安罗替尼”2周期后获得完全缓解。但本例患者治疗中存在一些缺陷:没有测定可预测疗效的AFP、没有进行肿瘤驱动基因的检测。

