以肺动静脉瘘致血胸1例
王科 张超 殷文杰 王飞 张贵恒 王凯
肺动静脉瘘合并咯血、脑栓塞、脑脓肿等情况屡有报道,其破裂导致自发性血胸的文献报道比较少见,而在自发性血胸的病因中,由肺动静脉瘘导致的临床报道也少见。我们收治了1例肺动静脉瘘致血胸病例,现就临床诊断治疗报道如下。
临床资料
患者,男性,15岁,学生,因剧烈活动时突发左侧胸痛伴呼吸困难2h来院。入急诊时查体: 体温36.5℃,脉搏110次/分,呼吸30次/分,血压100/70mmHg,吸氧情况下血氧饱和度88%,肥胖,体重105kg,口唇略发绀,胸壁静脉无扩张,左侧胸壁呼吸运动减弱,左侧语颤减弱,胸部无触痛,未触及皮下气肿,沿肋骨走行未触及骨擦感,右侧胸部叩诊呈清音,左侧胸部叩诊呈浊音,左肺呼吸音减弱,右肺呼吸音清晰,未闻及干湿性啰音及胸膜摩擦音,未见杵状指、趾。急诊行胸部CT检查提示左侧大量胸腔积液,双肺多发肺动静脉瘘(见图1、2)。血常规:白细胞13.2×109/L、血红蛋白154.0g/L、红细胞5.6×1012/L、红细胞压积45.3%。既往有红细胞增多症(既往化验红细胞压积50.5%、血红蛋白178.0g/L、红细胞6.3×1012/L)。左侧胸腔穿刺抽出不凝血性胸液,诊断为失血性休克、左侧自发性血胸、双肺多发肺动静脉瘘、红细胞增多症。行急诊胸腔镜手术,术中见左侧胸腔内大量积血并伴有血凝块,清除胸腔内积血和血凝块共计2000mL,发现左肺舌叶有一大小约1.5 cm之血管瘤样组织,局部破裂,予局部切除;探查见左肺下叶尚有肺动静脉瘘1处,表现为局部肿块,考虑到患者多发肺动静脉瘘,且此肺动静脉瘘距脏层胸膜尚有距离,行手术切除治疗会导致肺组织损失过多,可待术后行介入栓塞治疗;胸腔内探查未见胸膜粘连等其他异常,置胸腔引流管1根,术毕。术中切除组织(见图3)病理报告为肺组织中见血管群及较大畸形血管,考虑血管瘤及畸形血管破裂(见图4)。术后常规治疗,术后2天拔除胸管,8天后恢复出院,出院前血常规化验,红细胞5.4×1012/L,血色素150.0g/L,红细胞压积45.1%。之后1年内,余肺动静脉瘘全部行介入栓塞治疗(见图5、6),目前仍在随访中。
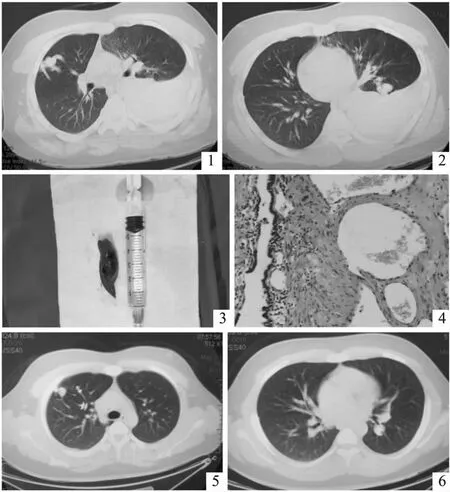
图1 急诊CT提示左侧血胸及右肺PAVF 图2 急诊CT提示左侧血胸及左肺PAVF 图3 切除之左肺PAVF 图4 左肺PAVF病理(HE染色,×100倍) 图5 右肺PAVF栓塞后 图6 左肺PAVF栓塞后
讨 论
肺动静脉瘘 ( pulmonary arteriovenous fistula, PAVF) 是一少见的肺血管畸形病变(pulmonary arteriovenous malformation, PAVM),发病率约为2~3/10万。PAVM是由于肺内血管丛的血管间隔形成发生障碍,造成动静脉短路,引起右向左或左向左分流,动脉端大多为肺循环动脉,约4%的病例动脉端还有体循环动脉参与,称为体动脉-肺循环畸形,其中体动脉来源于内乳动脉,肋间动脉,主动脉异常分支,支气管动脉等[1]。PAVM从病因可分为先天性和获得性两种,以先天性多见,90%的先天性PAVM又与遗传性出血性毛细血管扩张症(hereditaryhemorrhagictelangiectasia,HHT)有关,也即Osler-Weber-Rendusyndrome,HHT为一种常染色体显性遗传疾病,特征性表现为皮肤、黏膜、内脏器官,包括脑、脊髓、肝、胰腺和肺的多发动静脉畸形[2]。获得性PAVM可由肿瘤、感染、创伤、手术引起[3]。畸形血管迂曲成团,外形如瘤。PAVM的临床症状与病变大小有关,一般认为直径小于2cm的无明显临床症状,直径大于2cm的可引起临床症状。常见的临床表现为紫绀,杵状指,偏头痛,活动后气促、胸闷等,合并症有低氧血症,红细胞增多症,矛盾性栓塞,脑脓肿,咯血等[4]。本例患者表现为瘤体突然破裂导致大量血胸、失血性休克的临床急症,实属少见。导致瘤体破裂的机制可能是犯罪动静脉瘘位于周围肺组织,靠近脏层胸膜,瘤体周围缺乏正常肺组织加强;剧烈活动时肺循环增加,流经肺部血液增多增快,肺动静脉瘘血液分流增加,血流对血管瘤体冲击变大;同时使肺活量增加,肺的活动度增大,肺组织形变牵拉、剪切瘤体;上述因素导致瘤体靠近胸膜侧的薄弱部分破裂,出血至胸膜腔。应该强调的是患者红细胞增多现象印象尤其深刻。虽然有在其胸腔出血多达2000mL、液体复苏情况下抽血化验血常规红细胞仍为5.6×1012/L,血色素仍高达154.0g/L,红细胞压积45.3%。追溯病史,患者自幼有红细胞增多现象,既往血常规化验红细胞6.3×1012/L,血红蛋白178.0g/L,但未进一步查找原因。PAVF患者红细胞增多症是由于肺内的动静脉瘘引起血液右向左分流,未经氧合的肺动脉血直接进入肺静脉,产生低氧血症,机体长期慢性缺氧,使得血红蛋白和红细胞代偿性增多。PAVM患者红细胞压积高于正常,血液粘稠度增加,瘤体内血流速度缓慢易形成肺血管内小血栓,从而栓塞、脑脓肿等。回顾本病例,针对患者2000 mL的失血,约占患者全身血液的25%~28%(按体重估算患者全身血液7000 mL~8000 mL),以及基于PAVF患者红细胞增多及高凝状态,有学者在围手术期采取放血疗法的做法[5],提示临床医生对于PAVF患者输血指征的把握可能需要更保守一些。
肺动脉造影目前仍是诊断PAVF的金标准。PAVF一旦确诊,基于其潜在的并发症和缓慢进展性质,应积极治疗,治疗措施主要包括外科手术、介入栓塞以及杂交手术,外科手术适用于孤立性病灶、不适合栓塞或栓塞治疗失败、合并有自发性血胸等临床急症病例,采用传统开胸及胸腔镜微创手术,行肺楔形切除、肺叶切除术、血管结扎术等[6]。但不可避免的要损失部分正常肺组织。介入栓塞治疗适用于多发或弥漫性病灶。通过经皮穿刺导管在近肺动静脉瘘的供血动脉处放置栓塞物消除病变,操作简单、创伤小,可多次分期治疗,虽有栓塞或封堵器材脱落、移位,术后复发再通等可能,但可最大限度地保留肺组织,成为 PAVF 的重要治疗方法[7]。杂交手术是结合外科手术切除和介入栓塞共同治疗PAVF的方法[8],本病例中我们采用了杂交手术。在突发血胸时采用急诊胸腔镜手术,迅速控制出血,抢救生命,且镜下出血病灶显示清楚,手术损伤小,恢复快;术后肺动静脉造影未发现局部复发或再通,疗效可靠。外科切除手术后又对其他病灶采取了介入栓塞术,治疗后患者低氧血症改善,红细胞增多症消失。我们对本病例的治疗体会之一是杂交手术在处理复杂性肺动静脉瘘中更有优势。
对本病例治疗另外一个体会是临床上若遇有自发性血胸并红细胞增多病例,医生要想到存在PAVF的可能。单纯自发性血胸发病率不高,多因肺与胸膜之间的粘连带撕裂,少数病例因肺韧带撕裂、肿瘤侵犯[9]、食管动脉破裂[10]等出血导致。本例自发性血胸在手术探查中未发现有胸膜腔内粘连等现象,确定为PAVF破裂导致,临床上并不多见。虽然肺循环压力低于体循环压力,但其出血也十分凶险。本例患者2h内出血量多达2000mL,有失血性休克表现,我们及时处理,临床效果良好。因此,接诊自发性血胸为主要表现的患者,若病史中有紫绀、偏头痛、活动后气促、红细胞增多等现象,应考虑到PAVM,从而采取适当的影像学检查手段,予以确诊,及时给出患者治疗建议。

