不同强度光照对豚鼠屈光发育和形觉剥夺性近视的影响
李聪颖 甘嘉禾 王美君 曹倍赫 黄瑛 何曦 华梓煜 孙铭浩 李仕明
1首都医科大学附属北京同仁医院 北京同仁眼科中心 北京市眼科学与视觉科学重点实验室,北京 100730;2首都医科大学附属北京安贞医院眼科,北京 100029
近年来,近视已成为重要的公共卫生问题,其患病率呈“流行性”增长,尤其是在亚洲一些地区,青少年近视患病率甚至高达90%以上。流行病学研究发现,光照不足和/或户外活动减少会增加近视风险,增加户外活动时间能够延缓儿童近视发生,可能与户外环境的高强度光照有关。动物实验亦证实,增加光照强度能够延缓树鼩及豚鼠形觉剥夺性近视(form deprivation myopia,FDM)的进展,并减轻雏鸡和恒河猴FDM程度。然而,低强度光照对近视发生和发展影响的研究较少,研究结果也存在争议。有研究发现,50 lx的低强度光照条件下饲养的雏鸡会发展成近视,(15±8)lx的低强度光照可导致恒河猴屈光度发生远视性漂移,不同研究结果提示光照强度与近视发生和发展之间的关系较为复杂,并不是单一的线性关系,值得进一步研究。本研究拟观察低强度光照、正常强度光照和高强度光照对豚鼠正常屈光发育和FDM的影响,为近视防控相关研究提供实验依据。
1 材料与方法
1.1 材料
1
.1
.1
实验动物及分组 选取健康无眼疾3周龄雄性三色豚鼠108只(购于北京芳元缘养殖场),体质量150.5~211.5 g,平均181.0 g。实验动物的使用和喂养遵循中国科学技术委员会颁布的《实验动物管理条例》,本研究方案经首都医科大学附属北京同仁医院伦理委员会审核批准(批文号:TRLAWEC2022-S109)。1
.1
.2
主要试剂及仪器 复方托吡卡胺滴眼液、质量分数0.4%盐酸奥布卡因滴眼液(日本参天制药株式会社)。Quantel Medical Axis Nano眼科A型超声诊断仪(1.03,法国Quantel Medical公司);艾沃斯V3照度计、光照箱(上海锦玟仪器设备有限公司);点状光检影镜及镜片箱(丹阳市华辉光学仪器有限公司)。1.2 方法
1
.2
.1
豚鼠分组及不同强度光照处理 将豚鼠分为正常屈光发育豚鼠群54只和FDM豚鼠群54只,采用随机数表法分别分为低强度光照组、正常强度光照组和高强度光照组,每组18只,均在北京迈德康纳生物技术有限公司饲养于20 cm×35 cm×60 cm光照箱,饲养温度为20 ℃,湿度为60%。光照箱分为3层,每层天花板上安装LED灯管,灯管位于饲养笼上方10 cm处,从上到下各层光照强度分别为20、300和5 000 lx,光照节律均为12 h光照(7:00-19:00)/12 h黑暗。1
.2
.2
豚鼠FDM模型的制作 采用文献[15]中的经典FDM造模方法,选用10寸白色不透明气球套住豚鼠头部,剪去部分气球以暴露右眼、鼻唇部及耳部,保持左眼遮盖。随着豚鼠周龄增加及时更换合适的气球尺寸,防止过紧造成皮肤损伤或者过松导致眼罩滑脱及旋转(图1)。每天检查眼罩2次,若发现脱落及时重新佩戴,以确保眼罩遮盖左眼。
图1 豚鼠单眼FDM模型Figure 1 Guinea pig model of monocular FDM
1
.2
.3
眼生物学参数的测量 采用测量医师单盲法,分别于光照前及光照后2、4和6周摘除豚鼠眼罩进行眼生物学参数测量。正常屈光发育豚鼠测量结果为双眼平均值;FDM豚鼠测量结果为FDM眼测量值。(1)眼轴长度(axial length,AL)测量 采用眼科A型超声诊断仪测量豚鼠AL,频率设置为11 mHz,设置超声在前房、晶状体和玻璃体的声速分别为1 557.5、1 723.3和1 540 m/s。测量前采用0.4%盐酸奥布卡因滴眼液点眼行角膜表面麻醉,测量时探头对准角膜中心,并垂直于角膜平面,AL定义为角膜顶点到视网膜黄斑区的距离。每眼重复测量7~9次,去除最大值和最小值后取平均值。(2)眼屈光度测量 验光由2位熟练的专业验光师和助手完成。采用复方托吡卡胺滴眼液点眼行睫状肌麻痹,每5 min点眼1次,共2次,在瞳孔充分扩大的情况下于昏暗环境(<5 lx)中进行检影验光。检查者的视线与豚鼠视线平行,检影镜光源发出的光经过反光镜照射在豚鼠视网膜上,通过视网膜光点反射在瞳孔区的映光动向判断屈光状态。根据等效球镜原则计算屈光度,屈光度=球镜度+1/2柱镜度。AL和屈光度变化量为各测量时间点与光照前的差值。表1 正常屈光发育豚鼠不同强度光照组不同光照时间AL比较(x±s,mm)Table 1 Comparison of AL of normal refractive development guinea pigs after different lighting duration among three groups (x±s,mm)组别眼数不同光照时间AL光照前光照2周光照4周光照6周正常强度光照组367.97±0.218.21±0.06a8.36±0.11ab8.57±0.08abc低强度光照组367.90±0.168.24±0.14a8.42±0.10ab8.61±0.14abc高强度光照组367.95±0.148.22±0.09a8.35±0.10ab8.53±0.10abc 注:F组别=0.365,P=0.697;F时间=353.750,P<0.001.与各自组内光照前比较,aP<0.001;与各自组内光照2周比较,bP<0.001;与各自组内光照4周比较,cP<0.001(重复测量两因素方差分析,Bonferroni检验) AL:眼轴长度 Note:Fgroup=0.365,P=0.697;Ftime=353.750,P<0.001.Compared with respective baseline,aP<0.001;compared with respective 2-week lighting,bP<0.001;compared with respective 4-week lighting,cP<0.001 (Repeated measures two-way ANOVA,Bonferroni test) AL:axial length
表2 正常屈光发育豚鼠不同强度光照组不同光照时间屈光度比较(x±s,D)Table 2 Comparison of diopter of normal refractive development guinea pigs after different lighting duration among three groups (x±s,D)组别眼数不同光照时间屈光度光照前光照2周光照4周光照6周正常强度光照组36+1.62±1.46+2.00±1.56+1.13±2.21+0.85±2.24低强度光照组36+1.70±1.24+1.27±2.21+0.41±3.07+0.27±2.66高强度光照组36+1.92±1.36+2.08±1.53+2.75±2.15a+2.03±2.45 注:F组别=3.576,P=0.034;F时间=2.739,P=0.058.与各自时间低强度光照组比较,aP<0.01(重复测量两因素方差分析,Bonferroni检验) Note:Fgroup=3.576,P=0.034;Ftime=2.739,P=0.058.Compared with respective low intensity-lighting group,aP<0.01(Repeated measures two-way ANOVA,Bonferroni test)
1.3 统计学方法
采用SPSS 26.0统计学软件进行统计分析。计量资料经Shapiro-Wilk检验并结合直方图及QQ图证实服从或接近正态分布,以表示,低强度光照组、正常强度光照组和高强度光照组在光照不同时间豚鼠AL和屈光度及其变化量总体比较均采用重复测量两因素方差分析,若球形检验结果P
<0.05,以“Greenhouse-Geisser”矫正结果为准,P
<0.05为差异有统计学意义。多重比较采用Bonferroni法,并依据比较次数校正检验水准,α'=α/κ。2 结果
2.1 正常屈光发育豚鼠不同强度光照组不同光照时间AL和屈光度比较
正常屈光发育豚鼠不同强度光照组AL值组间总体比较差异无统计学意义(F
=0.365,P
=0.697),光照不同时间各组豚鼠AL值总体比较差异有统计学意义(F
=353.750,P
<0.001)(表1)。不同强度光照组豚鼠屈光度总体比较差异有统计学意义(F
=3.576,P
=0.034),其中高强度光照组光照4周豚鼠屈光度值明显大于低强度光照组,差异有统计学意义(P
<0.01)(表2)。2.2 FDM豚鼠不同强度光照组不同光照时间AL和屈光度比较
低强度光照组、正常强度光照组和高强度光照组光照不同时间FDM豚鼠AL值和屈光度值总体比较差异均有统计学意义(F
=408.302、27.407,均P
<0.001)。低强度光照组光照2周FDM眼屈光度值大于光照前屈光度,产生短暂性远视漂移,但差异尚无统计学意义(P
>0.05)(表3,4)。表3 FDM豚鼠不同强度光照组不同光照时间AL比较(x±s,mm)Table 3 Comparison of AL of FDM guinea pigs after different lighting duration among three groups (x±s,mm)组别眼数不同光照时间AL光照前光照2周光照4周光照6周正常强度光照组187.91±0.178.17±0.15a8.45±0.16b8.70±0.16c低强度光照组187.92±0.218.21±0.16a8.41±0.16b8.58±0.14c高强度光照组187.91±0.198.25±0.17a8.43±0.16b8.60±0.19c 注:F组别=0.105,P=0.900;F时间=408.302,P<0.001.与各自光照前比较,aP<0.001;与各自组内光照2周比较,bP<0.001;与各自组内光照4周比较,cP<0.001(重复测量两因素方差分析,Bonferroni检验) FDM:形觉剥夺性近视;AL:眼轴长度 Note:Fgroup=0.105,P=0.900;Ftime=408.302,P<0.001.Compared with respective pre-lighting,aP<0.001;compared with respective 2-week lighting,bP<0.001;compared with respective 4-week lighting,cP<0.001 (Repeated measures two-way ANOVA,Bonfer-roni test) FDM:form deprivation myopia;AL:axial length
表4 FDM豚鼠不同强度光照组不同光照时间屈光度比较(x±s,D)Table 4 Comparison of diopter of FDM guinea pigs after different lighting duration among three groups(x±s,D)组别眼数不同光照时间屈光度光照前光照2周光照4周光照6周正常强度光照组18+1.80±0.82+0.24±2.64-0.40±2.22a-2.83±2.35bc低强度光照组18+1.90±0.97+2.35±1.95+0.02±2.37-1.91±3.91b高强度光照组18+1.55±1.39+0.26±2.22-0.25±3.01a-2.41±4.29b 注:F组别=0.973,P=0.387;F时间=27.407,P<0.001.与各自光照前比较,aP<0.001;与各自光照2周比较,bP<0.001;与各自光照4周比较,cP<0.001(重复测量两因素方差分析,Bonferroni检验) FDM:形觉剥夺性近视 Note:Fgroup=0.973,P=0.387;Ftime=27.407,P<0.001.Compared with respective pre-lighting,aP<0.001;compared with respective 2-week lighting,bP<0.001;compared with respective 4-week lighting,cP<0.001 (Repeated measures two-way ANOVA,Bonferroni test) FDM:form deprivation myopia
2.3 各组豚鼠AL和屈光度变化趋势
正常屈光度发育豚鼠光照不同时间豚鼠AL变化量总体比较差异有统计学意义(F
=215.765,P
<0.001),其中高强度光照组AL最短且变化量最小,光照4周豚鼠屈光度变化量明显小于低强度光照组,差异有统计学意义(P
<0.05),低强度光照组豚鼠AL最长且变化量最大;正常屈光度发育豚鼠高强度光照组呈相对远视状态,低强度光照组呈相对近视状态。从光照4周开始,FDM豚鼠低强度光照组和高强度光照组AL变化量与正常强度光照组相比均有减小趋势,且各时间点豚鼠屈光度近视漂移程度均小于正常强度光照组,FDM眼低强度光照组光照2周屈光度变化量明显小于正常强度光照组,产生短暂性远视漂移(图2)。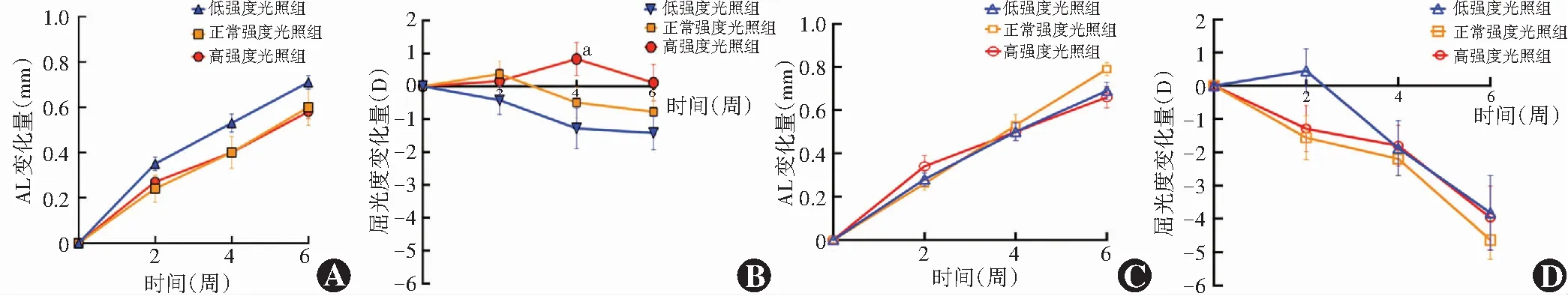
图2 不同光照时间各组豚鼠AL及屈光度变化量趋势 A:正常屈光发育豚鼠AL变化量趋势 B:正常屈光发育豚鼠屈光度变化量趋势 C:FDM豚鼠AL变化量趋势 D:FDM豚鼠屈光度变化量趋势 与低强度光照组比较,aP<0.05 AL:眼轴长度Figure 2 Change trend of AL and diopter in various groups A:Change trend of AL in the normal refractive development guinea pigs B:Change trend of diopter in the normal refractive development guinea pigs C:Change trend of AL in FDM guinea pigs D:Change trend of diopter in FDM guinea pigs Compared with the low intensity-lighting group,aP<0.05 AL:axial length
3 讨论
本研究探讨不同强度光照对豚鼠屈光发育和FDM眼的影响,发现高强度光照组正常屈光发育豚鼠屈光度呈相对远视状态,AL最短且变化量最小,低强度光照组豚鼠屈光度呈相对近视趋势,AL最长且变化量最大,其中光照4周低强度光照组豚鼠屈光度小于高强度光照组,其变化量显著大于高强度光照组,提示提高光照度能够抑制屈光发育过程中的AL增长和屈光度向近视漂移,可作为预防近视的一种措施。本研究还发现,从光照4周开始,低强度光照组和高强度光照组FDM豚鼠AL变化量与正常强度光照组相比有减小趋势。低强度光照组和高强度光照组光照不同时间豚鼠近视漂移程度均小于正常强度光照组,但低强度光照组光照2周屈光度远视漂移。这些研究结果提示,低强度光照并非必然促进豚鼠FDM进展,其原因和机制值得进一步研究。
光暴露是影响眼球屈光发育的重要环境因素,光照可以转换为影响眼球生长的生物信号。已有研究表明,在儿童眼屈光发育过程中,长期暴露在较低强度光照(200 lx)下会减少儿童远视储备,增加近视风险,而户外高强度光照可防止近视度数过快增长。Cohen等研究发现,50 lx低强度光照饲养90 d雏鸡AL和玻璃体腔较长,呈绝对性近视状态,但10 000 lx高强度光照呈远视状态。近年来有研究发现,低强度光照不一定加速近视的发生和发展。因此,本研究设计3种不同强度光照进行比较,进一步探讨低强度光照对近视发生和发展的影响。
本研究发现低强度光照有延缓FDM进展的趋势,与Ashby等及She等研究结果一致。Ashby等研究发现,FDM雏鸡以间歇性50 lx低强度光照6 h不会促进近视进展,表明短暂低强度光照可能不是禽类近视发展的风险因素。She等对发育早期的恒河猴进行研究,发现(15±8)lx低强度光照对FDM程度和AL均无明显影响,而且可以阻止FDM的恢复,进一步研究还发现(15±8)lx低强度光照也可降低恒河猴眼球对透镜诱导的屈光度改变。上述2种情况均与脉络膜未增厚有关,低强度光照会减弱眼球对光学离焦信号的反应,这表明在低强度光照下,由于光刺激减少,眼球对外界屈光干预作出适当反应的可能性减小。
不同动物视网膜感光细胞的数量比例不同,这是导致对光线强弱敏感度不同的生理基础。如鸟类视网膜中视锥细胞与视杆细胞比例为3∶ 2,视锥细胞数量占优势,而灵长类动物视网膜中视锥细胞与视杆细胞比例为1∶ 20,视杆细胞数量占优势。Hn等研究发现,视杆细胞转导蛋白敲除Gnat1
小鼠的正视化出现异常,且无法诱导出FDM。Landis等研究发现,不同光亮度对屈光度的影响不同,暴露于暗光(1.6×10cd/m)或明光(4.7×10cd/m)环境下时透镜诱导小鼠发生的近视漂移程度明显小于中间光(1.6×10cd/m)环境。也有研究采用仅有视杆细胞的小鼠进行研究,发现视杆细胞通路能够在暗光下抑制近视,但在明亮光下则未出现该现象。本研究采用的豚鼠与恒河猴、小鼠均属于哺乳动物,低强度光照未促进近视进展还可能与视杆通路在屈光发育中的重要作用有关。视杆细胞是感受弱光刺激的细胞,对光线的强弱反应非常敏感。视杆细胞与视网膜AⅡ型无长突细胞形成突触,这些无长突细胞与双极细胞相连,激活双极细胞后刺激多巴胺释放。多巴胺是眼屈光发育的停止信号,对眼球生长有较强的抑制作用。AⅡ型无长突细胞在近似于黄昏光照度水平(300 lx)时电耦合程度最高,该条件下多巴胺将不能有效释放,这可能是低强度光照与正常强度光照相比呈现相对远视的原因。最近有研究发现,视杆细胞在持续的强光条件下也是活跃的。这些研究均表明刺激视杆细胞和其介导的多巴胺释放可能有助于低强度光照对近视发展的保护作用。
光照波长也会影响屈光发育,不同波长的单色光对不同动物眼球的屈光发育可产生不同影响。在长波长光下,豚鼠和雏鸡可发生近视,而恒河猴和树鼩则发生远视。在短波长光下,雏鸡和小鼠远视程度增加。不同波长光可能是通过影响视网膜色素上皮细胞的增生及其分泌的生长因子来影响屈光发育,如短波长蓝光可延缓视网膜色素上皮细胞生长及其细胞因子分泌,进而延缓近视的发生和发展。此外,光照度大于250 lx的530 nm单色光可以抑制大鼠视网膜Müller细胞生长,并下调细胞中近视相关细胞因子表达,进而在近视的形成中发挥作用。以上研究表明,光线的不同特征对眼球屈光发育的影响较为复杂,光照强度与近视发生和发展并不是单纯的线性关系。
本实验仍存在一定局限性,如给豚鼠佩戴眼罩可能会导致部分角膜感染与磨损,可能使角膜曲率发生改变。在今后的研究中,我们将用红外验光仪进行验光并测量角膜曲率,进一步探讨不同强度的光照对屈光发育和FDM的影响。此外,不同强度光照对屈光度和AL产生影响的分子机制也有待进一步探讨。
总之,本研究结果支持低强度光照并非必然会增加FDM的发生和发展。对于光线如何与视觉信号相互作用以影响近视进展,目前尚未完全了解。外界低强度光照具体通过何种方式影响眼部发育,以及低强度光照是否可以作为近视防控的环境因素还有待进一步研究。
利益冲突
所有作者均声明不存在利益冲突作者贡献声明
李聪颖:参与研究实施、分析/解释数据、论文撰写及修改;甘嘉禾:参与实验设计、研究实施、修改论文;王美君:参与研究实施、数据采集;曹倍赫、黄瑛:参与研究实施、生物测量及数据采集;何曦、华梓煜、孙铭浩:参与研究实施;李仕明:参与实验设计、实验指导、数据分析、对论文智力性内容的修改及最终定稿
