急性早幼粒细胞白血病并发双眼眼内出血1例
刘建东 高磊 朱方兴 李子旭
潍坊眼科医院 国家重点临床专科,潍坊 261041
患者,男,47岁,2018年11月21日因头痛、咽痛8 d于当地医院就诊,经骨髓活检及免疫组织化学、骨髓细胞形态学检查、骨髓染色体及核型分析等相关检查,确诊为急性早幼粒细胞白血病(acute promyelocyte leukemia,APL),给予亚砷酸、柔红霉素联合全反式维甲酸(all-trans retinoic acid,ATRA)化疗后5 d,诉双眼视力突然下降,经眼科会诊确诊为双眼玻璃体积血,考虑到患者全身情况差,白细胞28.90×10/L,红细胞1.88×10/L,血红蛋白63.0g/L,血小板13×10/L,双眼暂未予治疗。2019年1月1日转诊至潍坊眼科医院,全身情况可,白细胞6.91×10/L,红细胞3.07×10/L,血红蛋白111g/L,血小板211×10/L,双眼视物不清35 d。眼部检查:双眼最佳矫正视力(best corrected visual acuity,BCVA)为数指/15 cm;眼压17 mmHg(1 mmHg=0.133 kPa);超广角眼底照相示双眼玻璃体血性混浊,仅可见周边视网膜;眼科B型超声检查双眼玻璃体腔内可见后极部团状致密回声。2019年1月2日行左眼玻璃体切割术,术中清除玻璃体积血后黄斑区内界膜下可见一边界清晰、表面光滑血红色病灶,剥除内界膜后,笛针清除“豆腐渣”样物质,见黄斑区视网膜大致正常,团块边界见线样增生嵴(图1)。术后1周左眼BCVA为0.16,黄斑区颞上方可见环状嵴样增生,随着时间延长,嵴高度有所降低(图2)。术后于当地医院继续行全身ATRA联合化疗,血小板回升至88×10/L。2019年1月30日再次入院行右眼玻璃体切割术,术中所见基本同左眼,病灶区完全呈白色(图1)。术后1周,右眼BCVA为0.1,眼底表现基本同左眼,随着时间延长,环形嵴线几乎不可见(图2);双眼行联合检查示左眼黄斑区毛细血管无明显荧光素渗漏,隐约可见环状嵴痕迹,视盘无明显异常;右眼荧光素眼底血管造影(fluorescein fundus angiography,FFA)示视盘荧光素渗漏明显,黄斑区斑驳状轻度渗漏,环状嵴间断性着色,吲哚菁绿血管造影(indocyanine green angiography,ICGA)示黄斑区斑驳状低荧光,环状嵴样非连续遮蔽荧光。左眼未见明显荧光素渗漏,隐见环状嵴。光相干断层扫描(optical coherence tomography,OCT)检查示双眼术后早期黄斑中心凹呈现“压陷式”变化,随时间延长有所改善(图3);左眼同一部位的嵴样隆起OCT检查结果显示,随时间延长,处于外丛状层的异常回声逐渐缩小(图4)。术后5个月BCVA右眼为0.3,左眼为0.5,继续行全身治疗。
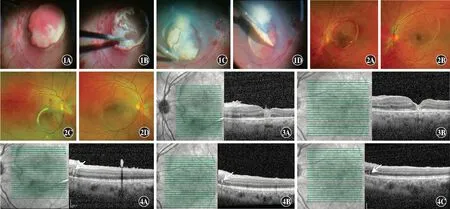
图1 双眼玻璃体切割术中图像 A:左眼视网膜散在灶状出血,静脉迂曲扩张,黄斑区血管弓内边界清晰、表面光滑混血白色团块 B:左眼黄斑区白色团块样物质,可见周围环状嵴样隆起增生线 C:右眼黄斑区视网膜下陈旧性出血呈白色 D:陈旧出血移除后,其下黄斑区视网膜表面光滑,周围环形隆起嵴形成 图2 双眼不同时期彩色眼底图像 A:左眼术后1周黄斑区偏上视网膜表面可见少许白色陈旧出血残留以及环状增生嵴 B:左眼术后5个月隐见黄斑区环状增生嵴 C:右眼术后1周眼底表现基本同左眼,内界膜下出血病灶位于黄斑偏下方 D:右眼术后4个月环形嵴线几乎不可见 图3 左眼不同时间黄斑OCT图像 A:左眼术后第2天可见黄斑中心凹结构存在,中心凹视网膜厚度大致正常,表面“毛刺状”,视网膜各层结构呈“压陷式”改变 B:左眼术后5个月,黄斑中心凹各层组织结构改善,视网膜外层包括椭圆体带、光感受器外节、光感受器外节和RPE复合体交叉区缺失或中断 图4 左眼不同时间环状嵴的OCT图像 A:术后第2天可见外核层内有强反射回声(白箭),将外丛状层与内界膜之间的视网膜组织拱形顶起 B:术后1个月异常强回声光团缩小(白箭) C:术后5个月异常回声隐约可见,视网膜几乎无隆起(白箭)
讨论:
APL是一种特殊类型急性非淋巴细胞白血病,眼部可表现为视网膜静脉迂曲、扩张,也可因贫血、血黏度高等原因表现为棉絮斑、硬性渗岀、微血管瘤以及视网膜新生血管等视网膜缺血改变,甚至出现视网膜不同层次、不同形态的出血,出血中央常可见“白芯”,为白细胞聚集所致,称为“Roth斑”。APL并发眼底出血可能与血小板数量显著减少和功能障碍、白血病细胞浸润使眼底小血管壁的通透性增加以及ATRA化疗过程中发生高颅压综合征,引起视盘水肿和视网膜出血有关。本例患者双眼同时出现“自发性”、“对称性”黄斑区内界膜下出血并玻璃体积血,较罕见。患者双眼玻璃体积血主要集中于玻璃体中后部,且位于内界膜下,与Terson综合征的玻璃体积血相似。Terson综合征是各种原因引起的颅内出血致颅内压增高所继发的眼内出血,其视网膜前出血发生率最高,占52.6%,双眼受累者高达63.2%;且大多聚集在黄斑区内界膜下,当出血量多时则穿透内界膜到达玻璃体腔内。有研究认为虽然ATRA治疗APL缓解率高,但也可引起高白细胞综合征、维甲酸综合征、颅内出血、脑梗塞等并发症,进而导致颅内压增高。Abu等报道1例APL患者在ATRA治疗过程中并发Terson综合征,患者治疗期间有明确脑出血、颅内压增高病史。本例患者眼部症状出现前并无颅内出血,甚至颅内压升高的任何症状和体征,如严重头痛、意识丧失、脑膜刺激征阳性、恶心、呕吐、瞳孔大小不对称等,考虑本例仅存在类“Terson”样改变。
仔细回顾病史发现,本例患者眼部症状发生在ATRA联合化疗后第5天。既往研究显示,在ATRA联合亚砷酸治疗APL过程中,一方面因治疗后白细胞增多和容积增加,细胞变形性小,导致血液黏度升高,细胞在管腔内聚集,产生机械性梗阻,造成微循环阻滞;另一方面治疗后大量细胞因子,如肿瘤坏死因子-α、白细胞介素等表达增加,导致白血病细胞黏附于内皮细胞,造成微血管内白细胞淤滞。考虑这种微循环阻滞极有可能诱发黄斑区毛细血管通透性增加,甚至血管破裂,进而发生内界膜下出血和玻璃体积血。本例患者眼部症状发生时白细胞因ATRA联合化疗由最初的0.53×10/L骤然升至28.90×10/L,最高达49.98×10/L,此发现为这一假设提供了证据。但本例患者左眼黄斑似黄斑裂孔闭合后的形态改变仍无法解释。
APL患者首诊于眼科者较少,出现眼部不适时常伴有Roth斑等典型眼底表现,再结合APL病史较易诊断。但对于眼底无特异性表现的患者,易造成漏诊。结合本病例,APL除其疾病本身会造成眼底病变外,APL化疗药物也可造成眼底损害,且两者表现不同,后者可有类“Terson”样改变,易漏诊或误诊为Terson综合征,可通过有无颅内压增高病史鉴别。
利益冲突
所有作者均声明不存在利益冲突
