人参皂苷G-Rh2通过调节脂质代谢与免疫改善小鼠代谢综合征①
黄容容 张子君 解梦园 苟 静 李 晴 马 坤 向 明
(华中科技大学同济医学院药学院生物药学系,武汉 430030)
代谢综合征(metabolic syndrome,MS)是多种代谢紊乱症候群在同一个体聚集的慢性疾病,表现为高血糖、高血压、血脂异常、腹部肥胖等,易诱发糖尿病、脂肪肝病以及心血管疾病[1-2]。近年来MS 患者大量增加,亟需开发治疗MS 的药物[3]。MS 发病机制是代谢紊乱和慢性炎症相互影响:肝脏和脂肪组织代谢异常易出现胰岛素抵抗,导致肥胖、高血脂[4];肥胖环境下脂肪扩张引发Th1 细胞、M1 型巨噬细胞以及IL-6、TNF-α 等过度产生,形成慢性炎症,促进脂肪分解,引起血浆脂肪酸升高[5-6]。据报道人参皂苷G-Rh2具有抗糖尿病、肥胖、炎症等药理活性,本课题组前期研究也发现G-Rh2 对肝脏脂肪酸代谢和免疫有调节作用[7-9]。本文旨在探究G-Rh2对MS的治疗作用,并通过代谢和免疫调节途径探究其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄雄性C57BL/6J小鼠40只,SPF 级,购自北京华阜康生物科技股份有限公司,合格证号:42000600036134。饲养于华中科技大学实验动物中心(温度25 ℃,相对湿度60%),许可证号SYXK(鄂)2016-0057,适应性喂养1 周后进行实验。本研究经过华中科技大学实验动物伦理委员会批准。
1.1.2 试剂 高脂饲料(北京华阜康生物科技股份有限公司,批号:D12492);人参皂苷G-Rh2(商品名:今幸胶囊,浙江亚克药业有限公司,每100 g 含16.2 g 人参皂苷G-Rh2,批号:190801);二甲双胍盐酸盐、洛伐他汀(上海TCI 化成工业发展有限公司,批号POW6L-QH、55FIB-JP);总胆固醇(total choles⁃terol,TC)、总三酰甘油(total triglycerides,TG)、游离脂肪酸(nonestesterified fatty acid,NEFA)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)、谷 丙 转 氨 酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)(南京建成生物工程研究所,批号:A111-1、A110-1、A112-1、A113-1、A042-2、C009-2、C010-2);BCA蛋白测定试剂盒(Beyotime 公司,批号:P0010S);PE-Cy5标记的小鼠CD3 流式抗体(美国BD 公司,批号:7069621);PE标记的小鼠CD8流式抗体(美国BD公司,批号:7132789);FITC 标记的小鼠CD4 流式抗体(天津三箭生物科技有限公司,批号:AD605);PE 标记的小鼠NK1.1 流式抗体(上海Biolegend 公司,批号:B190158);PE 标记的小鼠CD25 抗体(美国BD公司,批号:E021463);PE-Cy5 标记的小鼠Foxp3 抗体(美国BD 公司,批号:8025968);PE 标记抗小鼠Gr-1 流式抗体(美国BD 公司,批号:4277720);APC标记的小鼠CD11b 流式抗体(美国BD 公司,批号:2010622)。
1.1.3 仪器 血糖仪(湖南三诺生物传感股份有限公司);多功能酶标仪(美国BioTek公司);C6型流式细胞仪(美国BD 公司);液相色谱串联质谱仪(LC-MS/MS,美国AB SCIEX 公司);球磨匀浆机、超声仪、真空干燥机(武汉迈特维尔生物科技有限公司);HE 染色、油红O 染色分析仪(湖北百奥斯生物科技有限公司);高速冷冻离心机(上海力新仪器有限公司);恒温振荡器(太仓豪城实验仪器制造有限公司)。
1.2 方法
1.2.1 动物造模、分组及给药 随机挑取8只正常小鼠,给予标准饲料喂养,作为正常对照组(Con);其余32 只小鼠作为模型组,给予高脂饲料(high-fat diet,HFD,含60%脂肪、20%蛋白质、20%碳水化合物)喂养。喂养期间,每周称量一次小鼠体质量并记录其状态。喂养12 周后,小鼠禁食6 h(自由饮水),尾尖微创采血测定空腹血糖(fasting blood glu⁃cose,FBG)值,眼眶静脉丛取全血200µl,分离血清检测TC、TG、HDL-C、LDL-C 水平。取同时符合下列标准的小鼠作为MS 模型:①体质量高于同期饲养的正常组小鼠平均值;②FBG≥7.0 mmol/L;③血脂TG≥1.55 mmol/L、TC≥2.22 mmol/L、LDL-C≥0.35 mmol/L、HDL-C≤1.20 mmol/L 或与正常组相比有显著性差异[10-12]。
根据造模标准取造模成功的小鼠20只,随机分为4组(每组5只):模型组(Mod),二甲双胍组(阳性对照,Met,250 mg/kg),洛伐他汀组(阳性对照,Lova,10 mg/kg),G-Rh2 组(10 mg/kg 该剂量依据本课题组前期研究[9]和参考文献[13]确定)。正常对照组和模型组按0.2 ml/只灌胃蒸馏水,各给药组按相应剂量灌胃药物混悬液(蒸馏水配制),1 次/d,连续4 周。给药期间每周称量1 次体质量,末次给药后处死小鼠,剥取小鼠皮下和腹部脂肪,称重并计算脂肪指数。
1.2.2 胰岛素耐量实验(insulin tolerance test,ITT) 给药2 周后,小鼠禁食6 h(自由饮水),皮下注射胰岛素溶液(0.4 U/kg),分别于胰岛素注射后0 min、20 min、40 min 和90 min 采血测定FBG 值,记录所得数据并计算曲线下面积(AUC)。
1.2.3 口服葡萄糖耐量实验(oral glucose tolerance test,OGTT) 给药2周后,小鼠禁食6 h(自由饮水),灌胃葡萄糖溶液(2 g/kg),分别于葡萄糖负荷后0 min、30 min、60 min、90 min、120 min采血测定FBG值,记录所得数据并计算AUC。
1.2.4 胰岛素抵抗指数(homeostasis model assess⁃ment,HOMA-IR)评估 末次给药后,眼眶取血,4 ℃放置3~4 h,高速冷冻离心(6 000 r/min,4 ℃,10 min)收集血清。采用胰岛素试剂盒检测血清中胰岛素含量,通过稳态模型评估HOMA-IR,具体计算公式:HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.2.5 生化检测 取血清,采用生化试剂盒检测TC、TG、NEFA、HDL-C、LDL-C 水平。取肝脏匀浆,采用生化试剂盒检测肝脏组织中ALT、AST 含量,并用蛋白试剂盒进行均一化。
1.2.6 ELISA 检测炎症因子 取血清,采用ELISA试剂盒检测炎症因子TNF-α、IL-6水平。
1.2.7 肝脏组织病理学分析 末次给药后,脱臼处死小鼠,取肝脏组织同一部位的样本固定于4%的多聚甲醛中,行HE 染色。另取一份肝脏组织迅速冻于液氮中,行油红O染色。
1.2.8 非靶向脂质代谢组学分析 取小鼠肝脏组织同一部位的样本装在预冷的离心管中,迅速转移到-80 ℃冰箱冻存,采用非靶向脂质代谢组学技术检测八大类脂质代谢物含量,并对脂质代谢组学数据进行解析。
1.2.9 流式细胞仪(FACS)检测免疫细胞 末次给药后,脱臼处死小鼠,取出新鲜的脾脏和胸腺组织,置于PBS中保持湿润,碾磨消化后制备单细胞悬液,分装于EP 管中(每管约2×106个细胞),分别加入不同的流式抗体:T 细胞加入PE-Cy5 标记的小鼠CD3抗体、FITC 标记的小鼠CD4 抗体或PE 标记的小鼠CD8 抗体;调节性T 细胞(Treg)加入FITC 标记的小鼠CD4 抗体、PE 标记的小鼠CD25 抗体和PE-Cy5 标记的小鼠Foxp3 抗体;NK 细胞加入PE-Cy5 标记的小鼠CD3 抗体、PE 标记的小鼠NK1.1 流式抗体;骨髓来源的抑制性细胞(bone marrow-derived suppressor cells,MDSCs)加入APC 标记的小鼠CD11b 抗体、PE标记抗小鼠Gr-1 流式抗体;4 ℃避光孵育50 min,加入1 ml PBS,1 200 r/min 离心5 min,重复1 次,用300µl PBS重悬,流式细胞仪检测细胞百分比。
2 结果
2.1 G-Rh2 对MS 小鼠肥胖体征的影响 喂养12 周后,与正常组比较,HFD 饲养小鼠体质量快速增加且明显高于正常组(P<0.01),呈现出肥胖体型。给药4 周后,与模型组比较,G-Rh2 组小鼠体质量明显下降(P<0.01),恢复至正常组水平,呈瘦型(图1A、C)。与正常组比较,模型组小鼠脂肪指数显著升高(P<0.01)。与模型组比较,G-Rh2 组、二甲双胍组和洛伐他汀组小鼠脂肪指数均明显降低(P<0.05或0.01,图1B)。
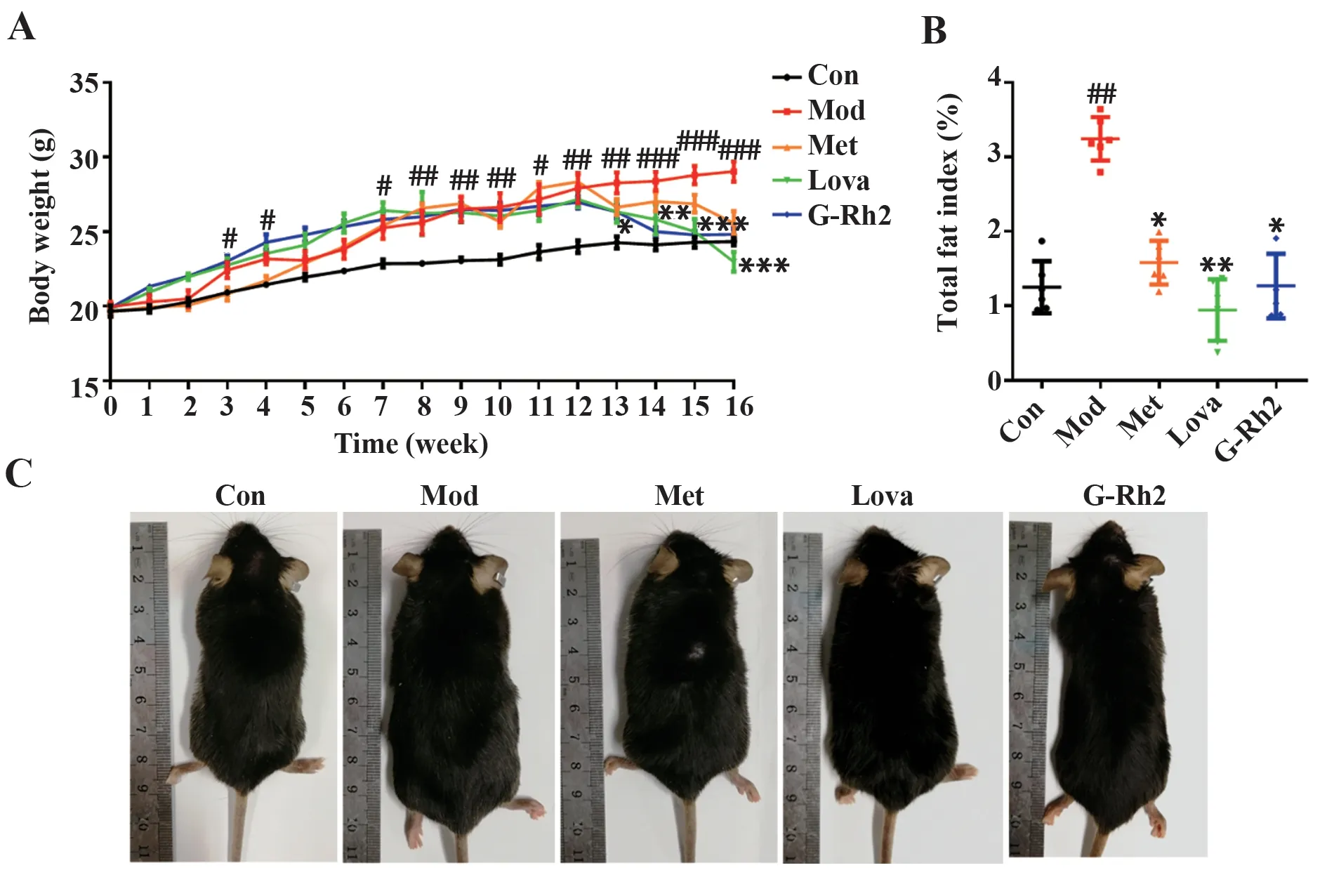
图1 G-Rh2对MS小鼠肥胖体征的影响(n=5)Fig.1 Effects of G-Rh2 on obesity symptom in MS mice(n=5)
2.2 G-Rh2对MS小鼠胰岛素敏感性的影响 给药2 周后,ITT 结果显示:与正常组比较,模型组小鼠AUC增大(P<0.05);与模型组比较,G-Rh2组注射胰岛素后FBG 值下降,AUC 减小(图2A)。OGTT 结果显示:与正常组比较,模型组小鼠口服葡萄糖30 min后FBG 值迅速上升,至120 min 时才恢复到初始水平,同时AUC 显著增大(P<0.01);与模型组比较,G-Rh2 组小鼠葡萄糖负荷后FBG 值变化幅度小,90 min 时恢复至初始水平,且AUC 明显减小(P<0.05,图2B)。给药4 周,与正常组比较,模型组小鼠HOMA-IR 显著升高(P<0.01);与模型组比较,G-Rh2 组小鼠HOMA-IR 指数有一定程度的降低(图2C)。
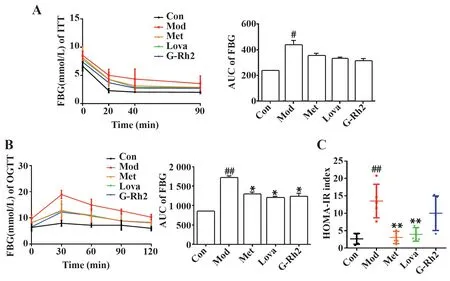
图2 G-Rh2对MS小鼠胰岛素敏感性的影响(n=5)Fig.2 Effects of G-Rh2 on insulin sensitivity in MS mice(n=5)
2.3 G-Rh2 对MS 小鼠血脂的影响 给药4 周,与正常组比较,模型组小鼠血清中4 种脂质TC、TG、NEFA、LDL-C 水平均升高;与模型组比较,G-Rh2 组小鼠血清中NEFA 和LDL-C 水平明显降低(P<0.01或0.05),TC 水平也下降(P=0.105);洛伐他汀组TC 和NEFA 水平明显降低(P<0.01);二甲双胍组NEFA 水平下降,其余4 种脂质水平无显著变化(图3)。
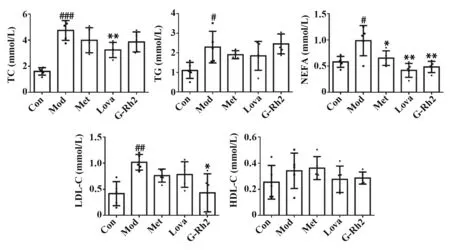
图3 G-Rh2对MS小鼠血脂的影响(n=5)Fig.3 Effects of G-Rh2 on serum lipid levels in MS mice(n=5)
2.4 G-Rh2对MS小鼠肝脏脂质代谢的影响 给药4周后,与正常组比较,模型组有28种脂质代谢物水平明显下调,222 种脂质代谢物水平明显上调;G-Rh2 组74 种脂质代谢物水平明显下调,8 种脂质代谢物水平明显上调(图4A)。差异倍数柱状图展示:与正常组比较,模型组小鼠肝脏中上调最显著的10种脂质代谢物包括6种三酰甘油(TGs)、2种神经酰胺(Cer)、1 种磷脂酰胆碱(PC)和1 种二酰甘油(DG);与模型组比较,G-Rh2 组小鼠肝脏中下调最显著的脂质代谢物有12 种,包括4 种TGs、2 种DGs、1 种Cer、2 种PCs、1 种磷脂酰乙醇胺(PE)、1 种溶血磷脂酰乙醇胺(LPE)和1 种溶血磷脂酰胆碱(LPC);上调最显著的代谢物有8 种,分别是1 种羟基花生四烯酸(HETE)、2种环氧十八碳烯酸(EpOME)、1种PC、1 种棕榈酸肉碱(palmitoleoylcarnitine)、1 种环氧二十碳三烯甘油酸(EET)、1 种血栓素B2(TXB2)、1种油酰基肉碱(oleyl-carnitine)(图4B)。
聚类分析结果显示,模型组与G-Rh2 组之间共有90 种脂质代谢物参与了聚类,其中G-Rh2 组较模型组减少的脂质代谢物有82 种,大多数是TGs 和磷脂酰胆碱类(PCs),与差异倍数柱状图结果一致。G-Rh2 组较模型组增多的脂质代谢物有8 种,分别是3种LPCs、3种胆固醇脂和2种LPEs(图4C)。
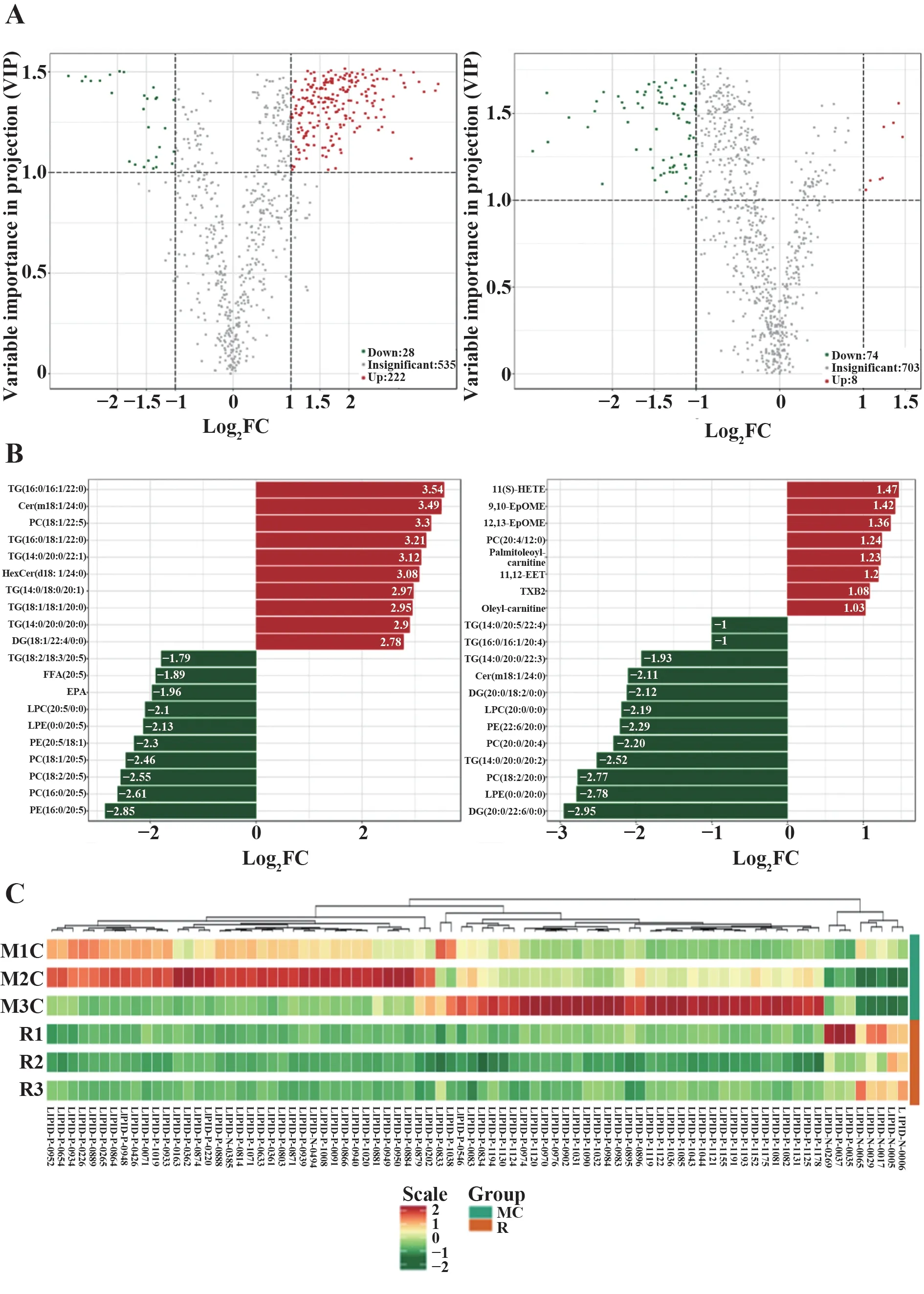
图4 G-Rh2对MS小鼠脂质代谢物的影响(n=5)Fig.4 Effects of G-Rh2 on lipid metabolites in MS mice(n=5)
2.5 G-Rh2 对MS 小鼠脂肪性肝炎的影响 给药4 周后,HE 切片结果显示:正常组小鼠肝脏形态结构完整,中央静脉血管清晰,肝小叶规则,肝索排列整齐;模型组小鼠肝窦萎缩变形,肝窦周围细胞散乱,存在多处炎症细胞聚集区域(黑色箭头所指);G-Rh2 组小鼠肝脏形态恢复正常,肝小叶呈规则的多面棱柱状,仅中央静脉管周围存在少许炎症细胞,其他肝实质区的炎症细胞较模型组明显减少(图5A)。油红O 染色结果显示:正常组小鼠肝脏油红O 染色呈阴性,蓝色的细胞核清晰,无红色;模型组小鼠肝脏油红O染色呈阳性,有较多红色的脂肪,蓝色的细胞核少,排列疏松并出现大量裂隙;G-Rh2组小鼠肝脏油红O 染色基本呈阴性,细胞核清晰,细胞内脂滴聚集少,红色染色比模型组明显减轻(图5B)。
给药4周后,与正常组比较,模型组小鼠肝脏指数增大,ALT、AST 含量显著升高(P<0.01);与模型组比较,G-Rh2 组小鼠肝脏指数和ALT、AST 含量明显降低(P<0.05或0.01,图5C、D)。与正常组比较,模型组血清中TNF-α、IL-6 含量升高;与模型组比较,G-Rh2 组TNF-α、IL-6 含量明显降低(P<0.05,图5E)。
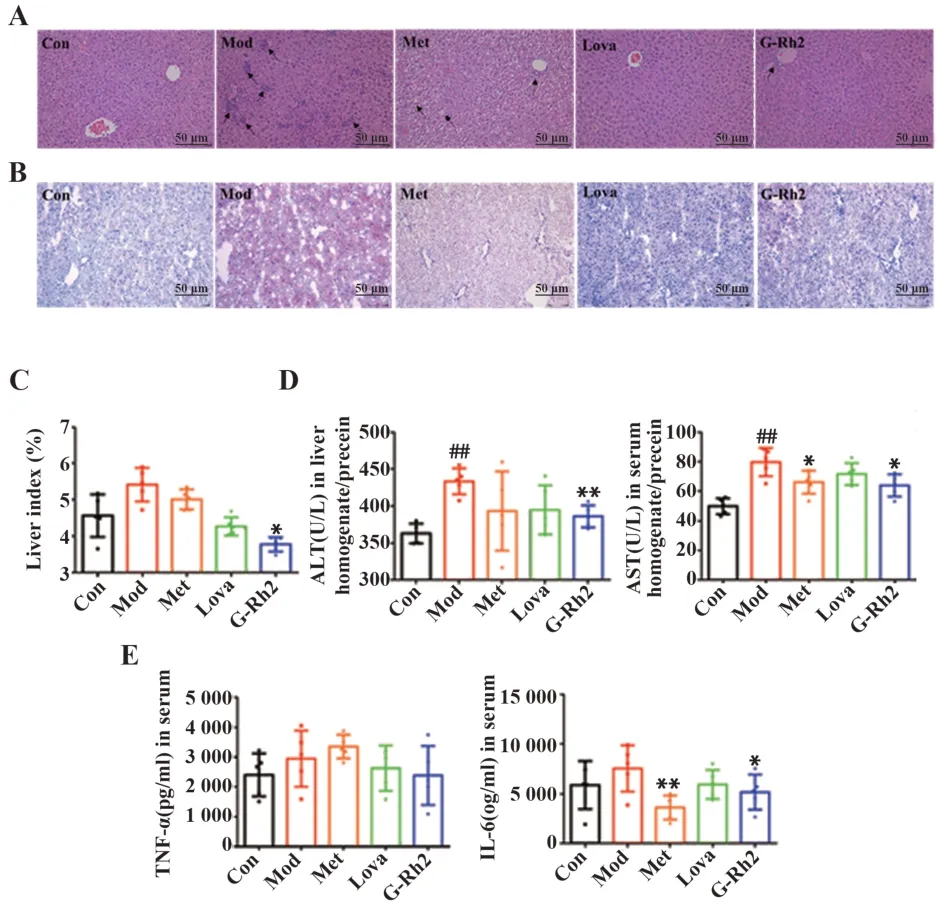
图5 G-Rh2对MS小鼠脂肪性肝炎的影响(n=5)Fig.5 Effects of G-Rh2 on steatohepatitis in MS mice(n=5)
2.6 G-Rh2对MS小鼠免疫系统的影响 与正常组比较,模型组小鼠脾脏中CD4+T 和CD8+T 细胞比例明显升高(P<0.05),MDSCs 细胞数量有一定程度的下降。与模型组比较,G-Rh2 组小鼠脾脏中CD4+T细胞数量明显减少(P<0.05);CD8+T 细胞和NK 细胞数量有一定程度地下降,MDSCs 细胞数量明显升高(P<0.01,图6A)。胸腺组织中CD4+T、CD8+T、NK和Treg细胞均无明显变化(图6B)。
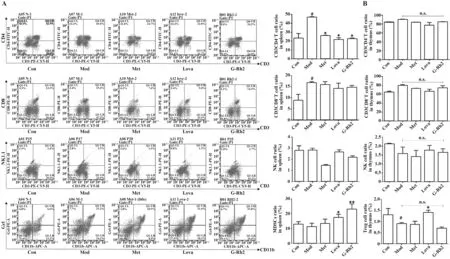
图6 G-Rh2对MS小鼠体内免疫环境的影响(n=5)Fig.6 Effects of G-Rh2 on immune function in MS mice(n=5)
3 讨论
诸多研究报道人参皂苷G-Rh2具有治疗代谢性疾病的作用,可提高糖尿病大鼠胰岛素敏感性和葡萄糖代谢能力,促进前脂肪细胞3T3-L1 脂质分解代谢预防肥胖[14-16],但是作用机制尚不清楚。本研究同样证实G-Rh2明显抑制MS小鼠肥胖和脂肪肝,并降低血脂TC、NEFA、LDL-C 水平。肝脏脂质代谢紊乱是引发高血糖、高血脂和肥胖等MS 系列症状的关键原因,一些药物可通过重编程肝脏脂质代谢治疗MS[17-18]。因此,本课题组利用脂质代谢组学探究G-Rh2 如何影响肝脏脂质代谢发挥治疗小鼠MS 的作用。结果表明经HFD 诱导的MS 小鼠肝脏中有大量脂质代谢物升高,最为显著的是TGs,而G-Rh2 降低MS 小鼠肝脏中多种脂质代谢物,包括TGs、DGs和PCs 等,说明G-Rh2 对脂肪肝的抑制与重塑肝脏脂质代谢模式有关。另外,有报道称与胰岛素抵抗患者相比,胰岛素敏感性患者的代谢产物中LPCs(C16:0)水平较高[19];本研究同样观察到G-Rh2 升高肝脏中LPCs,推测G-Rh2 改善MS 小鼠胰岛素抵抗效应可能通过升高LPCs实现。
除机体代谢紊乱外,MS和肥胖患者通常还伴随慢性低度炎症,他们的代谢器官肝脏和脂肪组织中存在大量的免疫细胞和细胞因子,如巨噬细胞、T 细胞、肥大细胞,炎症因子IL-6、IL-1β、TNF-α 和趋化因子CCL2、CXCL10[20-23]。MDSCs 在MS 疾病环境中具有降低免疫反应的作用,CD11b+Gr-1+髓样细胞在高血压小鼠外周血中增加,通过产生过氧化氢来抑制T 细胞活化,从而限制炎症反应和血压升高[24-26]。据报道G-Rh2 具有较强的抗炎活性,通过阻断MAPK 和NF-κB 信号通路抑制巨噬细胞激活和炎症因子产生[27]。本课题组也探究了G-Rh2 对MS 小鼠组织炎症及免疫系统的影响:给予G-Rh2 后,MS 小鼠肝脏中炎症细胞浸润减少,血清中炎症因子TNF-α、IL-6 水平降低,脾脏中CD4+T 细胞数量恢复至正常水平,MDSCs 数量增加。研究证实肝脏炎症与脾脏免疫状态密切相关,HFD 喂养的小鼠脾脏中T 细胞增殖加速和数量增加会导致脂肪性肝炎加重[28]。本研究观察到MS 小鼠脾脏中CD4+T 细胞和CD8+T细胞均明显升高,而G-Rh2 减少脾脏中CD4+T 细胞数量,增加MDSCs数量,说明G-Rh2限制脾脏中T细胞过度激活和增加MDSCs 细胞,有利于肝脏恢复免疫平衡。
MS患者脂质代谢和免疫相互影响,脂质代谢紊乱易导致免疫失衡引发肝脏炎症,而炎症反过来造成肝损伤,干扰其代谢功能,形成恶性循环[29]。有研究报道暴露于断奶后肥胖饮食的雌性C57BL/6J小鼠后代显示出肝损伤的迹象,暴露于母体肥胖会加剧肝脏炎症性损伤,ALT、TGs、IL-6、TNF-α 在肝脏中的含量增加[30]。G-Rh2 减少肝脏炎症细胞聚集,调节脾脏中CD4+T/MDSCs 细胞比例平衡并降低炎症因子IL-6、TNF-α 水平,这对抑制肝脏炎症性损伤有重要意义,同时G-Rh2 改变了肝脏的脂质代谢模式,尤其是减少TGs、DGs和PCs的过度堆积,有利于防止脂肪肝的形成。但是由于脂质代谢和炎症存在相互影响的关系,本研究尚不能确定G-Rh2 是通过解除代谢紊乱环境避免了炎症反应,还是通过抑制炎症进而改善肝脏代谢紊乱及高血脂、胰岛素抵抗、肥胖等MS症状。
综上所述,本研究发现G-Rh2 有改善胰岛素抵抗、肥胖和降血脂的作用,可用于治疗MS 的高血糖、高血脂、肥胖、脂肪肝等系列症状,机制可能是通过调控MS 小鼠免疫失衡阻止肝脏炎症性损伤,同时重塑脂质代谢从而发挥治疗MS的作用。

