Apelin/APJ 在人支气管上皮细胞炎症反应中的作用及地胆头对其影响的研究①
贾盼红 熊晓嫚 李 琪 周向东③ 唐欢欢 王 杰
(海南医学院第一附属医院呼吸内科,海口 570102)
细菌内毒素脂多糖(lipopolysaccharide,LPS)能够诱导气道上皮细胞、巨噬细胞等细胞产生大量炎症因子(IL-6、IL-8、IL-1β、TNF-α)的分泌,形成“炎症瀑布”,进而损伤机体[1-2]。目前针对“炎症瀑布”的治疗,除了使用皮质醇激素外,中医药对抑制炎症瀑布效应也具有独特的效果。本课题组前期发现苦味类中药可抑制炎症因子释放[3],地胆头(Ele⁃phantopus scaber Linn)是长江以南常用的民间中药,味苦,具有清热解毒、利尿消肿、抑菌等功效[4]。在本课题组前期实验及临床观察中已证实地胆头能够有效抑制社区获得性肺炎(community-acquired pneumonia,CAP)的炎症因子释放,有效改善CAP 症状,缩短治疗时间[5]。
Apelin 是近年来发现的一种肽类激素,是G 蛋白偶联受体APJ(apelin receptor)的内源性配体[6-7]。Apelin 通过减少线粒体ROS 触发的氧化损伤、线粒体介导的细胞凋亡以及由NF-κB 和NLRP3 炎症小体激活所诱导的炎症反应来预防LPS诱导的急性肺损伤(acute lung injury,ALI)[8]。因此,Apelin 对LPS诱导的ALI/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)有保护作用。然而,迄今为止,Apelin/APJ 在人体肺组织及支气管上皮细胞中的表达定位以及调控尚未得到研究。此外,地胆头对Apelin/APJ 的作用,以及地胆头发挥抗炎作用是否与Apelin/APJ 相关,目前也无相关研究。因此,本研究采用人支气管上皮细胞急性细胞肺损伤模型,观察Apelin/APJ定位表达,探讨外源性Apelin-13治疗对支气管上皮细胞炎症因子的影响。另外,本研究用地胆头干预LPS 致急性肺损伤细胞模型,探讨地胆头对急性肺损伤治疗作用以及对Apelin/APJ的影响。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人支气管上皮细胞16HBE 购自上海弘顺生物科技有限公司。
1.1.2 主要试剂 DMEM 高糖培养基(武汉普诺赛公司);胎牛血清(上海YEASEN);RIPA 裂解液、TEMED、Western 封闭液、PVDF 膜(0.22µm)、PVDF浸润活化泡液、ECL免疫印迹化学发光试剂(上海碧云天生物技术有限公司);CCK8试剂盒、脂多糖LPS(biosharp 公 司);Human IL-1β Quantikine ELISA Kit、Human IL-6 Quantikine ELISA Kit、Human TNF-α Quantikine ELISA Kit(上海酶联);Apelin、APJ 一抗、Anti-GAPDH 抗体、HRP 标记的山羊抗小鼠抗体(美国Abcam 公司);SureScriptTMFirst-Strand cDNA Synthesis Kit、ALL-in-oneTMqPCR Primer(中国易锦生物有限公司)。
1.1.3 主要仪器与设备 恒温水浴箱(苏州安泰空气技术有限公司);酶标仪(SynergyHTX 公司,美国);全自动化学发光图像分析系统(中国天能公司);Mx3OO5P 实时荧光定量PCR 仪(Stratagene 公司,美国);10 cm 细胞培养皿、6 孔板、12 孔板、96 孔板、200 µl PCR 管、无RNA 酶的吸头(Axygen 公司,美国);共聚焦激光显微镜(FV1000)。
1.2 方法
1.2.1 细胞培养、传代、冻存及复苏 16HBE 细胞用DMEM 高糖培养液常规培养,置于5%CO2和37 ℃培养箱内培养48 h 后换液,细胞融合至70%~80%时,终止消化,按1∶3的比例接种到培养皿中进行传代培养或接种到孔板中提取16HBE 细胞培养上清液、总蛋白及RNA继续后续实验。
1.2.2 地胆头提取液制备 地胆头采集于海南省儋州市那大镇城郊,经海南医学院科学实验中心易国辉研究员鉴定为菊科类地胆头草,取地胆头粉480 g,用95%乙醇热回流旋转蒸发共得22 g 浸膏,提取率4.5%。取地胆头浸膏10 mg,使用DMSO 50µl溶解,超声振荡1 h,使浸膏完全溶解,用9.5 ml完全培养基配制地胆头母液浓度为1 mg/ml。再分别配制20、40、80µg/ml地胆头液。
1.2.3 实验分组及给药 实验分6 组(n=8):正常对照组(阴性对照组),模型组(LPS组,10µg/ml),阳性对照组(LPS+Apelin-13 组,1 µmol/L),低、中、高地胆头组[LPS+ESE(20µg/ml)组、LPS+ESE(40µg/ml)组、LPS+ESE(80µg/ml)组]。
1.2.4 CCK8 测细胞活力 将细胞按照5×104个/孔(100 µl)接种于96 孔板,设6 组,培养24 h 后将20、40、80µg/ml地胆头提取液及Apelin-13(1µmol/L)各20µl 分别加入对应组,设4 个复孔,培养箱孵育3 h,将20 µl 10 µg/ml LPS 分别加入LPS 组、20、40、80µg/ml 地胆头组及Apelin-13 组,再次放入培养箱孵育16 h,每组每孔各加CCK8 10 µl,2 h 后酶标仪下测吸光度,设置450 nm,重复3次。按以下公式计算细胞活力:细胞活力(%)=实验组OD 值/空白组OD值×100%。
1.2.5 细胞免疫荧光、激光共聚焦显微镜观察细胞内Apelin/APJ 蛋白表达定位情况 细胞分组同
1.2.3 培养细胞密度达到80%时,弃去培养液,4%多聚甲醛固定细胞10 min。吸干残留液,滴加山羊血清工作液在室温孵育1 h。弃血清,再加入兔抗多克隆抗体(1∶100)过夜。第2 天取出用PBS 清洗,加入FITC山羊抗兔二抗。避光37 ℃孵育1 h。各组均加入DAPI。用抗荧光减灭剂封片。激光共聚焦显微镜下采集分析图像。
1.2.6 ELISA 检测细胞上清液IL-1β、IL-6、TNF-α的含量 细胞分组同1.2.3,将20、40、80 µg/ml 地胆头提取液及Apelin-13(1 µmol/L)各20µl 加入对应组,培养箱孵育3 h,将10µg/ml 20µl LPS 分别加入LPS 组、20、40、80 µg/ml 地胆头组及Apelin-13组,再次放入培养箱孵育16 h。严格按照其说明书操作,450 nm波长处测OD值。
1.2.7 Western blot 法检测Apelin、APJ 蛋白表达细胞分组及药物干预分别同1.2.3和1.2.6。每孔加RIPA 裂解液,细胞刮刮取细胞。4 ℃12 000 r/min离心。取上清液。采用BCA 法测定蛋白浓度。煮沸法使蛋白质变性。配制SDS-PAGE 凝胶。经SDS-PAGE 电泳分离,切胶、转膜,室温下在摇床上脱脂奶粉封闭液封闭2 h,PBST 洗涤,4 ℃孵育一抗12 h,二抗液室温孵育2 h。天能系统曝光捕获图片,Image J分析条带灰度值。
1.2.8 RT-PCR 检测Apelin、APJ mRNA 水平 按1.2.3进行细胞分组,PBS清洗贴壁细胞后加入裂解液,使RNA 充分溶解。药物干预同1.2.6,采用Sim⁃ply P 总RNA 提取试剂盒提取RNA。按SureScriptTMFirst-Strand cDNA Synthesis Kit 试剂盒说明书逆转录成cDNA。按照All-in-oneTMqPCR Primer 试剂盒说明书进行PCR扩增反应,实验重复3次,并设置空白对照组,保证各复孔之间的Ct值差异不超过1,引物购自GeneCopoeiaTM公司。根据2-ΔΔCt法分析目的基因的表达情况,ΔΔCt=ΔCt实验组-ΔCt对照组。
1.3 统计学分析 每组实验重复3次,统计分析用Graphpad prism8 软件进行。应用SPSS22.0 软件进行单因素方差分析。蛋白灰度值分析采用Image J软件。计量资料数据均采用±s表示,P<0.05 表示差异有统计学意义。
2 结果
2.1 Apelin/APJ 蛋白在气道上皮细胞及炎症损伤模型表达、定位 在正常对照组中,Apelin/APJ 表达于细胞膜,在给予LPS刺激时,细胞膜Apelin/APJ荧光强度明显变亮。而后给予地胆头提取液(20µg/ml)刺激细胞时,细胞膜Apelin/APJ 蛋白表达量明显增多,提示Apelin/APJ 系统在急性炎症损伤期间被激活,参与急性炎症损伤调节(图1)。
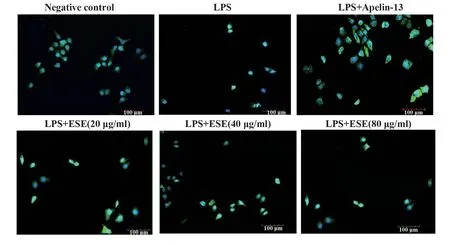
图1 Apelin/APJ 蛋白在气道上皮细胞及炎症损伤模型表达、定位Fig.1 Expression and localization of Apelin/APJ protein in airway epithelial cells and inflammatory injury model
2.2 Apelin-13 及地胆头提取物对气道上皮细胞细胞活力的影响 与正常对照组比较,LPS 诱导后细胞活力明显下降(P<0.05);与LPS组对比,Apelin-13干预后气道上皮细胞活力明显增高(P<0.05)。地胆头干预后气道上皮细胞活力明显提高,且浓度越高细胞活力增高越明显(P<0.05)。见图2。
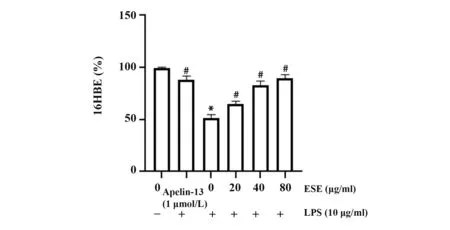
图2 Apelin-13 及地胆头提取物对气道上皮细胞细胞活力的影响Fig.2 Effects of Apelin-13 and extract of Elephantopus scaber Linn on viability of airway epithelial cells
2.3 Apelin-13 及地胆头提取物对气道上皮细胞炎症因子表达的影响 实验结果显示:与正常对照组相比,LPS 模型组IL-1β、IL-6、TNF-α 分泌显著增加(P<0.05);与LPS 组对比,地胆头干预后气道上皮细胞IL-1β、IL-6、TNF-α 分泌明显减少(P<0.05),且浓度越高分泌越减少,80 µg/ml 地胆头抑制炎症因子释放优于Apelin-13组(P<0.05)。见表1。
表1 地胆头对IL-1β、IL-6、TNF-α的影响(±s,n=8,pg/ml)Tab.1 Effects of elephantopus scaber linn on IL-1β,IL-6,TNF-α(±s,n=8,pg/ml)
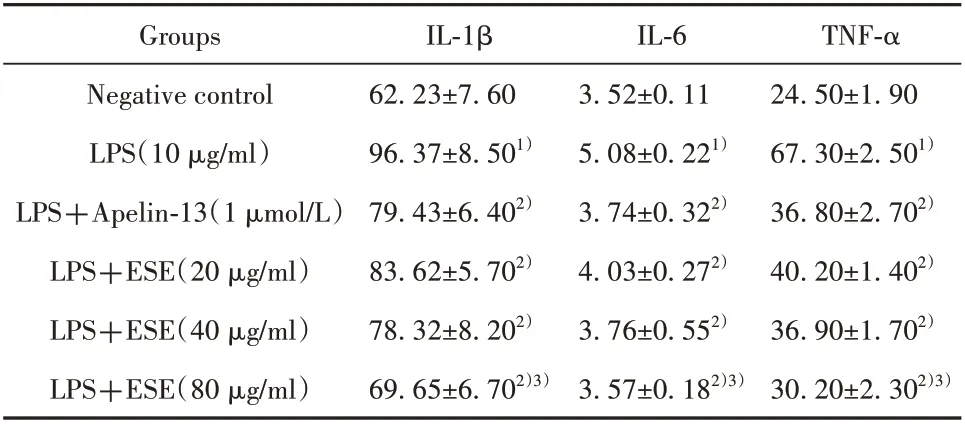
表1 地胆头对IL-1β、IL-6、TNF-α的影响(±s,n=8,pg/ml)Tab.1 Effects of elephantopus scaber linn on IL-1β,IL-6,TNF-α(±s,n=8,pg/ml)
Note:Compared with negative control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with LPS+Apelin-13,3)P<0.05.
TNF-α 24.50±1.90 67.30±2.501)36.80±2.702)40.20±1.402)36.90±1.702)30.20±2.302)3)Groups Negative control LPS(10µg/ml)LPS+Apelin-13(1µmol/L)LPS+ESE(20µg/ml)LPS+ESE(40µg/ml)LPS+ESE(80µg/ml)IL-1β 62.23±7.60 96.37±8.501)79.43±6.402)83.62±5.702)78.32±8.202)69.65±6.702)3)IL-6 3.52±0.11 5.08±0.221)3.74±0.322)4.03±0.272)3.76±0.552)3.57±0.182)3)
2.4 地胆头提取物对Apelin/APJ mRNA 转录的影响 与正常对照组相比,LPS(10 µg/ml)可使细胞Apelin/APJ mRNA 转录增高(P<0.05);与LPS 组相比,给予Apelin-13、地胆头干预后Apelin/APJ 的mRNA 转录水平进一步增高(P<0.05)。结果表明,LPS 可使Apelin/APJ 转录上调,Apelin-13、地胆头可进一步刺激气道上皮细胞Apelin/APJ转录(图3)。
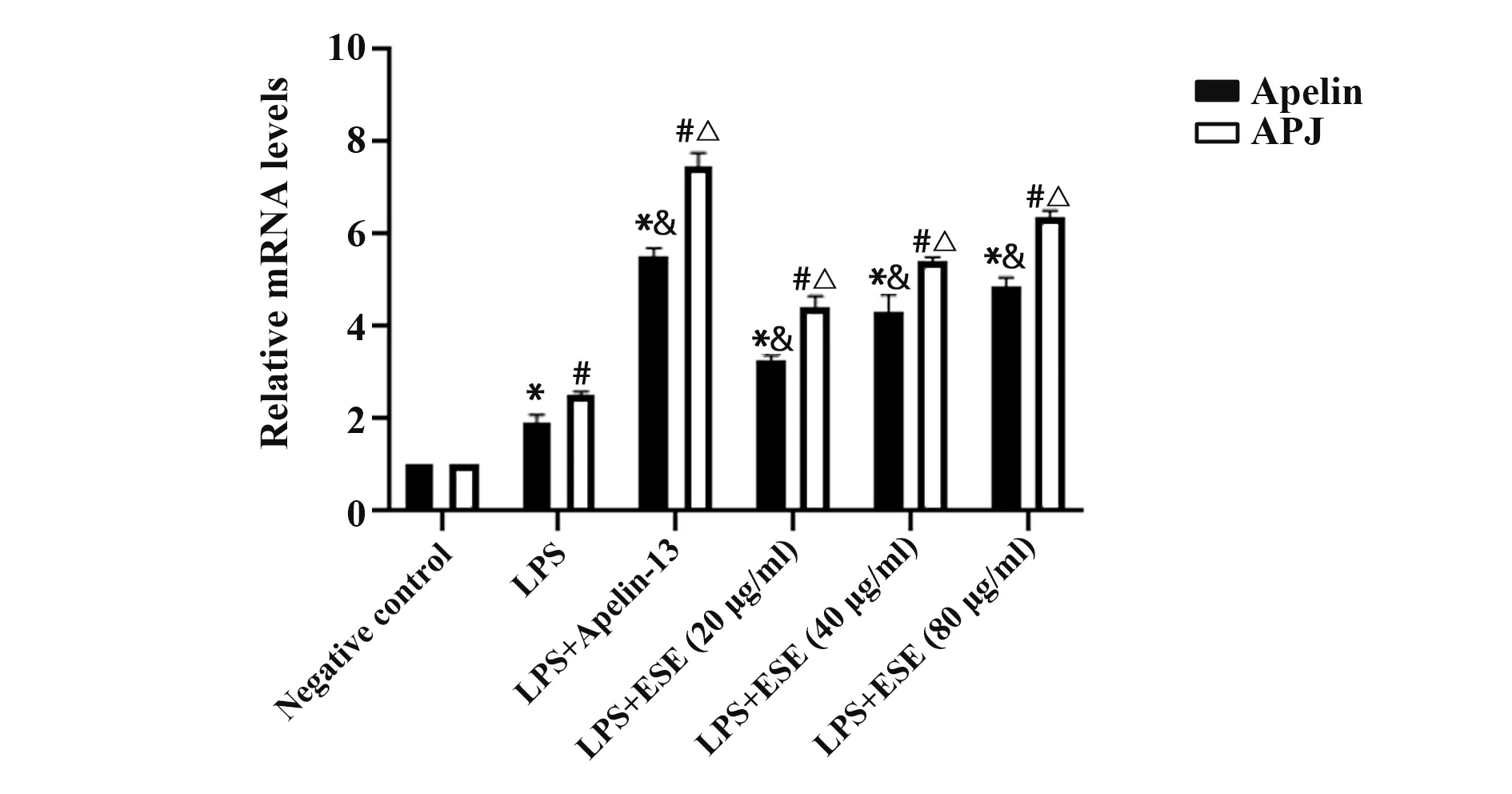
图3 地胆头提取物对Apelin/APJ mRNA 转录的影响Fig.3 Effects of extract from Elephantopus scaber Linn on Apelin/APJ mRNA transcription
2.5 地胆头提取物对Apelin/APJ蛋白表达的影响与正常对照组相比,LPS(10µg/ml)可使支气管上皮细胞Apelin/APJ 表达增高(P<0.05);与LPS组相比,给予Apelin-13、地胆头干预后Apelin/APJ 的表达水平进一步增高(P<0.05)。结果表明:LPS 可使Apelin/APJ 表达上调,Apelin-13、地胆头可进一步刺激支气管上皮细胞Apelin/APJ表达(图4)。
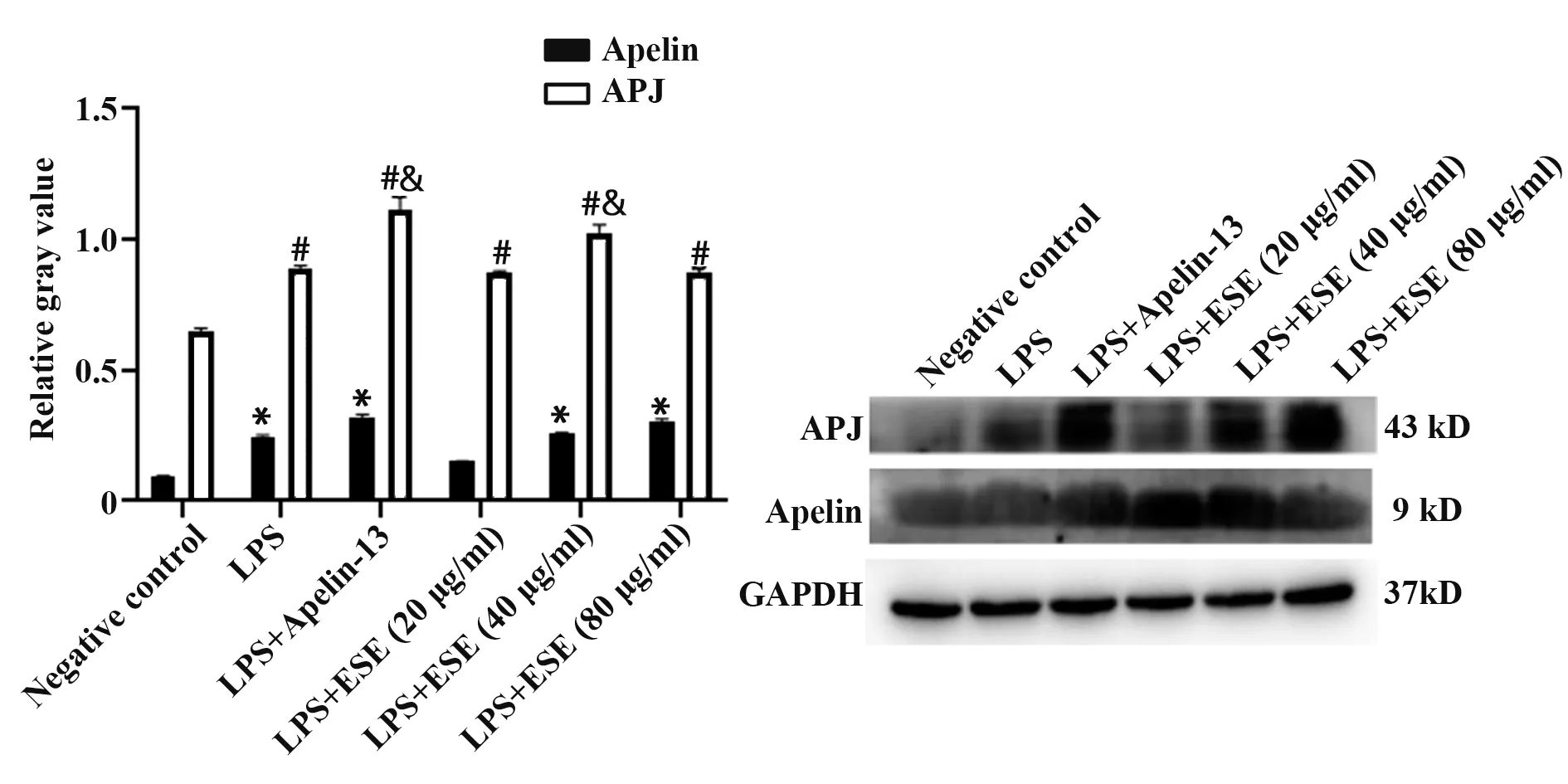
图4 地胆头提取物对Apelin/APJ蛋白表达的影响Fig.4 Effects of extract from Elephantopus scaber Linn on Apelin/APJ protein expression
3 讨论
感染性疾病是临床常见病,呼吸系感染性疾病尤为常见,呼吸系感染性疾病直接参与其他多种呼吸系疾病的进展、恶化,是造成全球患者发病及死亡的主要原因[9]。感染性疾病中生物因素最为常见,细菌内毒素(LPS)可诱导气道上皮细胞、巨噬细胞等细胞炎症因子(IL-6、IL-8、IL-1β、TNF-α)的分泌、释放,引起ALI“炎症风暴”。临床上针对“炎症风暴”炎症因子释放的药物是糖皮质激素,虽然激素对抑制炎症因子释放效果明显,但较多患者存在激素抵抗,高剂量糖皮质激素增加患者股骨头坏死发病率,因此临床上针对呼吸系统感染性疾病治疗急需新的治疗靶点和策略[10]。另外在介导肺部炎症和损伤的机制及途径等方面已被广泛研究,但关于预防肺部感染和损伤的机制及途径研究较少,很少有内源性抗肺损伤机制的报道[11-12]。
本实验通过培养支气管上皮细胞及LPS构建急性肺损伤细胞模型,首先以细胞免疫荧光法激光共聚焦技术观察各组细胞胞内Apelin/APJ 分布,阐明Apelin/APJ 蛋白为支气管上皮细胞膜上表达。LPS刺激使支气管上皮细胞Apelin/APJ 膜蛋白表达量明显增多,提示Apelin/APJ 系统在ALI 期间被激活。其次,ELISA 检测不同分组的细胞炎症因子释放水平,结果显示LPS 使细胞炎症因子表达明显增多,Apelin-13 及不同浓度梯度地胆头组药物干预组IL-1β、IL-6、TNF-α 明显下降,提示Apelin-13 及地胆头可抑制IL-1β、IL-6、TNF-α 炎症因子释放,抑制炎症损伤。采用Western blot 法明确了Apelin-13 及不同浓度梯度地胆头组药物干预细胞中Apelin/APJ表达量相较于对照组及LPS组增高,再次提示Apelin/APJ参与急性肺损伤调控。利用qPCR 检测细胞Apelin/APJ 转录水平,结果提示Apelin/APJ 系统在急性炎症损伤期间被激活,参与急性炎症损伤调节。验证了该通路可以抵消炎症和损伤反应,防止失控的肺损伤。同时也提出中草药地胆头抗炎作用与Ape⁃lin/APJ 通路相关,与Apelin-13 阳性对照组有类似作用。
虽然Apelin-APJ 途径是ALI 保护机制,但Ape⁃lin 较短的血浆半衰期限制目前的研究应用于临床治疗。长效APJ 受体激动剂的开发将克服这一局限。中草药毒副作用相对较少,能够从多种途径发挥抗炎性,在新药研发领域一直备受关注[13-14]。本课题组研究证实地胆头可有效抑制社区获得性肺炎炎症因子释放,有效减少患者住院时间,减轻症状,同时也证实地胆头能够显著增加AECOPD 治疗效果,增强抗氧化能力,明显改善肺功能。地胆头抑制炎症因子释放。机制可能与TLR4/NF-κB 通路相关[15]。目前关于中草药抗炎作用的研究,较少涉及分子水平层面上。然而中草药具有多种有效成分,往往具有多靶点抗炎性,造成研究者及医务工作者对大多数中草药抗炎作用的具体分子机制了解不够深入及全面,至今发表从基因水平研究中草药抗炎作用的报道也不多,以致严重阻碍了中草药在世界范围内的推广及临床应用[16]。因此运用现代科学方法研究传统中草药的抗炎机制是发展宏大中医药的必经之路,探寻中草药抗炎新靶点分子机制,寻找抗炎性强且毒副作用低的抗炎中草药为大势所趋[17]。

