女贞子多糖联合布地奈德在哮喘幼鼠模型中的免疫调节及抗氧化作用研究①
吴振奎 钟丽花 刘延霞 刘玉玲 (海南现代妇女儿童医院儿科,海口 571100)
哮喘是一种常见的慢性肺部炎症性疾病,其特征为气道高反应性、可变性气流受限和支气管重塑[1-2]。尽管哮喘发病机制和治疗手段研究越来越深入,但全球哮喘发病率仍不断上升。哮喘作为目前9 岁儿童最常见慢性疾病之一,其患病率备受关注[3]。目前哮喘治疗主要以药物为主,可分为控制患者病情和缓解症状两类。长期口服或静脉注射糖皮质激素可引起免疫抑制和库欣综合征等副作用。吸入普通剂量的糖皮质激素通常不会引起不良反应[4]。但吸入糖皮质激素后,约有80%~90%药物沉积于咽部并被吞入胃肠道,最终沉积的糖皮质激素会引起咽部或全身不良反应。因此,有必要寻找其他有效药物替代或减少糖皮质激素用量,从而减少患者不良反应。
目前认为CD4+T淋巴细胞失衡引起的细胞因子异常释放是引起气道损伤、反应性增强、重塑的主要原因[5-6]。CD4+T细胞根据功能不同可分为辅助性T(T helper,Th)细胞和调节性T 细胞(T regulatory cell,Treg)。Treg 主要调节免疫应答和其他免疫细胞功能,从而将涉及T 细胞的免疫应答限制在一个适当范围,以避免损伤机体[7]。Treg 有多种亚型,其中CD4+CD25+Treg 可抑制Th 细胞,目前已在哮喘研究领域得到广泛关注[8]。除Treg 外,自然杀伤(natural killer,NK)细胞作为一种特殊的内生淋巴细胞,同样在对哮喘治疗中发挥关键作用,NK 细胞可通过与树突状细胞(dendritic cells,DCs)作用并分泌炎症因子发挥免疫调节作用[9]。
此外,研究发现炎症细胞可产生活性氧(reac⁃tive oxygen species,ROS),内源性和外源性ROS 与气道炎症和哮喘严重程度有关[10]。由于抗氧化物是对抗氧化应激所必需的,寻找具有抗氧化活性的哮喘治疗药物具有极大前景[11]。
女贞子属木犀科,呈无叶绿素表型,因其金色叶子而被广泛用作园艺灌木[12]。女贞子虽具有较高观赏价值和环保价值,但其治疗潜力尚不明确。LIU 等[13]在环磷酰胺诱导的小鼠免疫抑制模型中发现,女贞子多糖(Ligustrum vicaryiL. fruit polysac⁃charide,LVFP)具有免疫调节和抗氧化作用。鉴于尚无关于LVFP 在儿童哮喘中作用的报道,本研究拟通过建立哮喘幼鼠模型研究LVFP 对免疫和氧化的影响。
1 材料与方法
1.1 材料 SPF 级6 周龄BALB/c 小鼠(20~22 g)购自常州卡文斯实验动物有限公司;马斯亮蓝G-250购自中国索莱宝有限公司;卵清蛋白(OVA)、Giemsa染色液购自美国Sigma-Aldrich 公司;氢氧化铝购自美国Thermo Scientific 公司;FITC-CD16、PE-CD56、FITC-CD11c、PE-CD86(B7-2)、FITC-CD4 及PECD25 购自美国eBioscience 公司;IL-4、IL-5、IL-9、IL-10、IL-13、IFN-γ及TGF-β ELISA试剂盒购自美国BD Biosciences Pharmmgen;RIPA 强裂解液、BCA 检测试剂盒、封闭液、一抗及二抗稀释液、ECL 发光显影液购自上海碧云天生物技术有限公司;一抗NLRP3(ab214185)、硝基络氨酸(ab183392)、超氧化物歧化酶2(superoxide dismutase 2,SOD2,ab13533)、Optic Atrophy 1(OPA1,ab157457)、线粒体融合蛋白2(mitofusin 2,Mfn2)、动力蛋白相关蛋白1(dynamin-re⁃lated protein 1,DRP1,ab184247)、线粒体分裂蛋白1(mitochondrial fission protein 1,Fis1,ab71498)及β-actin(ab179467)购自英国Abcam 公司;傅里叶变换红外光谱仪IRTracer-100 购自日本岛津公司;高压离子色谱(high-performance ion chromatography,HPIC)系统(Dionex ICS-5000+HPIC)、化学发光成像系统购自美国Thermo Scientific 公司;高效凝胶过滤色 谱(high-performance gel filtration chromatography,HPGFC)系统购自美国Waters 公司;流式细胞仪FC500、台式高速离心机购自美国Beckman Coulter公司;FinePointeTMRC气道阻力与肺顺应性检测系统购自美国BUXCO 公司;一抗多功能酶标仪购自美国Biotek公司。
1.2 方法
1.2.1 LVPF 提取与纯化 将干燥的女贞子研磨成粉,40 目筛过滤,粉末溶于丙酮(粉末与丙酮比例为1∶3),振荡24 h去除脂质,3 000 r/min 离心5 min,弃上清,烘干,加入一定量蒸馏水(8∶11)50 ℃、250 w超声提取80 min,棉花过滤,3 000 r/min 离心3 min去除残渣,70%乙醇沉淀浓缩上清,95%乙醇重复此过程,去上清,加入蒸馏水溶解提取物,3 000 r/min离心3 min 去除残渣。采用DM101 大孔吸附树脂去除色素。Sevage 试剂(氯仿/正丁醇体积比为4∶1)去除蛋白至考马斯亮蓝G-250 检测未发现变色反应。将多糖冷冻干燥24 h,得到冷冻LVPF 粉末。采用透析袋(3 500 D)连续2 d 去除多糖中的小分子,每12 h 更换1 次蒸馏水,Sephadex G-200 柱层析法纯化LVFP。
1.2.2 LVFP 分析与鉴定 LVFP 与纯溴化钾粉混合后置于玛瑙研钵中,红外线灯下均匀研磨,傅里叶变换红外光谱仪检测。HPIC 检测LVFP 单糖,将5 mg LVFP 溶 解 于1 ml 2 mol/L 三 氟 乙 酸,121 ℃水解2 h,0.45µm 微孔滤膜过滤。在ICS-5000 离子色谱仪上采用CarboPac-PA20 柱和脉冲安培检测器进行单糖色谱分离,调整离子色谱分离条件并检测8 种单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和果糖)混合物,0.5 ml/min恒流梯度洗脱[13]。采用HPGFC 进行多糖分子质量分析,多糖样品在液相中溶解,微孔滤膜过滤。用于绘制标准曲线的分子量分别为135 350 D、36 800 D、9 750 D、2 700 D和180 D。
1.2.3 分组、幼鼠哮喘模型建立及LCVP 处理 所有幼鼠在空调动物房中以12 h 光/12 h 暗循环饲养,自由饮水进食。本研究所有动物实验方案均经海南现代妇女儿童医院伦理委员会批准。40只6周龄幼鼠随机分为4 组:对照组(Control)、哮喘组(OVA)、OVA+布地奈德组、OVA+LVFP+布地奈德组。第1~3 天和第14 天腹腔注射200 µl 含0.8 mg氢氧化铝及50µg OVA的生理盐水致敏溶液对幼鼠进行致敏,第14、17、20、23 和27 天将幼鼠置于雾化器内吸入2%OVA 30 min 激发哮喘症状。除常规饮食外,Control 组幼鼠采用等体积生理盐水代替OVA进行致敏和激发,OVA+布地奈德及OVA+LVFP+布地奈德组幼鼠在第14~27天内每日分别给予布地奈德(3 µg/d,吸入)或LVFP[(400 mg/(kg·d),灌胃]+布地奈德(3µg/d,吸入)。第28 天测定所有组幼鼠气道反应性,第29 天腹腔注射戊巴比妥后处死幼鼠,结扎右肺,0.5 ml 预冷PBS 灌洗左肺3 次,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),1 000 r/min 离心5 min,收集上清,ELISA 测定炎症因子水平,PBS重悬沉淀进行炎症细胞计数,留取肺组织,Western blot检测氧化蛋白水平,-80 ℃保存待用。免疫细胞分离方法参考文献[14]。
1.2.4 流式细胞术分析DCs、NK 细胞及Treg 比例 流式细胞仪测定骨髓源性树突状细胞(bone marrow derived DCs,BMDCs)、NK 细胞及Treg 比例,CXP 软件2.3 分析。采用FITC-CD11c 和PE-CD86(B7-2)对BMDCs 进行染色,FITC-CD16 和PE-CD56对NK细胞进行染色,FITC-CD4 和PE-CD25 对Treg进行染色。
1.2.5 气道反应性检测 气道阻力与肺顺应性检测系统测定幼鼠气道反应性。第28 天腹腔注射60 mg/kg 戊巴比妥,行气管切开术,呼吸频率设为160 次/min,吸入10µl 乙酰胆碱,浓度依次增高,分别为0、1、2、4、8 mg/ml,记录3 min内最大气道阻力。
1.2.6 BALF 炎症细胞计数 采用血细胞计数仪测定重悬BALF细胞总数。Wright-Giemsa染色法鉴别嗜酸性粒细胞、淋巴细胞、中性粒细胞和单核细胞。
1.2.7 ELISA测定BALF中炎症因子IL-4、IL-5、IL-9、IL-10、IL-13、IFN-γ及TGF-β水平 根据ELISA试剂盒说明书对BALF上清中炎症因子进行测定,多功能酶标仪进行吸光度读数,绘制标准曲线,计算浓度。
1.2.8 Western blot 测定肺组织氧化相关蛋白表达 向肺组织中加入一定量RIPA 强裂解液,研磨、超声至得到肺组织匀浆,4 ℃、15 000 r/min 离心15 min,取上清,BCA 法测定蛋白浓度,按1∶4 加入蛋白缓冲液,100 ℃加热变性5 min。12%SDS-PAGE凝胶电泳分离等量肺组织匀浆蛋白,转至PVDF 膜,室温封闭2 h,加入相应一抗4 ℃摇床孵育过夜,次日回收一抗,TBST 洗3 次,5 min/次,加入二抗室温孵育,TBST 洗3 次,ECL 荧光成像系统中滴加显影液进行蛋白显影,以β-actin为内参。
1.3 统计学分析 采用SPSS18.0软件进行统计学分 析,数 据 以±s表 示,组 间 比 较 采 用Student'st检验,P<0.05为差异具有统计学意义。
2 结果
2.1 LVFP 鉴定 FTIR 观察LVFP 多糖结构表征,3 331 cm-1处特征宽峰对应于O-H(可能包括N-H)伸缩振动,2 920 cm-1处吸收峰对应C-H 伸缩振动吸收峰和糖吸收峰,1 587 cm-1处吸收峰表明-OH 弯曲振动模态,1 407 cm-1处峰值由C-H 弯曲振动导致,1 069 cm-1处吸收峰表明醇羟基形式C-O 伸缩弯曲振动模态(图1A)。HPIC 分析LVFP 单糖组成,根据单糖标准品洗脱时间、参照标准曲线,对多糖中所有单糖进行鉴定,确定LVFP 主要由鼠李糖、阿拉伯糖、半乳糖和葡萄糖组成,摩尔比为1.73∶7.51∶4.52∶1.59(图1B、C)。以水溶性物质右旋糖酐(分子量依次为180 D、2 700 D、9 750 D、368 000 D 和135 350 D)作为标准品,结合HPGFC法绘制标准曲线测定LVFP 分子量为88 974 D,以上结果与LIU 等[13]报道基本一致。
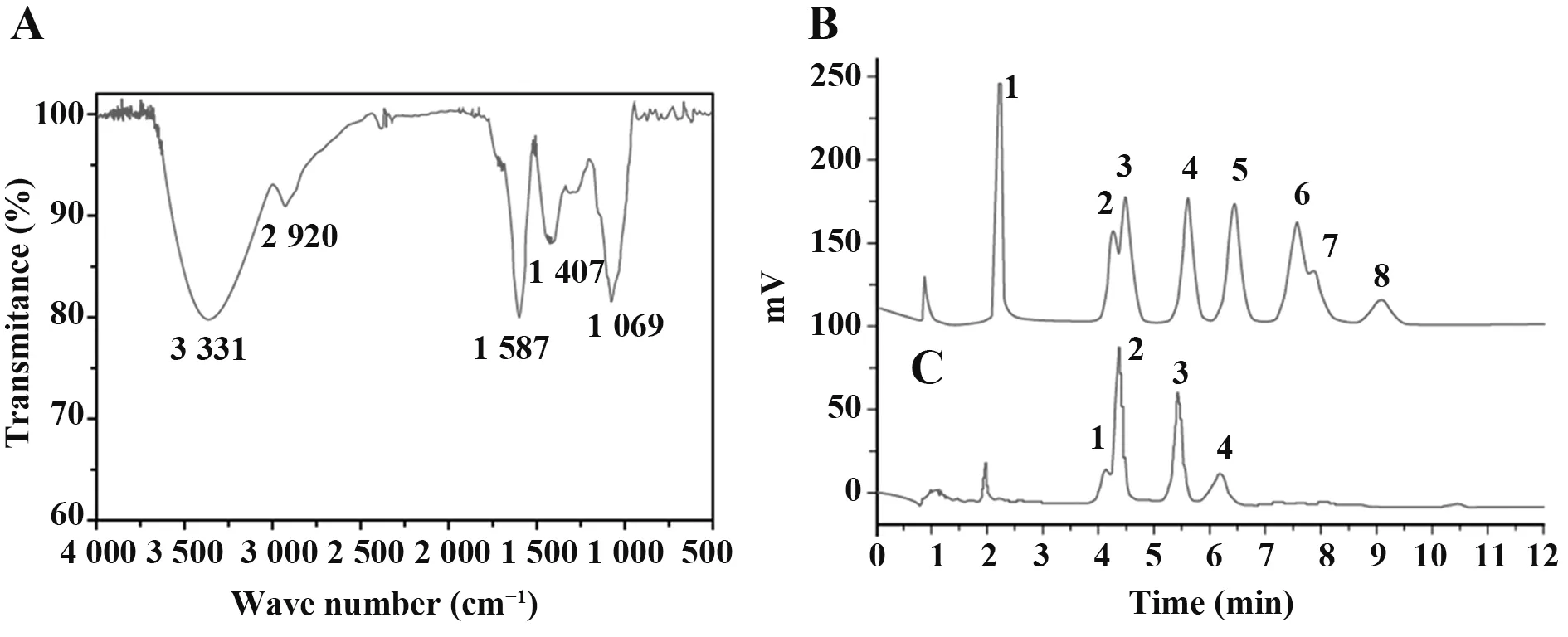
图1 LVFP结构特征鉴定Fig.1 Structural characterization of LVFP
2.2 LVFP 调节哮喘幼鼠DCs、NK 细胞、Treg 比例与Control 相比,OVA 组、OVA+布地奈德及OVA+LVFP+布地奈德组幼鼠DCs 显著增多(P<0.05),而NK 细胞和Treg 明显减少(P<0.05)。与OVA 组相比,单独给予布地奈德及LVFP+布地奈德联合用药均可显著减少DCs(P<0.05),而NK 细胞和Treg 增加(P<0.05),其中,LVFP+布地奈德联用效果强于布地奈德单独用药(P<0.05,图2)。

图2 流式细胞术测定各组幼鼠DCs、NK细胞及Treg比例Fig.2 Flow cytometric analysis of DCs,NK cells,and Treg of young mice in each group
2.3 LVFP 降低哮喘幼鼠的气道高反应性 与Control组相比,OVA 处理幼鼠在乙酰胆碱浓度为1、2、4 和8 mg/ml 时均表现出显著气道阻性(P<0.05)。与OVA 组相比,单独给予布地奈德及LVFP+布地奈德联合用药在乙酰胆碱浓度为1、2、4 和8 mg/ml 时气道阻性显著降低(P<0.05),LVFP+布地奈德联用效果更为显著(P<0.05,图3)。

图3 LVFP与布地奈德对哮喘幼鼠气道反应性的影响Fig.3 Effects of LVFP and budesonide on airway resis⁃tance of young mice with asthma
2.4 LVFP 抑制哮喘幼鼠气道炎症细胞聚集 与Control 组相比,OVA 处理幼鼠BALF 中嗜酸性粒细胞数明显增加(P<0.05),单独给予布地奈德或LVFP 与布地奈德联用可明显逆转该变化(P<0.05),且LVFP 与布地奈德联用效果更强(P<0.05)。巨噬细胞、中性粒细胞及淋巴细胞变化与嗜酸性粒细胞相似(P<0.05)。与OVA组相比,单独给予布地奈德或LVFP 与布地奈德联用可显著减少炎症细胞总数(P<0.05),且LVFP 与布地奈德联用抑制作用更为显著(P<0.05,图4)。

图4 LVFP 与布地奈德对哮喘幼鼠BALF 中炎症因子数的影响Fig.4 Effects of LVFP and budesonide on immune cell counts in BALF of young mice with asthma
2.5 LVFP 可降低哮喘幼鼠BALF 中炎症因子水平 与Control组相比,幼鼠经OVA处理后,BALF中IL-4、IL-5、IL-13、IL-9、IL-10 和TGF-β 水平显著升高(P<0.05),单独给予布地奈德或LVFP 与布地奈德联用可显著逆转上述炎症因子水平变化(P<0.05),各组IFN-γ水平差异无统计学意义(P>0.05,图5)。

图5 LVFP与布地奈德对哮喘幼鼠BALF中炎症因子水平的影响Fig.5 Effects of LVFP and budesonide on inflammatory factors levels in BALF of young mice with asthma
2.6 LVPF 增强哮喘幼鼠肺组织抗氧化能力 与Control 组相比,幼鼠经OVA 处理后,肺组织中氧化相关蛋白Nitrotyrosine 及SOD2 表达明显增加(P<0.05),代表线粒体融合和分裂相关蛋白OPA1、Mfn2、DRP1 及Fis1 表达呈不同水平增高(P<0.05),单独给予布地奈德或LVFP 与布地奈德联用可显著抑制上述蛋白表达(P<0.05,图6)。

图6 LVFP与布地奈德对哮喘幼鼠肺组织中氧化相关蛋白的影响Fig.6 Effects of LVFP and budesonide on oxidation related proteins in lung tissues of young mice with asthma
3 讨论
目前哮喘主要治疗药物包括支气管扩张剂、糖皮质激素、白三烯拮抗剂、单克隆抗体等,但生产成本较高,且控制哮喘症状效果不甚满意[15-16]。此外,约5%~10%严重哮喘患者病情控制不佳,常规治疗难以控制[17]。尽管医药行业发展迅速,但新的生物疗法并未在哮喘治疗中取得理想成果[18]。因此,研究提出可采用药用植物作为治疗哮喘替代或补充方法[19]。BLANC 等[20]研究表明,约24%哮喘患者已采用草药作为辅助治疗。儿童作为哮喘高危人群,为其寻找有效治疗药物引起广泛关注。
LVFP 作为女贞子重要活性成分,目前已有研究报道其具有抗炎、抗氧化、抗癌和调节免疫等作用[21]。邹慧等[22]发现LVFP 可通过促进淋巴细胞增殖促进小鼠非特异性免疫及细胞免疫;朱琪等[23]在四氯化碳诱导肝损伤小鼠模型中证实,LVFP 可通过调节肝脏丙二醛表达抑制脂质过氧化反应而有效缓解化学性肝损伤;佘亮亮等[24]研究证实LVFP在脂多糖诱导的大鼠睾丸支持细胞炎症损伤中具有保护作用,可抑制细胞凋亡,并在炎症过程中调节该细胞分泌的IL-1β、IL-6和TGF-β 水平。鉴于目前尚无LVFP 在哮喘中的相关作用研究,因此本研究首先从女贞子中提取LVFP,并通过FTIR、HPIC及HPGFC 技术对LVFP 表征进行鉴定,构建OVA 致敏和激发的哮喘模型,研究LVFP 是否可作为布地奈德的辅助药物发挥免疫调节及抗氧化作用。
目前研究认为支气管哮喘发病与细胞免疫功能紊乱密切相关。NK 细胞是一种重要的天然免疫细胞,近期研究表明与健康对照组相比,哮喘患者外周血中分离的NK 细胞对肿瘤细胞株的杀伤能力降低,尽管其可分泌大量细胞毒调节因子[25]。研究证实,过敏性哮喘患者NK 细胞亚群明显减少,提示哮喘发生与NK 功能抑制有关[26]。此外,Treg 在平衡炎症反应和调节免疫反应中发挥重要作用。Treg可通过多种抑制机制负反馈调节T 细胞,如下调T 细胞因子表达,抑制T 细胞活化和分化等[27]。吸入无害的过敏原时,DCs 可被上皮细胞直接激活或间接激活,启动细胞免疫应答。本研究证实LVFP与布地奈德联用可调节DCs、NK 细胞和Treg 比例。与布地奈德单用相比,LVFP 与布地奈德联用可显著减少DCs,提示哮喘幼鼠免疫应答得到缓解。此外,本研究还发现LVFP+布地奈德联用可显著降低支气管高反应性(P<0.05),并可显著减少BALF 中总炎症细胞数和嗜酸性粒细胞数,提示LVFP 与布地奈德联用不仅可改善哮喘症状,还可调节免疫细胞作用。
已知哮喘是一种过敏性炎症性呼吸道疾病。慢性哮喘患者持续表现为慢性炎症和氧化应激[28]。肺上皮细胞和免疫细胞不断被激活,可释放多种炎症细胞因子、炎症递质和氧化分子,损伤细胞和组织从而损伤肺功能[29]。因此本研究除检测炎症细胞数及淋巴细胞比例外,还检测了BALF 中炎症因子表达。研究发现哮喘状态下,幼鼠BALF 中IL-4、IL-5、IL-13、IL-9、IL-10 和TGF-β 水 平 显 著 升 高,LVFP 与布地奈德联用可显著逆转上述炎症因子水平变化,发挥抗炎作用,而IFN-γ 水平未见明显变化。提示LVFP 与布地奈德联用不仅可通过调节免疫细胞数发挥免疫调节作用,其还可通过抑制炎症因子表达发挥抗炎作用。
氧化应激方面,本研究选择硝基酪氨酸作为氧化应激指标,硝基酪氨酸作为一种亚硝化蛋白产物,其含量可作为过氧亚硝酸盐阴离子水平的标志[30]。本研究表明,OVA 致敏和激发可诱导幼鼠体内硝基酪氨酸表达,而LVFP 与布地奈德联用则可逆转此作用,表明幼鼠哮喘状态下可发生氧化应激,LVFP 与布地奈德联用可发挥抑制作用。此外,作为一种有效的抗氧化剂,SOD2 在OVA 激发后也显著增加,而LVFP 与布地奈德联用可降低其水平,可能原因为哮喘促进SOD2 表达从而发挥抗氧化作用,而LVFP 与布地奈德联用在幼鼠体内与SOD2 发挥类似作用,为防止过度过氧化而SOD2 表达减少,形成氧化与抗氧化动态平衡。
已有研究报道,氧化应激诱导的线粒体功能障碍可促进哮喘患者和动物模型炎症反应和气管重塑[31]。线粒体在细胞内经历动态分裂/融合循环,该过程受线粒体生物标志物(包括OPA1、Mfn1/2、DRP1 和Fis1)调控,维持分裂/融合循环精确性对线粒体功能至关重要[32]。本研究发现,OVA 激发可显著增加融合/分裂蛋白标志物OPA1、Mfn2、DRP1 及Fis1表达,而LVFP与布地奈德联用可逆转上述蛋白表达变化,提示抗氧化应激作用中,LVFP 与布地奈德可通过保护线粒体功能发挥正向调节作用。
综上所述,本研究通过从女贞子中提取LVFP,OVA 致敏和激发的哮喘幼鼠模型发现,LVFP 与布地奈德联用通过改善气道反应性、调节免疫细胞比例、抑制炎症因子、氧化及线粒体融合/分裂相关标志蛋白表达发挥保护作用。提示LVFP 与布地奈德联用有望成为治疗小儿哮喘、改善症状的有效方法。

