过敏性哮喘患者外周血循环TFR细胞的变化及临床意义①
季 拓 龚 芳 吕蓓丽 申卫红 白仲虎 金 坚 (江南大学生物工程学院,无锡 214122)
过敏性哮喘是指由过敏原引起以免疫球蛋白E(immunoglobulin E,IgE)水平升高为主要特征的慢性呼吸道炎症反应,流行病学调查显示过敏性哮喘患者占哮喘患者的50%以上,且随着工业化的推进、过敏原的增多,其发病率逐年提升[1-2]。传统观点认为过敏性哮喘主要受2 型辅助性T 细胞(T helper 2 cell,TH2)免疫反应主导[3]。近年来一些新T 细胞亚群如辅助型T细胞17(helper T cell 17,TH17)、辅助型T 细胞9(helper T cell 9,TH9)、调节性T 细胞(regula⁃tory T cell,TREG)在哮喘炎症中的作用也逐渐被认识[1,4]。本课题组对滤泡辅助性T 细胞(follicular helper T cells,TFH)开展了系统研究,发现哮喘中TFH细胞异常活化并发生极化偏移,其中TFH2 细胞亚群通过分泌细胞因子IL-21、IL-4 促进B 细胞向浆细胞分化、Ig 类别转换和IgE 亲和力成熟等环节,使得IgE水平异常增高从而加重哮喘炎症[5-10]。
滤泡调节性T 细胞(T follicular regulatory cell,TFR)是近年来发现的一类负向调控生发中心体液免疫反应的最主要CD4+T 细胞亚群,TFR兼具TREG细胞及TFH细胞的双重特性[11]:不仅表达TREG细胞特征分子如特异转录因子叉头翼状转录因子3(Foxp3)、细胞毒性T 淋巴细胞相关抗原4(CTLA-4)和Blimp-1,而且表达TFH细胞标志物如程序性死亡受体1(PD-1)、趋化性细胞因子受体5(CXCR5)、特异转录因子B 细胞淋巴瘤基因6(Bcl-6)和Ki67 等[12-13]。TFR细胞在次级淋巴器官生发中心通过抑制TFH细胞和B 细胞的过度活化,维持生发中心抗体生成的免疫平衡[14]。由于TFR细胞定位于淋巴滤泡,且淋巴组织取材的困难一度迟滞临床研究。2014 年,外周血循环TFR(circulating TFR,cTFR)细胞一经发现便引起了众多学者关注,相继有越来越多的文献报道在多种自身抗体相关疾病如系统性红斑狼疮、干燥综合征和类风湿性关节炎中cTFR细胞数量或功能变化,且cTFR细胞数量与疾病相关自身抗体水平高度相关[15-18]。然而,cTFR在过敏性哮喘发病中的作用尚未明确。本研究通过检测过敏性哮喘患者的外周血cTFR细胞比例及其相关细胞因子表达的变化,旨在探讨cTFR在过敏性哮喘中的作用及可能机制。
1 资料与方法
1.1 资料
1.1.1 一般资料 招募江南大学附属医院2021 年1 月至2021 年12 月收治的25 例过敏性哮喘患者,采集临床资料(表1)。过敏性哮喘患者选择标准参照全球哮喘防治创议(the global initiative for asthma,GINA)和2020 年中华医学会呼吸病学分会哮喘学组制定的《支气管哮喘防治指南》[19],即有胸闷、喘息、咳嗽的临床症状,有可逆性气流受限的客观证据,且排除其他可导致哮喘样症状的疾病;暴露于过敏原环境可诱发或加重症状;过敏原SPT 或IgE 中至少有一项阳性。所有病例在入选前一周内未使用糖皮质激素或其治疗哮喘的药物,无其他慢性病史且一周内无急性感染。选择同期在医院体检的健康志愿者为对照,均无慢性疾病以及过敏史,皮肤过敏原点刺试验为阴性,血清过敏原特异性抗体为阴性。两组受试者的性别、年龄的差异均无统计学意义(P>0.05)。本研究获得江南大学附属医院学术伦理委员批准,所有受试对象均签署知情同意书。
1.1.2 材料 Ficoll-PaqueTMPREMIUM 购自GE Healthcare(货 号17-1440-02);PBS 购 自CORNING(货号21-040-CV);DMSO 购自Sigma(货号D2650);FBS 购自Biological Industries(货号BI04-001-1A);细胞因子检测试剂盒购自Quanto Bio(货号C191016)。流式抗体见表2。
1.2 方法
1.2.1 PBMCs 和血清的分离 采集健康志愿者和哮喘患者空腹静脉血4 ml,置于含有EDTA 抗凝剂的真空采血管中,Ficoll 密度梯度离心法分离PBMCs。用1 ml 含10% DMSO 的FBS 将2.5×106个PBMCs 置于细胞冻存管中,转入冻存盒并置于-80 ℃冰箱过夜,次日转入液氮罐进行长期冻存。采集健康志愿者和哮喘患者空腹静脉血5 ml,置于含促凝剂的真空采血管中,3 000 r/min,离心10 min,分离血清,置于-80 ℃冰箱保存。
1.2.2 流式细胞术检测外周血cTFR细胞比例 复苏PBMCs,取1×106个PBMCs,重悬于50 µl 含2%FBS 的PBS 中,根据说明书加入荧光抗体(CD3-AF532、CD19-SB436、TCRγδ-BV480、CD4-BV750、CD8a-BV570、CD25-PE、CD127-APC-R700、CXCR5-APC、CD45RA-AF488),4 ℃避光孵育45 min。孵育完成后用PBS 洗涤2 次,细胞重悬于100 µl 含2%FBS 的PBS 中,加入1 µl 7-AAD,避光孵育5 min。38 通道光谱流式细胞仪Cytek NL-CLC-3000 上检测,使用FlowJo v10.6.2 软件进行流式数据分析。参考国内华中科技大学的刘争教授团队的圈门策略,将cTFR细胞定义为CD3+CD4+CD25highCD127lowCXCR5+CD45RAlow[20]。
1.2.3 流式细胞微球芯片捕获技术法检测血清细胞因子水平 根据细胞因子检测试剂盒说明书,检测血清5 种CD4+T 细胞相关炎症因子水平。具体步骤如下:在孔板中加入微球,抽滤去除孔中液体;在孔板中加入样品或标准品,避光震荡孵育60 min;抽滤孔板中液体,洗液洗涤3 次;在孔板中加入二抗,避光震荡孵育30 min;抽滤孔板中液体,洗液洗涤3 次;在孔板中加入藻红蛋白标记的链霉亲和素,避光震荡孵育20 min;抽滤孔板中液体,洗液洗涤3 次;每孔加入100 µl 读数液,混匀吸入流式管中,使用MECKMAN Navios流式细胞仪检测。
1.3 统计学处理 组间数据应用SPSS23.0进行统计学分析,采用t检验和非参数检验。指标间相关性采用Spearman 秩相关分析。数据以±s表示。使用GraphPad Prism 8软件和RStudio进行数据作图。
2 结果
2.1 过敏性哮喘患者外周血cTFR细胞比例变化使用Cytek 全光谱流式细胞仪,对过敏性哮喘患者和健康志愿者外周血cTFR细胞进行分析,圈门策略如图1A。结果显示,过敏性哮喘组中cTFR细胞显著低于健康对照组[(0.42±0.08)vs(0.91±0.12),P<0.01](图1B、C)。
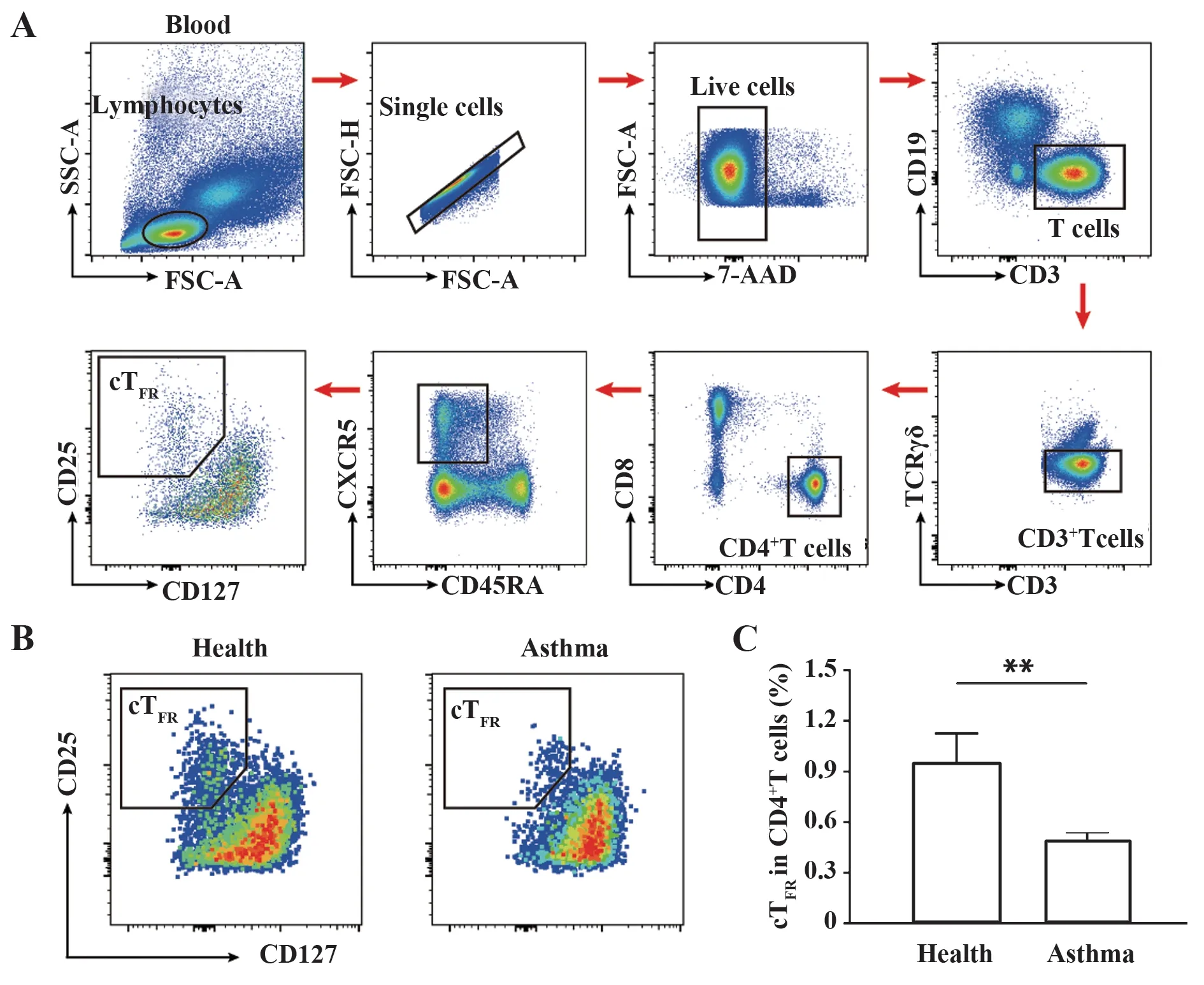
图1 健康对照组和过敏性哮喘组cTFR细胞比较Fig.1 Comparison of cTFR cells between healthy control group and allergic asthma group
2.2 过敏性哮喘患者血清细胞因子变化 使用流式细胞微球芯片捕获技术,对过敏性哮喘患者和健康志愿者CD4+T 细胞相关血清细胞因子进行分析(图2A)。结果显示,与健康对照组相比,过敏性哮喘组IL-10[(10.03±5.71)vs(23.00±9.95),P<0.001]和IFN-γ[(9.26±4.52)vs(15.88±2.39),P<0.05]显著降低,IL-4[(15.67±8.03)vs(6.28±3.41),P<0.001]、IL-5[(16.25±6.16)vs(6.87±3.28),P<0.01]和IL-13[(77.41±33.15)vs(31.64±15.53),P<0.01]显著升高(图2B)。
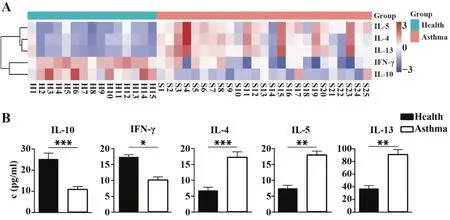
图2 过敏性哮喘患者血清细胞因子变化Fig.2 Changes of serum cytokines in patients with allergic asthma
2.3 过敏性哮喘患者外周血cTFR细胞和临床指标相关性 见图3,对25 例哮喘患者外周血cTFR细胞与临床指标血清总IgE、C-反应蛋白(CRP)水平、第1 秒用力呼气容积(FEV1)占预计值的百分比FEV1%和嗜酸性粒细胞EOS绝对数,以及细胞因子的相关性进行统计学分析。结果发现,cTFR与血清总IgE 呈负相关(r=-0.56,P<0.05),与FEV1%呈正相关(r=0.60,P<0.05),与血清CRP 以及EOS 无关。cTFR与IL-10 呈正相关(r=0.61,P<0.05),与IFN-γ、IL-4、IL-5和IL-13无相关性。
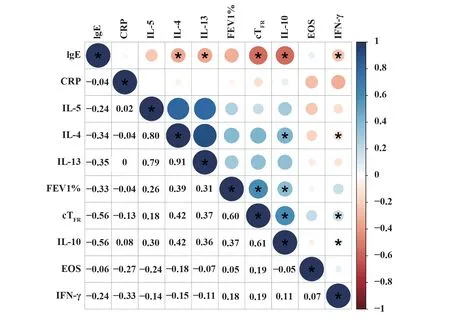
图3 cTFR细胞与过敏性哮喘临床指标相关性Fig.3 Correlation between cTFR cells and clinical indica⁃tors of allergic asthma
3 讨论
IgE 调控是过敏性哮喘研究领域热点问题,但以往研究多聚焦于IgE正向调控。TFR细胞是新发现的具有抑制功能的一类CD4+T 细胞亚群,其在抑制生发中心B细胞过度增殖、类别转换及高亲和力抗体产生中发挥重要负向调节作用[21]。CLEMENT 等[14]研究小组揭示TFR细胞的缺失增强了抗原特异性IgE抗体的产生并加剧了肺部炎症的实验,提示TFR细胞可能在IgE 生成中发挥重要负向调控作用。然而在花生过敏(灌胃方式)模型小鼠中,TFR细胞的缺失反而会导致花生特异性IgE 水平显著下降,提示在食物过敏中TFR细胞可能起正向促进作用[22]。由于TFR细胞位于生发中心,取材不易,更多团队将目光聚焦于cTFR。刘争教授团队报道[20]发现过敏性鼻炎患者的cTFR细胞显著降低,且cTFR细胞与IgE 积聚呈负相关。值得关注的是,过敏原特异免疫治疗(aller⁃gen specific immunotherapy,AIT)后伴随cTFR细胞水平的增高患者临床症状缓解[20]。然而迄今为止,cTFR细胞在过敏性哮喘中对IgE的作用仍然不明确。
本课题组发现过敏性哮喘患者外周血cTFR细胞的比例显著下降,且与血清总IgE 呈负相关,提示cTFR细胞可能参与负向调控IgE 生成。IL-10 是一种多细胞来源的抗炎细胞因子,通过激活巨噬细胞抑制炎症因子的分泌,也可抑制TH2 细胞功能,减轻气道炎症反应[23]。小鼠实验证明生发中心TFR细胞可以分泌IL-10 抑制B 细胞产生IgE[24-25]。课题组通过检测血清细胞因子水平,发现过敏性哮喘患者血清IL-10 水平显著下降,提示外周血cTFR细胞可能通过分泌IL-10 抑制IgE 的产生。TH1 和TH2 免疫失衡是哮喘公认的免疫学机制。TH1 和TH2 及其相关的细胞因子IFN-γ、IL-4、IL-5 和IL-13 等参与过敏性哮喘的病理过程[26]。TH1 通过分泌抗炎因子IFN-γ 抑制嗜酸性粒细胞浸润,缓解过敏性哮喘发展;TH2 通过分泌IL-4 和IL-5 促进B 细胞的增殖活化,诱导B 细胞合成IgE,分泌IL-13 破坏气道上皮屏障,诱发气道高反应性[27]。本课题发现和以往的报道一致,过敏性哮喘患者血清IFN-γ 水平降低,IL-4、IL-5 和IL-13水平显著提升[28-29]。
综上所述,本研究发现过敏性哮喘患者外周血cTFR细胞显著减少,cTFR细胞相关细胞因子IL-10 降低,并且cTFR细胞水平和IgE 呈负相关,与疾病病情呈正相关,结果提示cTFR细胞可能在哮喘IgE病理性增加中发挥重要作用。

