大蒜衍生的类外泌体样纳米颗粒通过上调肠道TGF-β1 改善小鼠溃疡性结肠炎的研究①
肖 定 纪桂宝 温松奇 邹雯佳 胡 勇
(武汉市第四医院,华中科技大学附属普爱医院普通外科,武汉 430030)
溃疡性结肠炎(ulcerative colitis,UC)是一种临床较为常见的慢性肠道疾病,同时也是一种由多因素引起的非特异性炎症性疾病,其病程迁延不愈,病情轻重不一。UC 主要发病于结肠黏膜或黏膜下层,常累及患者的直肠及乙状结肠。其临床表现主要为反复发作的腹痛、腹泻、黏液脓血便、恶心、纳差、里急后重、呕吐、发热及营养不良等,患者同时可伴有皮肤、黏膜、肝胆、眼及肠外的表现[1]。目前临床上对UC 的治疗主要采用药物治疗,即采用免疫抑制剂、生物制剂、糖皮质激素及氨基水杨酸类治疗,尽管药物的使用能够缓解患者症状,但其副作用仍然明显且无法避免复发[1]。中医药是我国传统医疗的宝贵财富,越来越多的研究表明中药在UC的治疗中发挥重要作用,特别是中药方剂联合西药的中西医结合治疗方法在临床上被广泛应用[2]。尽管如此,中医药在UC 治疗领域仍存在很多局限。因此寻找新的、绿色的中医药治疗方法成为中医临床治疗UC 面临的难点。为此,本研究拟探讨绿色无公害食物来源中药材大蒜衍生的类外泌体样纳米颗粒(garlic-derived exosome-like nanoparticles,GDELN)在葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎中对肠道炎症的保护作用及其作用机制。
1 材料与方法
1.1 材料 5~6 周龄SPF 级C57BL/6 雄性小鼠,采用国际标准方法清除肠道微生物,清除后收集小鼠粪便,采用常规细菌培养基培养检测并细菌。本研究经华中科技大学实验动物伦理委员会审批(2020-1102)。
1.2 方法
1.2.1 GDELN 的制备及鉴定 将产地为山东的新鲜大蒜参考文献[3]方法去皮后匀浆,采用梯度离心法(500 g 10 min,2 000 g 20 min,5 000 g 30 min,10 000 g 1 h,100 000 g 2 h)离心,100 000 g 之前每次的沉淀均丢弃,收集100 000 g 后的沉淀物,用预冷的PBS重悬沉淀,参考文献[4]中植物外泌体纯化方法,通过8%、30%、45%及60%的梯度蔗糖离心纯化,收集30%~45%的外泌体样颗粒。电镜检测:将收集的GDELN 溶于含3%戊二醛及1%多聚甲醛的0.1 mol/L 的二甲胂酸钠缓冲液,然后用含2%四氧化锇的0.1 mol/L 的二甲胂酸钠缓冲液固定1 h,2%醋酸铀作用30 min 后经30%、50%、70%、80%、90%、100%梯度乙醇分别脱水15 min。电镜下观察颗粒形态。颗粒直径分析:取纯化后的纳米颗粒溶于40µm滤膜过滤后的PBS,采用倍比稀释法分析颗粒浓度,取1∶1 000 稀释后的颗粒,采用NANOSIGHT 检测GDELN的直径及浓度。
1.2.2 GDELN进入小鼠肠道后的吸收分布检测Dir 染料标记的2.5 mg GDELN 悬浮在0.5 ml PBS中,通过灌胃方式给予小鼠。在第0、2、4、6 小时使用珍珠脉冲成像系统(LI-COR Biosciences)捕获活体图像。16 h 后,对小鼠实施安乐死,采集小鼠肝、肺、心、肾、胃、肠、肠系膜淋巴结(MLN)、脾和脑,采用Odyssey CLX成像仪扫描GDELN在器官内的分布。
1.2.3 结肠炎动物模型的建立及GDELN 处理小鼠 5~6周龄C57BL/6雄性小鼠随机分3组,8只/组,第1 天开始3 组小鼠分别给予PBS、PBS、GDELN[2.5 mg/(只·d)]灌胃,在预处理10 d后,3组小鼠分别给予PBS、2%DSS、2%DSS+GDELN。
1.2.4 GDELN 对DSS 诱导的结肠炎小鼠体质量、生存期及肠道炎症的影响 从小鼠给予DSS开始每天称量、记录并分析各组小鼠体质量,在处死小鼠前比较分析各组小鼠体质量差异;从实验开始记录每组每只小鼠生存的时间,直至其中1 组小鼠全部死亡,统计分析各小组的生存期;在第14 天时处死小鼠,取小鼠结肠组织,一部分用于固定后组织切片染色,HE 及Alcian blue 染色参照参考文献[5]的方法;一部分用于蛋白Array(The Common Cytokines RT²Profiler,ARY006)检测结肠组织中炎症细胞因子的表达(参照试剂盒说明书)。
1.2.5 炎症细胞因子及Smad信号通路的检测 按照ELISA检测方法提取组织蛋白,对蛋白Array筛选出的促炎细胞因子IL-8、TNF-α 和IL-6 及抑炎细胞因子TGF-β1、IL-10 和IL-4 进行一一验证,统计分析各细胞因子的表达差异。qPCR及Western blot 检测结肠组织中TGF-β1 受体的表达,Western blot 检测结肠组织Smad2和Smad3的磷酸化。
1.2.6 去除肠道微生物后GDELN 对小鼠DSS诱导结肠炎的影响 3 组小鼠饮水中分别加入氨苄青霉素钠(1 g/L)、硫酸新霉素(1 g/L)、盐酸万古霉素(500 mg/L)和甲硝唑(1 g/L)4 种抗生素组合连续喂养4 周,以完全清除小鼠肠道共生细菌。然后分别给3 组小鼠PBS、PBS、GDELN[2.5 mg/(只·d)]灌胃10 d(灌胃所用试剂及器材均为无菌),10 d 后分别给予PBS、2%DSS、2%DSS+GDELN(无菌),从给予DSS开始,每天称量体质量,在处死前比较分析各组小鼠体质量差异。记录每组每只小鼠的生存时间,直至其中一组小鼠全部死亡后统计分析各小组的生存期。第14 天处死小鼠,取小鼠结肠组织,部分用于固定后组织切片染色,部分用于ELISA 检测IL-8、TNF-α、IL-6、TGF-β1、IL-10 和IL-4 水平,qPCR及Western blot 检测TGF-β1 受体表达,Western blot检测Smad2和Smad3的磷酸化。
1.2.7 GDELN 进入肠道后肠道微生物代谢产物对结肠上皮细胞TGF-β1 表达的影响 收集实验小鼠的粪便及结肠内容物,以预冷的PBS溶解,然后梯度离心(500 g 10 min,2 000 g 20 min,5 000 g 30 min,10 000 g 1 h)去除沉淀,收集上清(无菌)。结肠上皮细胞株MC-38培养于含10%FBS的DMEM培养基,当细胞生长至85%时消化后接种至6孔板,1×105个/孔,24 h 后加入各组动物肠道内容物离心后的上清液,再次培养48 h,期间再次加入1 次代谢物上清。当细胞长满培养板时,分别收集细胞制备RNA 和蛋白。qPCR及Western blot检测TGF-β1表达。
1.3 统计学分析 本研究采用Graphad8.0 软件进行统计学分析。计量资料以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 GDELN 的制备、鉴定及其在体内的内化分布 通过梯度离心及蔗糖纯化后对GDELN 的直径进行测定,结果显示,GDELN 的直径为(156±48)nm(图1A、B)。电镜结果显示,GDELN呈现球形(图1C)。小鼠活体成像结果显示,GDELN 能够在小鼠体内被吸收,其中肝脏、消化道比例最高(图1D、E)。

图1 GDELN的制备、鉴定及其在体内的内化分布Fig.1 Preparation and identification of GDELN and its internalization distribution in vivo
2.2 GDELN 对DSS 诱导结肠炎小鼠体质量及生存期的影响 GDELN 处理小鼠能显著抑制DSS 导致的小鼠体质量下降,与未处理组相比差异有统计学意义(P<0.05,图2A);此外,给予GDELN 的小鼠生存期显著高于未给予GDELN 的小鼠(P<0.05),在DSS 组小鼠均死亡的情况下,GDELN 处理组仍未有小鼠发生死亡事件(图2B)。
2.3 GDELN 对DSS 诱导结肠炎小鼠肠道炎症的影响 GDELN 处理组小鼠结肠长度明显长于未处理组(P<0.05,图3A),经HE 及阿利新蓝染色后观察发现,GDELN 可显著抑制DSS 诱导的结肠炎,小鼠肠道组织结构完整性显著优于未处理组(图3B、C)。细胞因子蛋白Array 检测结果表明,GDELN 可抑制IL-8、TNF-α 及IL-6 的表达,同时上调TGF-β1 表达(P<0.05,图3D、E)。ELISA 结果表明,GDELN 处理组小鼠IL-8、TNF-α 及IL-6 均显著低于未处理组,而TGF-β1 显著高于未处理组(P<0.05,图3F)。Western blot结果则表明,GDELN处理组小鼠结肠组织中Smad2和Smad3磷酸化水平显著高于未处理组(P<0.05,图3G)。
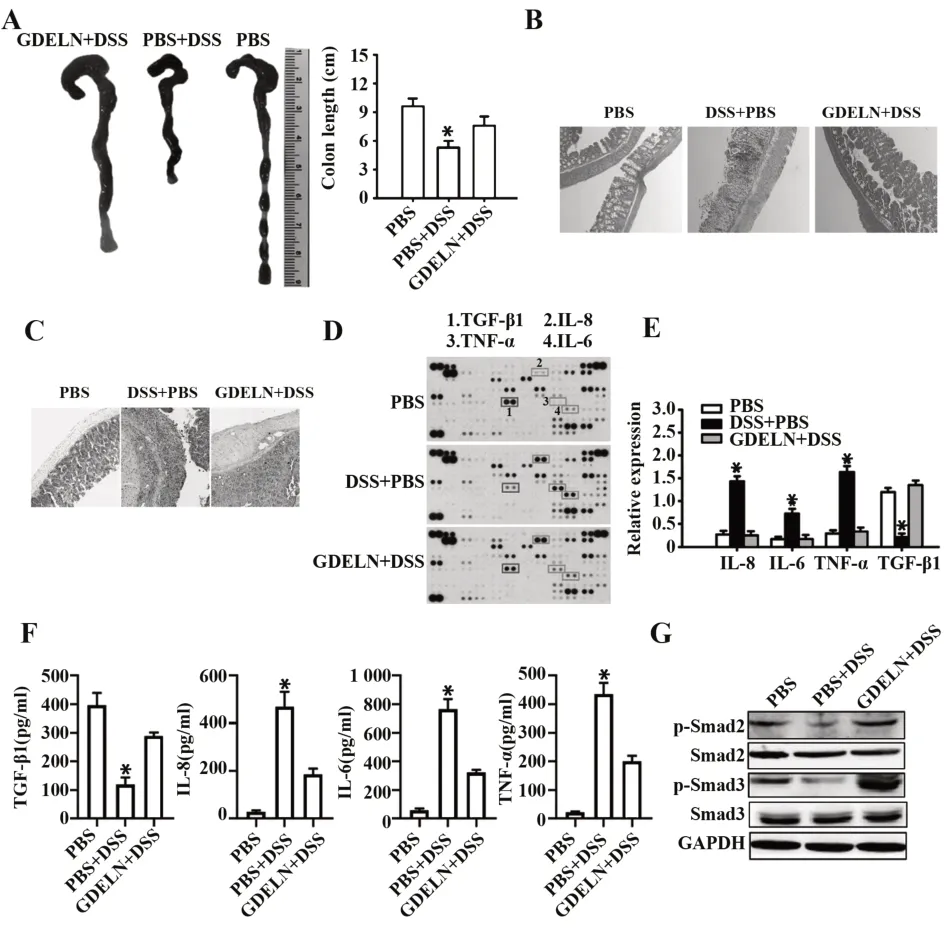
图3 GDELN对DSS诱导的结肠炎小鼠结肠炎症的影响Fig.3 Effect of GDELN on colonic inflammation in mice with DSS-induced colitis
2.4 肠道微生物对GDELN 缓解DSS诱导结肠炎的影响 清除小鼠肠道内菌群后,GDELN 抑制结小鼠体质量下降的作用被消除(P<0.05,图4A);小鼠生存期也未得到显著延长(P<0.05,图4B);结肠组织染色表明,清除肠道微生物后,GDELN 无法发挥抑制肠道炎症的作用(P<0.05,图4C);ELISA 结果显示,清除肠道微生物后,GDELN 无法上调结肠组织中TGF-β1 表达,也无法抑制IL-8、TNF-α 及IL-6 表达(图4D);Western blot 结果显示,清除肠道微生物后,GDELN 无法上调TGF-β1 的表达及Smad2 和Smad3 的磷酸化水平(P<0.05,图4E);体外细胞实验结果表明,GDELN 处理小鼠肠道微生物的代谢产物能显著上调结肠上皮细胞MC-38 中TGF-β1 的表达(图4F)。

图4 去除肠道微生物后GDELN 对小鼠DSS诱导结肠炎的影响Fig.4 Effect of GDELN on DSS-induced colitis in mice after removal of intestinal microorganisms
3 讨论
目前UC 的病因尚不明确,但其发病机制正在被逐步破解。在过去的十几年中,全基因组关联研究、基于微阵列的转录组学分析以及基于肠道微生物的16s 测序分析都为UC 的研究提供了新的研究方向[5-7]。由于对发病机制的逐步了解,新的治疗靶点也在被不断发现。消化系统每天都暴露在食源性的纳米颗粒中,其中包括可食用植物来源的纳米颗粒。在健康人的肠道中,免疫系统和微生物通过适当调节外来抗原(包括食物源性抗原负荷及其产生的免疫反应)从而维持肠道的恒定平衡[8]。一旦这种平衡被打破,就可能导致各种疾病发生。研究组在小鼠结肠炎模型中发现,食用来源的GDELN能够降低小鼠结肠炎症的严重程度,缓解小鼠体质量下降程度,且结肠缩短程度明显低于未给予GDELN组小鼠。提示GDELN 可能通过调控肠道免疫反应从而调节肠道平衡抑制结肠炎症。
研究表明,细胞因子在调节肠道免疫中发挥重要作用,而在肠道免疫中的细胞因子又分为促炎细胞因子和抑炎细胞因子[9-11]。促炎症细胞因子主要包括IL-8、TNF-α、IL-6 等,抑炎细胞因子主要包括TGF-β1、IL-10、IL-4 等。在UC 的发生过程中,促炎细胞因子和抑炎细胞因子的平衡失调,IL-8、TNF-α及IL-6 显著上调,TGF-β1 显著下调[12]。IL-8 能够促进PMN 进入炎症结肠组织,从而加重炎症反应[13]。TNF-α 能够上调血管内皮细胞黏附分子表达,同时诱导内皮细胞产生血小板活化因子和IL-8,这些因素共同导致PMN、淋巴细胞及单核巨噬细胞等与血管内皮细胞的黏附,进而迁移和外渗至结肠局部组织,引起肠道炎症反应[14-15]。此外,在IL-6 的参与下,TNF-α能够诱导凝血酶形成,从而使内皮细胞表面从抗凝血状态转变为促凝血状态,导致黏膜微循环出现障碍,从而降低肠道黏膜的屏障作用,促进细菌进入肠黏膜加重肠道炎症[16]。本研究结果表明,小鼠经GDELN 处理后可显著抑制DSS诱导结肠炎中促炎症细胞因子IL-8、TNF-α 及IL-6 的表达。进一步提示GDELN 可能通过调节肠道免疫反应从而缓解结肠的炎症。
TGF-β1是转化生长因子家族中的重要成员,是一种具有免疫抑制作用的细胞因子,目前的研究表明,体内几乎所有细胞均可表达并分泌TGF-β1,同时也都对该细胞因子产生反应。正常情况下,肠道黏膜中高度表达TGF-β1,而TGF-β1 作为抑制炎症的细胞因子,其功能非常强大,可抑制巨噬细胞的黏附和迁移,同时还能抑制T 细胞和B 细胞凋亡,抑制许多重要的炎症介质表达从而抑制肠道炎症[17]。在活动性结肠炎患者中,TGF-β1表达下调,而在UC患者中,TGF-β1 表达上调与病情缓解明显有关[18]。TGF-β1 与其受体的结合导致细胞内Smad2 和Smad3 的磷酸化,进而与Smad4 形成复合物转移到细胞核并抑制炎症基因的转录水平,其中就包括IL-8、TNF-α 及IL-6 等[19-22]。本研究以DSS 诱导结肠炎小鼠GDELN 后,结肠组织中TGF-β1 的表达显著上调,同时Smad2和Smad3的磷酸化水平显著上调。
肠道黏膜稳态是基于丰富多样的共生细菌生态系统的生理共存。越来越多的证据表明肠道菌群代谢物(包括细菌与膳食成分相互作用的副产物)均可影响肠道的免疫平衡。任何微生物的异常代谢物都能通过改变营养和支持网络的机制,降低肠黏膜的防御能力,影响肠道免疫系统,进而影响机体健康[23]。微生物群从宿主无法消化的食物成分中获取能量,这些食物成分被代谢生成物质,然后被宿主吸收,随后合成为必需营养素,如维生素B和K等,这个过程改变了整体能量的平衡[24]。因此,局部微生物群、肠上皮细胞和常驻免疫细胞间复杂的相互作用有助于胃肠道环境的稳定。在这个系统中,细菌代谢产物对上皮屏障和免疫细胞正常功能发挥重要的反馈信号作用。本研究去除小鼠肠道微生物,再给予DSS 诱导结肠炎小鼠GDELN 后,GDELN对肠道炎症的缓解作用被消除,其中TGF-β1表达显著下调,炎症因子IL-8、TNF-α 及IL-6 表达显著上调。提示GDELN进入小鼠肠道后,是通过肠道微生物发挥其对肠道免疫调控作用的。研究组在收集小鼠肠道微生物代谢产物进行体外实验后,发现肠道微生物代谢产物能够上调结肠上皮细胞TGF-β1的表达,进一步证实GDELN 进入肠道后,通过调控微生物代谢产物从而实现对结肠炎症的缓解。
综上所述,本研究证实了日常可食用中药材GDELN 能够显著缓解DSS 诱导的结肠炎,并通过小鼠动物模型及细胞体外实验证实GDELN 通过调控肠道微生物的代谢产物从而上调TGF-β1 表达,进而激活其下游的Smad2/Smad3 信号通路,实现对炎症细胞因子的调控,缓解结肠炎症。

