不同化学结构盐皮质激素受体拮抗剂在心血管疾病中的应用
林中樵, 陈佩佩, 王蕾
不同化学结构盐皮质激素受体拮抗剂在心血管疾病中的应用
林中樵1, 陈佩佩2, 王蕾1
(1. 山西医科大学第三医院(山西白求恩医院, 山西医学科学院), 综合医疗科, 太原 030032; 2. 中国科学院, 国家纳米科学中心, 纳米加工实验室, 北京 100190)
盐皮质激素受体的过表达或过度激活通常参与心血管疾病的发生发展. 通过拮抗盐皮质激素受体, 抑制其过度激活, 阻断盐皮质激素受体介导的生物学效应, 能够有效治疗相关疾病. 拮抗盐皮质激素受体化合物的化学结构决定了拮抗效应的强弱和临床上的针对性应用. 通过对盐皮质激素受体拮抗剂进行化学结构的优化, 改善其药理特性, 不仅增加了对盐皮质激素受体的选择性, 还降低了不良反应的发生率和严重程度, 同时在心血管疾病治疗方面也有不同侧重. 本文总结了不同化学结构的盐皮质激素受体拮抗剂螺内酯(Spironolactone)、 依普利酮(Eplerenone)和非奈利酮(Finerenone)的作用机制、 药理特性和心血管疾病临床应用的各自优势, 以期在后续临床应用以及新药研发方面提供新的思路.
盐皮质激素; 受体甾体类化合物; 非甾体类化合物; 心血管疾病
心血管疾病是危害人类生命健康最严重的疾病之一. 盐皮质激素受体在心血管系统中广泛分布, 生理状态下参与细胞的增殖分化, 病理状态下则加重组织器官功能损伤. 醛固酮(Aldosterone, Ald)是由肾上腺皮质球状带分泌的一种盐皮质激素, 也是盐皮质激素受体的内源性配体. 在经典的肾素-血管紧张素-醛固酮系统(RAAS)中, 醛固酮结合并激活盐皮质激素受体来维持体内水盐平衡[1]. 随着局部RAAS研究的深入, 盐皮质激素受体的作用不局限于调节水盐平衡. 心血管系统中盐皮质激素受体的过度激活或表达增加, 会加速心血管疾病如高血压、 心力衰竭和心室肥厚等的发展, 其对于心肌离子通道的再分布作用还可引起严重心律失常[2]. 盐皮质激素受体拮抗剂能够阻断盐皮质激素受体介导的生物学效应, 通过抑制盐皮质激素受体的过度激活来有效治疗相关疾病, 具有良好的临床应用前景.本文综合评述了盐皮质激素受体拮抗剂的不同化学结构、 作用机制和在心血管疾病中的临床应用, 以期在盐皮质激素受体拮抗剂后续临床应用以及新一代盐皮质激素受体拮抗剂研发方面有所贡献.
1 盐皮质激素受体及其不同化学结构的拮抗剂
盐皮质激素受体(Mineralocorticoid receptor, MR)是一种核受体, 属核受体超家族类固醇激素受体亚群. 1987年, Arriza等[3]首次将盐皮质激素受体克隆出来. 盐皮质激素受体表达于心、 血管、 肾、 大脑和脂肪组织等多个部位, 参与局部的物质代谢或病理损伤. 在肾小管上皮中, 过度激活盐皮质激素受体会促进钾离子外流和水钠潴留, 参与肾性高血压的发生发展[4]. 在心血管系统中, 过度激活盐皮质激素受体会促进胶原合成以及炎症因子释放, 参与血管重塑和心肌肥厚. 在脂肪组织中, 过度激活盐皮质激素受体会导致脂肪代谢障碍[5]. 在大脑中, 虽然盐皮质激素受体缺失影响海马神经元发育, 但是过度激活盐皮质激素受体可以改善压力应激下的情绪行为[6,7]. 因此, 盐皮质激素受体在诸多疾病的病理生理过程中扮演着重要角色. 临床上也已应用盐皮质激素受体拮抗剂抑制醛固酮对盐皮质激素受体的过度激活, 以治疗高血压、 心室肥厚和糖尿病肾病等疾病[8](图1).

Fig.1 Over⁃activation of MR lead to multiple organ damage[8]
Copyright 2021, Elsevier.
盐皮质激素受体拮抗剂(Mineralocorticoid receptor antagonist, MRA)是一类小分子化合物, 其化学结构在空间上与盐皮质激素受体形成互补, 因此能与醛固酮竞争性结合盐皮质激素受体. 但其本身不具备活性, 与盐皮质激素受体结合后可促进盐皮质激素受体降解或干扰激素-受体复合物核转位而发挥拮抗效应. 盐皮质激素受体拮抗剂的应用早于盐皮质激素受体的发现. 1953年, Simpson等[9]首次分离和纯化出醛固酮. 1959年, John等[10]基于醛固酮的分子结构研发出第一代甾体类盐皮质激素受体拮抗剂螺内酯(Spironolactone), 用于拮抗醛固酮的生物效应, 至今依旧在临床上使用. 此后, 科学家在螺内酯的基础上, 引入氧环优化侧链结构以增加选择性, 研发出第二代甾体类盐皮质激素受体拮抗剂依普利酮(Eplerenone). 第三代盐皮质激素受体拮抗剂以非奈利酮(Finerenone)为代表, 具有与螺内酯和依普利酮完全不同的化学结构, 被划归为非甾体类. 其全新的化学结构改变了以氢键互补的单一结合方式, 具有更高选择性和亲和力;在临床试验中展示出更低的不良反应的发生率和严重程度.
2 盐皮质激素受体的结构和作用机制
2.1 盐皮质激素受体结构
盐皮质激素受体的结构可分为3个部分: N端结构域、 DNA结合域和C端配体结合域. N端结构域(N-terminal domain, MR-NTD)位于氨基端, 大小和长度高度可变. MR-NTD包含配体非依赖性交互因子-1(AF-1), 起到与转录共调节因子相互作用以及与C端配体结合域(LBD)的分子内相互作用的功能, 从而调节MR的活性[11]. DNA结合域(DNA binding domain, MR-DBD)位于受体中部, 由66个氨基酸组成. 2个垂直的-螺旋和8个保守的半胱氨酸残基同2个锌原子形成的“锌指”结构组成球形构象, 可识别和结合特定DNA序列. MR-DBD还可结合激素反应元件(Hormone response element, HRE), 参与转录调控. C端配体结合域(Ligand binding domain, MR-LBD)位于羧基端, 结构上高度保守, 包含11个-螺旋(H1以及H3~H12)和2个短-片层, 组成类似三明治的三折叠构型[图2(A)][12]. H3, H5, H7, H11和H12螺旋的22个残基, H5和H6螺旋之间的链, 以及H11和H12螺旋环构成MR的配体结合域, 可结合特异性激素, 参与MR的核转位[13].
2.2 盐皮质激素受体作用机制
盐皮质激素受体最经典的作用是参与水盐调节, 其特异性作用需要11羟基类固醇脱氢酶(11-HSD2)参与. 在经典途径中, 11-HSD2可将皮质酮和皮质醇灭活, 使之不与醛固酮竞争MR活性位点. 醛固酮进入胞内后与MR-LBD结合, 通过Thr817残基使H5螺旋的C末端旋转约15.5°, 与原先的链形成夹角即重定位. MR-LBD空间构象使得盐皮质激素受体转变为激动态[图2(B)和(C)][14].醛固酮通过与MR-LBD的多个氨基酸残基相互作用发挥其活性, 其中醛固酮的21-羟基通过与MR-LBD H3螺旋的Asn770残基产生氢键, 稳定MR-LBD的活性构象[1,15]. 醛固酮-MR复合物核转位进入细胞核后, 盐皮质激素受体的DBD先与激素反应元件(HRE)结合形成二聚体, 其后通过Lys624, Val625和Arg629位点锚定DNA特定序列, 促进靶基因转录醛固酮诱导蛋白(AIP)mRNA并翻译[图2(D)][16]. AIP可增加细胞膜钠通道的开放频率和数量, 促进对钠的重吸收. 在心肌、 血管内皮和血管平滑肌等肾外组织, 醛固酮可以通过经典途径激活非上皮型MR产生非上皮作用[17]. DuPont等[18]发现, 血管MR的表达增加和活化可下调miRNA-155的表达, 参与血管老化. 在血管内皮中, MR活化通过增加细胞氧化应激水平, 促进炎性标志物细胞间黏附分子-1(ICAM-1)的表达, ICAM-1启动子也含有MR反应元件, 能在转录水平上增加ICAM-1表达[19]. Voelkl等[20]发现平滑肌细胞钠依赖性磷酸转运蛋白的转录受醛固酮-MR复合物的调节, 钠依赖性磷酸转运蛋白表达增加可促进平滑肌细胞表性改变, 参与血管钙化. Messaoudi等[21]通过基因组学激活心肌MR上调心肌细胞23个基因表达, 其中结缔组织生长因子 (CTGF)的表达增加(包括mRNA和蛋白质)被认为与心室重塑和心力衰竭有关. 因此, 盐皮质激素受体在血管重塑、 心肌肥厚、 促炎及纤维化方面的机制和不同的共调节因子的差异表达或锚定不同的DNA序列有关系.
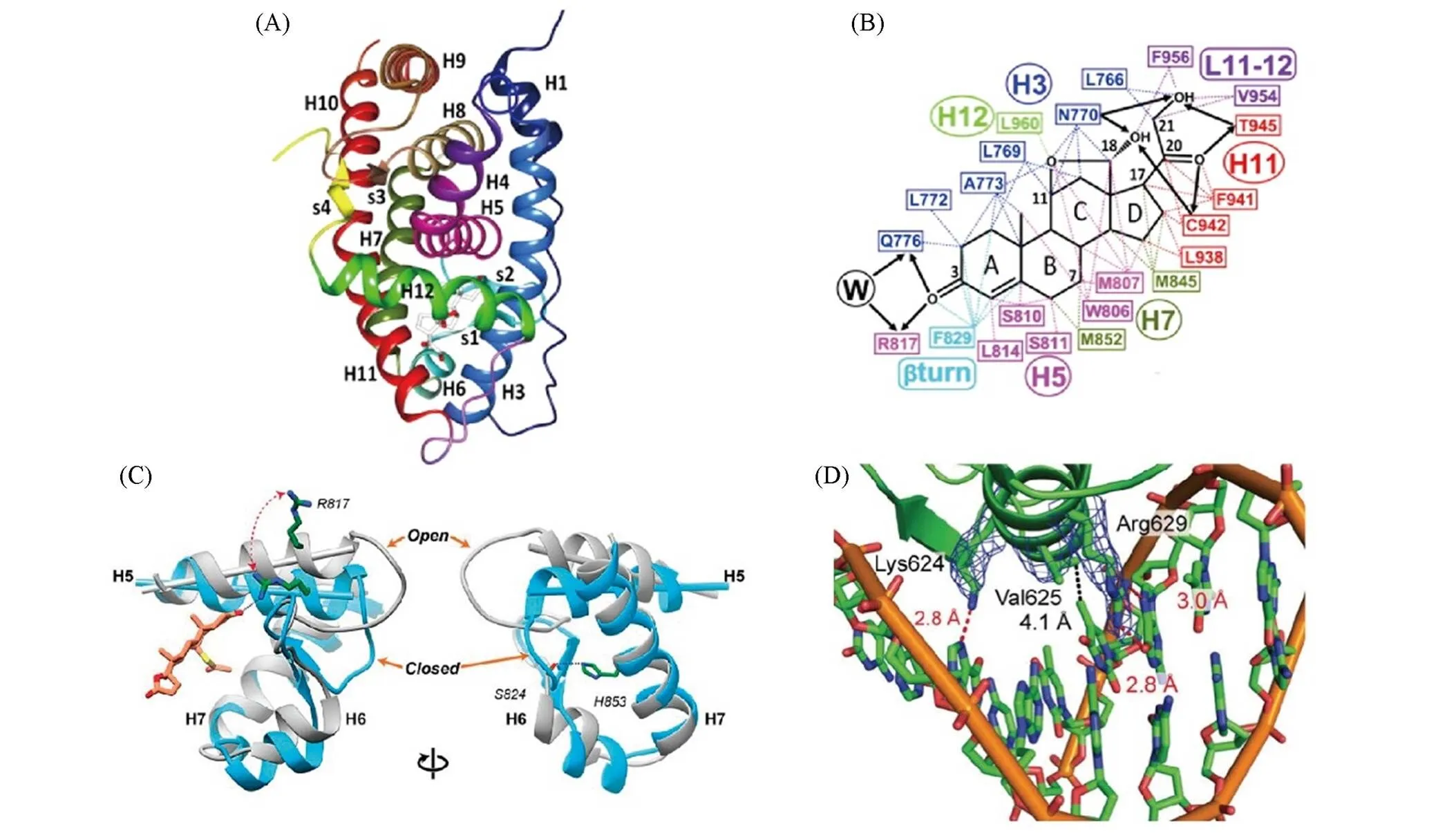
Fig.2 Spatial structures of MR⁃LBD and MR⁃DBD[13,15,21]
(A) Three-dimensional structure of MR-LBD[12]; (B) Amino acid residues of aldosterone[12], Copyright 2012, Elsevier; (C) Relocation of H5 helix of MR-LBD, then MR from antagonism state to agonist state[14], Copyright 2019, PNAS; (D) Schematic diagram of DBD recognition specific DNA sequence[16], Copyright 2014, Plos one.
3 盐皮质激素受体拮抗剂的化学结构和拮抗机制
3.1 盐皮质激素受体拮抗剂的化学结构
盐皮质激素受体的内源性配体是醛固酮(Aldosterone), 化学式为C21H28O5. 醛固酮具有甾体结构, 以环戊烷多氢菲为基本单位[22]. 盐皮质激素受体拮抗剂依据化学结构的特点, 可分为甾体类化合物和非甾体类化合物. 甾体类盐皮质激素受体拮抗剂为醛固酮的衍生物, 即母核结构相同, 在侧链上发生不同基团取代, 代表化合物为螺内酯(Spironolactone)和依普利酮(Eplerenone). 非甾体类盐皮质激素受体拮抗剂在二氢吡啶类化合物基础上改良而来, 代表化合物为非奈利酮(Finerenone).
甾体类化合物螺内酯(Spironolactone)是初代盐皮质激素受体拮抗剂, 化学式为C24H32O4S, 化学名称为17-羟基-3-氧代-7-(乙酰硫基)-17-孕甾-4-烯-21-羧酸--内酯. 与醛固酮相比, 螺内酯主要的改变是第二个甾环的第7号碳原子上偶联乙酰巯基, 具有较好的脂溶性[23]. 螺内酯与醛固酮一样对盐皮质激素受体具有亲和性, 但与受体结合后抑制其活性, 从而产生拮抗作用. 由于巯基形成氢键能力比羟基低, 因此螺内酯与盐皮质激素受体结合不稳定.
同为甾体类化合物的依普利酮(Eplerenone)是第二代盐皮质激素受体拮抗剂, 化学式为C24H30O6, 化学名称为9,11-乙氧基-17-羟基-3-氧-17-孕-4-烯-7,21-二羧酸--内甲酯. 与螺内酯相比, 依普利酮主要的改变是第二个甾环的第7号碳原子上偶联羧基, 同时第9号和第11号碳原子形成环氧环, 因此增加了对盐皮质激素受体的选择性. 由于羧基形成了稳定氢键, 依普利酮与盐皮质激素受体结合更为稳定, 但亲和力低于螺内酯.
甾体类盐皮质激素受体拮抗剂的高选择性和高亲和力不可兼得, 因此寻求新的非甾体类盐皮质激素受体拮抗剂受到重视. 二氢吡啶类(DHPs)药物是常用的钙通道阻滞剂[24]. 体外研究结果显示, DHPs具有拮抗盐皮质激素受体的作用, 因而备受关注[25,26]. 非甾体类化合物非奈利酮(Finerenone)在4-喹啉-二氢吡啶的基础上衍生而成, 化学式为C21H22N4O3, 化学名称为(4)-4-(4-氰基-2-甲氧基苯基)-5-乙氧基-2,8-二甲基-1,4-二氢-1,6-萘啶-3-甲酰胺. 非奈利酮对盐皮质激素受体的结合域不同于螺内酯, 对MR有极高选择性, 主要通过阻断转录辅调节因子募集, 拮抗盐皮质激素受体的效应[27]. 同时非奈利酮不具有钙通道阻滞效应, 体现了对盐皮质激素受体的专一性. 图3展示了醛固酮和不同盐皮质激素受体拮抗剂的化学结构.
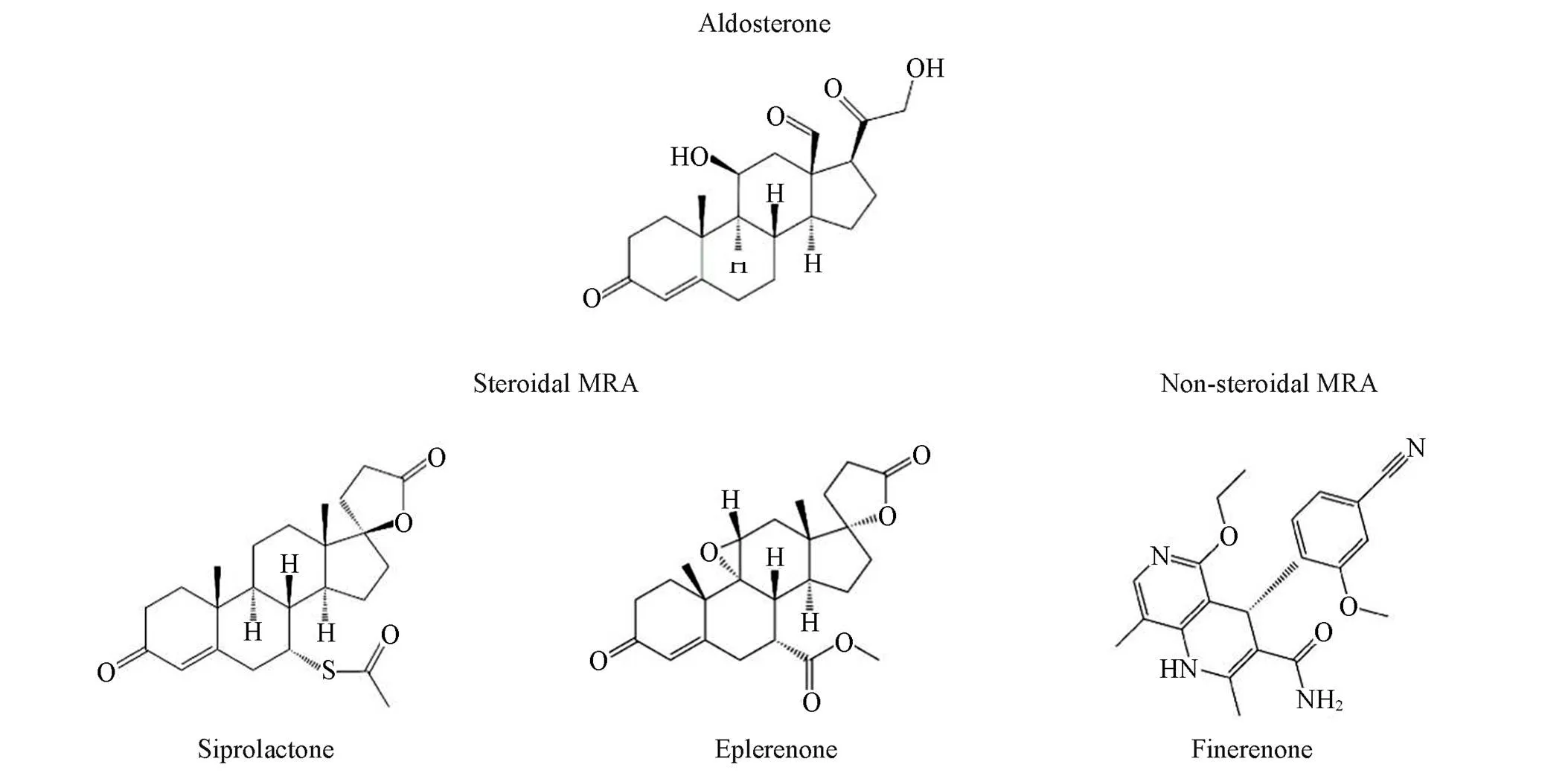
Fig.3 Chemical structures of aldosterone and MRAs
3.2 盐皮质激素受体拮抗剂的作用机制
醛固酮通过结合盐皮质激素受体配体结合域(MR-LBD)发挥作用. 目前认为, 盐皮质激素受体拮抗剂的拮抗效应在空间上主要是通过与醛固酮竞争性抑制MR-LBD, 干扰盐皮质激素受体活性构象;在功能上主要通过抑制共激活分子募集和激素-受体复合物核转位而产生的. 不同结构的盐皮质激素受体拮抗剂与盐皮质激素受体结合域的相互作用以及对盐皮质激素受体功能上的影响存在差异.
3.2.1与盐皮质激素受体结合域的不同作用机制甾体类盐皮质激素受体拮抗剂具有相似的针对 MR-LBD的拮抗机制. 螺内酯主要与MR-LBD的Ser810残基形成氢键[图4(A)], 依普利酮同时与 MR-LBD的Ser810残基和Arg817残基形成氢键, 但两者都无氨基酸残基的改变[28]. 非甾体类盐皮质 激素受体拮抗剂对MR-LBD的空间占据更为彻底[图4(B)], 因而针对盐皮质激素受体的选择性更高. Mizuki等[29]利用晶体衍射分析发现非甾体类盐皮质激素受体拮抗剂Esaxerenone除了与MR-LBD 的Arg817残基的氧原子和Ser810残基形成氢键外, 还发生了氨基酸残基重排列, 即与MR-LBD来自 多个残基的侧链, 如Gln776, Trp806, Leu814, Phe829和Met852, 被翻转并形成一个“口袋”包裹 Esaxerenone, 产生形状互补[图4(C)和(D)]. 这种重排列导致MR-LBD构象改变, 使得第12片段由正常激活位移至第3和第4片段周围, 影响调节因子与MR-NTD的结合. 同为非甾体类化合物, 非奈利酮主要与Asn770残基和Ser810残基形成特异性氢键结合, 与MR-LBD的氨基酸残基重排列与Esaxerenone类似[28]. 非甾体类盐皮质激素受体拮抗剂的独特作用机制带来了更高选择性和稳定的拮抗效应, 应用上更具有优势.

Fig.4 Schematic diagram of the binding sites between mineralocorticoid receptor antagonists and MR⁃LBD[29]
(A) Superimposition of MR-LBD/spironolactone (dark green); (B) Superimposition of MR-LBD /esaxerenone(orange);(C) Rearrangement of residues surrounding esaxerenone; (D) Residues from MR-LBD/esaxerenone(orange) and MR-LBD/eplerenone(light green) are shown in the stick model. In the picture, orange: esaxerenone, dark green: spironolactone, light green: eplerenone, Copyright 2020, John Wiley and Sons.
3.2.2对盐皮质激素受体功能上的不同影响盐皮质激素受体拮抗剂与MR-LBD发生空间上相互作用后, 在功能上主要通过抑制共激活分子募集和激素-受体复合物核转位, 从而拮抗盐皮质激素受体. 盐皮质激素受体调节靶基因转录需要转录共激活因子SRC-1和RNA聚合酶Ⅱ的参与, 其中MR与类固醇受体辅激活子1a(SRC-1a, SRC-1的剪接变体)的相互作用最强. 甾体类盐皮质激素受体拮抗剂螺内酯可使MR-LBD的H12片段不稳定, 影响RNA聚合酶Ⅱ的募集并延迟MR-DBD的核转位, 但不影响SRC-1的募集[30,31]. 同为甾体类的依普利酮则是使MR活性构象不稳定, 促进MR核转位. 但在依普利酮作用下, MR结合靶基因后形成惰性构象, 从而抑制转录过程[32,33]. 非甾体类盐皮质激素受体拮抗剂在功能上的拮抗效应较为全面. 非甾体类的代表化合物非奈利酮不仅抑制共调节因子的募集, 还抑制MR结合转录共激活因子SRC-1和RNA聚合酶Ⅱ, 且延迟MR-DBD与SCNN1A基因序列的结合调节靶基因转录[27]. 因此, 对于共调节因子的差异调节很可能与异常MR激活有关, 值得进一步研究.
4 不同化学结构的盐皮质激素受体拮抗剂的药理特性
螺内酯是人工合成的甾体化合物(IC50=24 nmol/L), 进入人体后80%由肝脏迅速代谢为有活性的坎利酮(Canrenone), 代谢产物经肾脏和胆道排泄[34]. 但因螺内酯可非特异结合孕激素受体和雄激素受体, 产生性激素样副作用;同时长期使用可引起血钾升高, 限制了部分患者的使用.
依普利酮同属甾体类化合物, 对盐皮质激素受体的选择性高, 但亲和力低, IC50=990 nmol/L.依普利酮在体内无活性形式, 口服剂量为10~100 mg之间的血药峰浓度和药时曲线下面积呈剂量依赖性, 表观分布容积()为42~90 L, 血浆清除率()约为10.0 L/h[35]. 依普利酮对孕激素受体和雄激素受体的选择性低, 但其升高血钾的副作用依旧存在.
非奈利酮属于非甾体类化合物, 对盐皮质激素受体的选择性和亲和力都较高, IC50=18 nmol/L, 表观分布容积(d)为124 L, 血浆清除率(CL)为44.0 L/h[36]. 非奈利酮平均分布于心脏和肾脏[37], 对血钾水平几乎没有影响, 极大避免了高钾血症带来的心血管副作用(如心律失常等), 具有良好的应用背景[36], 详见表1.

Table 1 Pharmacokinetic differences between three MR antagonistic compounds[38~40]
5 盐皮质激素受体拮抗剂在调节心血管重塑中的作用
心血管重塑包括细胞自身表型改变和细胞外基质纤维化, 是导致心血管疾病(高血压、 心肌梗死和心力衰竭等)发病和死亡的重要原因. 氧化应激和炎症反应是心血管重塑的主要病理过程. 不同的细胞实验和动物实验已证实过度激活盐皮质激素受体能够增加超氧化物和炎症因子表达介导炎症反应, 同时促进胶原合成, 参与心血管重塑[41,42]. 本课题组[43,44]也发现联合应用螺内酯能够下调老年高血压大鼠血管CTGF的表达, 减轻血管纤维化, 并增加心脏冠状动脉、 肾内动脉和基底动脉的舒张能力. 拮抗盐皮质激素受体能够减轻炎症反应和降低胶原合成, 减少心血管纤维化, 改善心血管重塑[8](图5).
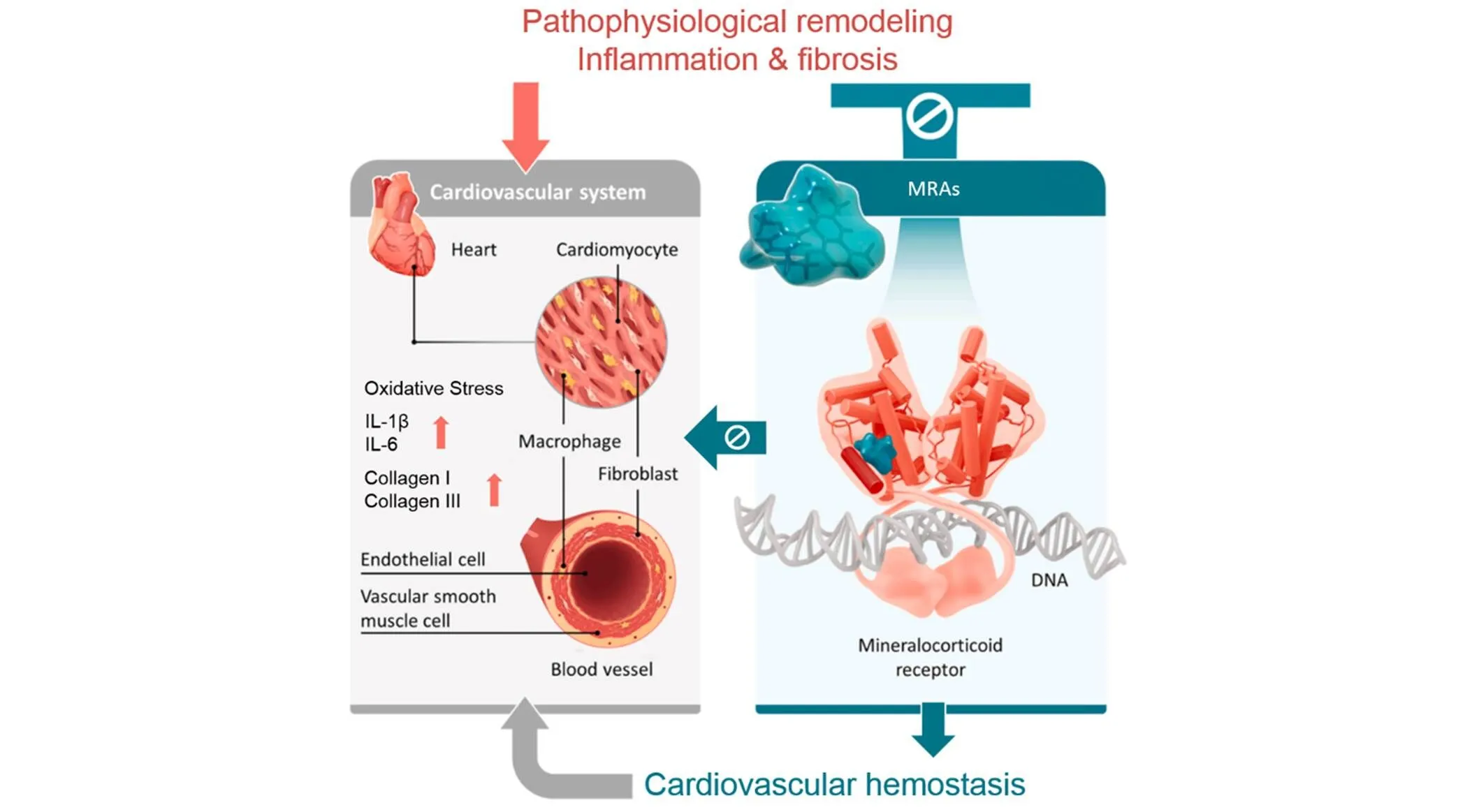
Fig.5 Anti⁃inflammatory and anti⁃fibrosis roles of MR antagonistic compounds[8]
Copyright 2021, Elsevier.
5.1 盐皮质激素受体拮抗剂在心血管炎症反应中的作用
氧化应激水平增加会促进炎症反应. Menon等[45]发现螺内酯可抑制肺动脉高压小鼠肺周围血管炎症反应, 减轻肺动脉肌化, 通过改善血管重塑治疗肺动脉高压. 在甲亢的高血压大鼠体内, 螺内酯降低了心脏脂质过氧化物水平, 增加了抗氧化剂谷胱甘肽水平, 通过降低氧化应激减轻炎症反应, 改善心室重塑[46].
炎症反应伴随着巨噬细胞的募集. 依普利酮可抑制醛固酮诱导的巨噬细胞募集和浸润, 降低炎症状态下心肌细胞炎症因子IL-6的表达, 减轻醛固酮小鼠的心室重塑[47]. 在急性心梗后大鼠体内, 依普利酮通过IL-33/sST2信号通路下调炎症因子IL-1的表达, 减轻心肌炎症反应[48]. 非奈利酮则是直接抑制MR共调节因子的募集, 切断下游信号通路, 进而减轻炎症反应[39].
5.2 盐皮质激素受体拮抗剂在胶原合成中的作用
胶原蛋白(Collagen)由成纤维细胞分泌, 于细胞外聚合形成胶原纤维, 血清Ⅰ型胶原和Ⅲ型胶原是常用的纤维化标志物. 螺内酯联合受体阻滞剂治疗能够显著改善无症状或者中度心衰患者的血管舒张功能, 同时降低心衰指标BNP和血清前胶原Ⅲ水平[49]. Hayashi等[50]发现螺内酯可降低首发前壁心梗患者血清醛固酮和血清前胶原Ⅲ表达水平, 提升左心室射血分数, 说明螺内酯可通过抑制心肌胶原合成改善心梗后心室重塑. 针对依普利酮用于急性心肌梗死后心力衰竭的疗效和生存研究(EPHESUS)的回顾分析显示, 依普利酮能够降低心肌梗死患者血清Ⅰ型胶原和Ⅲ型胶原水平[51,52]. 依普利酮通过抑制胶原的合成, 减缓心肌纤维化所致的心室重塑, 同时不受其利尿和早期保钾作用的影响[52,53]. 细胞实验结果表明, 非奈利酮能够降低细胞外基质蛋白Tenascin-X的表达, 抑制胶原的合成和沉积, 发挥抗纤维化作用[54].
6 不同盐皮质激素受体拮抗剂在心血管疾病中的应用优势
甾体类盐皮质激素受体拮抗剂螺内酯最初作为利尿剂用于缓解水肿和治疗原发性醛固酮增多症和原发性高血压. 针对射血分数保留型心衰患者, 螺内酯有着较好的治疗效果. Pitt等[55]报道的螺内酯随机对照研究(RALES)最早提出小剂量应用螺内酯能降低重度心衰患者(包括心衰引起的和突发心脏病)的死亡率, 并明显改善重度心衰患者的临床症状. 在射血分数保留型心衰合并顽固性高血压患者中, 加用螺内酯能显著降低收缩压和舒张压, 且长期预后与单纯射血分数保留型心衰患者相似[56]. 在应用螺内酯治疗射血分数保留型心衰的临床实验(TOPCAT)中, 对于合并肥胖、 糖尿病及左心室肥厚等靶器官损害的射血分数保留型心衰患者, 螺内酯能显著减少心血管事件、 心脏骤停及心衰住院等主要终点的发生率, 同时螺内酯通过改善心肌纤维化促进左室舒张功能[57]. 因此, 在心衰的基础治疗上加用螺内酯对于提升射血分数保留型心衰患者的预后效果存在益处.
同为甾体类化合物的依普利酮是第二代盐皮质激素受体拮抗剂. 与螺内酯相比, 其对盐皮质激素受体有更高的选择性, 虽然同时有血钾升高的副作用, 但其它不良反应少, 耐受性好, 能较好替代螺内酯. 依普利酮在心血管疾病方面的应用更侧重于对心梗后心衰的治疗. EPHESUS实验[58]显示, 在平均18个月的随访期中, 联用依普利酮组患者因心血管因素的死亡数以及死于心血管事件和因心衰住院等研究主要终点的发生率均低于对照组, 心血管猝死的发生率也明显降低. Montalescot等[59]的研究也证实, 对于无心力衰竭的急性ST段抬高型心肌梗死患者, 早期的基础治疗上加用依普利酮在平均13个月的随访中显著降低了心衰的发生率. 在使用依普利酮抗心肌纤维化治疗的急性ST断抬高型心肌梗死患者中, Ⅲ型前胶原氨基端前肽基线水平>3.6 mmol/L的患者服用依普利酮有更好的疗效[39]. 因此, 依普利酮在心梗后心室重塑及心衰方面有着良好应用前景.
非甾体类的非奈利酮更适用于伴有其它合并症的心衰患者. 针对心衰的盐皮质激素受体拮抗剂耐受研究(ARTS-HF)[60,61]显示, 对于合并糖尿病或者慢性肾脏病的射血分数减低型心衰老年患者, 服用不同剂量非奈利酮的受试者和服用依普利酮的受试者在90 d的观察期内, NT-proBNP的降低幅度相似, 但非奈利酮组各剂量组患者由于各种原因死亡、 因心血管再入院、 因慢性心衰恶化紧急就诊等次要终点的发生率均低于依普利酮治疗组;且在血钾方面, 非奈利酮组受试者的血钾变化幅度低于依普利酮组. 另一项针对非奈利酮改善慢性肾脏病和糖尿病肾病的研究(FIDELIO-DKD)[62]也表明, 在平均2.6年的中位随访期中, 无论受试者是否患有动脉粥样硬化性心血管疾病(CVD), 非奈利酮都显著降低了心血管事件(心肌梗死、 心衰和猝死等)的发生率, 同时高钾血症的发生率较低. 因此, 对于有多病共存的心脏病患者, 非甾体类盐皮质激素受体拮抗剂非奈利酮有着良好的治疗潜力.
7 展望
目前的临床研究肯定了盐皮质激素受体拮抗剂在治疗心血管疾病包括顽固性高血压、 心肌梗死、 心力衰竭等方面的益处. 非甾体类的非奈利酮作为新一代的盐皮质激素受体拮抗剂, 在继承前两代药物优点的同时, 降低了不良反应发生几率、 提升了耐受性, 特别是在伴有其它器官疾病的心血管病患者的治疗方面具有极大优势. 非甾体类盐皮质激素受体拮抗剂同时通过氢键作用和氨基酸残基重排列与盐皮质激素受体形成更牢固空间结构的特性, 成为新药的研发焦点. 这也给研究人员在下一代盐皮质激素受体拮抗剂的研发上带来了思考, 即通过设计药物的空间结构, 使之能尽可能占据受体的活性位点, 同时侧链能够与更多个氨基酸残基交联形成氢键或发生重排列增加稳定性;也可尝试从调控MR-DBD与激素反应元件(HRE)结合形成二聚体这方面着手, 直接抑制盐皮质激素受体锚定DNA特定序列, 阻断后续的基因转录. 双管齐下, 可更好地发挥拮抗效应.
除了传统的心血管疾病和肾脏疾病应用, 近年来盐皮质激素受体拮抗剂用于血管性痴呆等脑血管疾病和代谢方面的研究也有进展[63,64]. 本课题组近期研究发现, 利用依普利酮拮抗自发性高血压大鼠海马盐皮质激素受体, 能够促进自发性高血压大鼠突触蛋白的表达, 并改善高血压所致的认知功能障碍, 这有望成为新的拓展应用. 相信在不久的将来, 全新结构的拮抗化合物将被发现并应用于临床, 造福患者.同时, 随着对盐皮质激素受体研究的不断深入, 盐皮质激素受体将在更多的领域得到应用(图6).
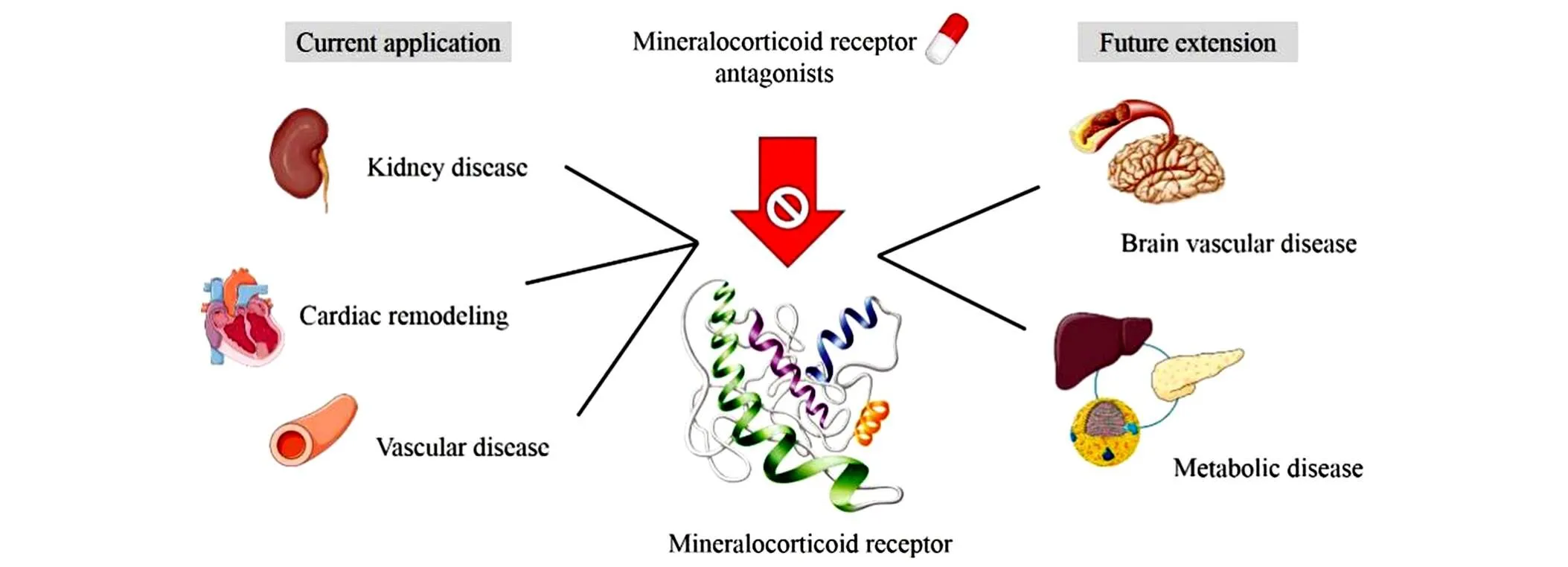
Fig.6 Application prospect of mineralocorticoid receptor antagonist
[1] Kolkhof P., Bärfacker L.,.., 2017, 234(1), T125—T140
[2] Ouvrard⁃Pascaud A., Sainte⁃Marie Y., Bénitah J. P., Perrier R., Soukaseum C., Cat A. N. D., Royer A., Le Quang K., Charpentier F., Demolombe S., Mechta⁃Grigoriou F., Beggah A. T., Maison⁃Blanche P., Oblin M. E., Delcayre C., Fishman G. I., Farman N., Escoubet B., Jaisser F.,, 2005,(23), 3025—3033
[3] Arriza J. L., Weinberger C., Cerelli G., Glaser T. M., Handelin B. L., Housman D. E., Evans R. M.,, 1987,(4812), 268—275
[4] Ayuzawa N., Fujita T.,...., 2021,(2), 279—289
[5] Cannavo A., Bencivenga L., Liccardo D., Elia A., Marzano F., Gambino G., D'amico M. L., Perna C., Ferrara N., Rengo G., Paolocci N.,...., 2018,, 1204598
[6] Gesmundo I., Villanova T., Gargantini E., Arvat E., Ghigo E., Granata R.,, 2016,, 66
[7] Otte C., Moritz S., Yassouridis A., Koop M., Madrischewski A., Wiedemann K., Kellnerr M.,, 2007,(1), 232—238
[8] Kolkhof P., Joseph A., Kintscher U.,.., 2021,, 105859
[9] Garthwaite S. M., Mcmahon E. G.,..., 2004,(1/2), 27—31
[10] Kagawa C. M., Sturtevant F. M., Van Arman C. G.,...., 1959,(2), 123—130
[11] Lavery D. N., McEwan I. J.,.., 2005,, 449—464
[12] Huyet J., Pinon G. M., Fay M. R., Rafestin⁃Oblin M. E., Fagart J.,.., 2012,(2), 187—195
[13] Pippal J. B., Fuller P. J.,..., 2008,(5/6), 405—413
[14] Fuller P. J., Yao Y. Z., Jin R. T., He S. T., Martín⁃Fernandez B., Young M. J., Smith B. J.,...., 2019,(37), 18578—18583
[15] Nordqvist A., O'mahony G., Fridén⁃Saxin M., Fredenwall M., Hogner A., Granberg K. L., Aagaard A., Bäckström S., Gunnarsson A., Kaminski T., Xue Y. F., Dellsén A., Hansson E., Hansson P., Ivarsson I., Karlsson U., Bamberg K., Hermansson M., Georgsson J., Lindmark B., Edman K.,, 2017,(1), 50—65
[16] Hudson W. H., Youn C., Ortlund E. A.,, 2014,(9), e107000
[17] Alzamora R., Michea L., Marusic E. T.,, 2000,(5), 1099—1104
[18] DuPont J. J., McCurley A., Davel A. P., McCarthy J., Bender S. B., Hong K., Yang Y., Yoo J. K., Aronovitz M., Baur W. E., Christou D. D., Hill M. A., Jaffe I. Z.,, 2016,(14), e88942
[19] Marzolla V., Armani A., Mammi C., Moss M. E., Pagliarini V., Pontecorvo L., Antelmi A., Fabbri A., Rosano G., Jaffe I. Z., Caprio M.,..., 2017,, 233—242
[20] Voelkl J., Alesutan I., Leibrock C. B., Quintanilla⁃Martinez L., Kuhn V., Feger M., Mia S., Ahmed M. S. E., Rosenblatt K. P., Kuro⁃o M., Lang F.,..., 2013,(2), 812—822
[21] Messaoudi S., Gravez B., Tarjus A., Pelloux V., Ouvrard⁃Pascaud A., Delcayre C., Samuel J., Launay J. M., Sierra⁃Ramos C., de la Rosa D. A., Clément K., Farman N., Jaisser F.,, 2013,(2), 361—367
[22] Liao X. J., Tang L.D., Liang Y. W., Geng H. W., Xu S. H.,.., 2011,(2), 217—220
[23] Jia L. H., Zhou L., Du W., Zhou L. N., Zhang M. J., Hou B. H., Bao Y., Wang Z., Yin Q. X.,..., 2018,(7), 836—845
[24] Jiang L., Ye W. T., Su W. K., Yu C. M.,.., 2019,(1), 21—25
[25] Kosaka H., Hirayama K., Yoda N., Sasaki K., Kitayama T., Kusaka H., Matsubara M.,..., 2010,(1—3), 49—55
[26] Martín⁃Martinez M., Pérez⁃Gordillo F. L., de la Rosa D. A., Rodríguez Y., Gerona⁃Navarro G., González⁃Muniz R., Zhou M.M.,..., 2017,(7), 2629—2650
[27] Amazit L., Le Billan F., Kolkhof P., Lamribet K., Viengchareun S., Fay M. R., Khan J. A., Hillisch A., Lombès M., Rafestin⁃Oblin M. E., Fagart J.,..., 2015,(36), 21876—21889
[28] Kolkhof P., Borden S. A.,..., 2012,(2), 310—317
[29] Takahashi M., Ubukata O., Homma T., Asoh Y., Honzumi M., Hayashi N., Saito K., Tsuruoka H., Aoki K., Hanzawa H.,, 2020,(10), 1615—1623
[30] Couette B., Lombes M., Baulieu E. E., Rafestin⁃Oblin M. E.,., 1992,(Pt 3), 697—702
[31] Le Billan F., Khan J. A., Lamribet K., Viengchareun S., Bouligand J., Fagart J., Lombès M.,., 2015,(9), 3977—3989
[32] Rogerson F. M., Yao Y. H., Smith B. J., Fuller P. J.,...., 2004,(10), 704—709
[33] Hultman M. L., Krasnoperova N. V., Li S. Z., Du S., Xia C. S., Dietz J. D., Lala D. S., Welsch D. J., Hu X.,.., 2005,(6), 1460—1473
[34] Vergin H., Mahr G., Metz R., Eichinger A., Nitsche V., Martens H.,....., 1997,(8), 334—340
[35] Cook C. S., Berry L. M., Bible R. H., Hribar J. D., Hajdu E., Liu N. W.,.., 2003,(11), 1448—1455
[36] Bärfacker L., Kuhl A., Hillisch A., Grosser R., Figueroa⁃Pérez S., Heckroth H., Nitsche A., Ergüden J. K., Gielen⁃Haertwig H., Schlemmer K. H., Mittendorf J., Paulsen H., Platzek J., Kolkhof P.,, 2012,(8), 1385—1403
[37] Heinig R., Gerisch M., Engelen A., Nagelschmitz J., Loewen S.,..., 2018,(6), 715—727
[38] Kolkhof P., Jaisser F., Kim S. Y., Filippatos G., Nowack C., Pitt B.,..., 2017,, 271—305
[39] Agarwal R., Kolkhof P., Bakris G., Bauersachs J., Haller H., Wada T., Zannad F.,.., 2021,(2), 152—161
[40] Yang J., Young M. J.,..., 2016,, 78—85
[41] Fraccarollo D., Berger S., Galuppo P., Kneitz S., Hein L., Schütz G., Frantz S., Ertl G., Bauersachs J.,, 2011,(4), 400—408
[42] Shen J. Z., Morgan J., Tesch G. H., Rickard A. J., Chrissobolis S., Drummond G. R., Fuller P. J., Young M. J.,, 2016,(8), 3213—3223
[43] Li S.,, Shanxi Medical University, Taiyuan, 2019(李晟. 醛固酮在老年高血压大鼠小血管纤维化中的作用研究, 太原:山西医科大学, 2019)
[44] Li S., Liu Y., Song Q. Y., Li L., Zhao X. F., Li H., Wang L.,......, 2020,(12), 1414—1419 (李晟, 刘宇, 宋奇颖, 李丽, 赵晓芳, 李晗, 王蕾. 第二军医大学学报, 2020,(12), 1414—1419)
[45] Menon D. P., Qi G. M., Kim S. K., Moss M. E., Penumatsa K. C., Warburton R. R., Toksoz D., Wilson J., Hill N. S., Jaffe I. Z., Preston I. R.,.., 2021,(3), 20458940211025240
[46] Mayyas F. A., Aljohmani A. I., Alzoubi K. H.,..., 2020,(3), 206—215
[47] Liao C. W., Chou C. H., Wu X. M., Chen Z. W., Chen Y. H., Chang Y. Y., Wu V. C., Rose⁃John S., Hung C. S., Lin Y. H., Wu C. H., Ho Y. L., Chang H. W., Lin L. Y., Hu F. C., Liu K. L., Wang S. M., Huang K. H., Chen Y. M., Kuo C. C., Chang C. C., Liao S. C., Yen R. F., Wu K. D.,...., 2020,(3), 165627
[48] Chen B., Geng J., Gao S. X., Yue W. W., Liu Q.,.., 2018,(3), 137—144
[49] Macdonald J. E., Kennedy N., Struthers A. D.,, 2004,(7), 765—770
[50] Hayashi M., Tsutamoto T., Wada A., Tsutsui T., Ishii C., Ohno K., Fujii M., Taniguchi A., Hamatani T., Nozato Y., Kataoka K., Morigami N., Ohnishi M., Kinoshita M., Horie M.,, 2003,(20), 2559—2565
[51] Iraqi W., Rossignol P., Angioi M., Fay R., Nuée J., Ketelslegers J. M., Vincent J., Pitt B., Zannad F.,, 2009,(18), 2471—2479
[52] Stienen S., Rossignol P., Barros A., Girerd N., Pitt B., Zannad F., Ferreira J. P.,..., 2020,(2), 194—204
[53] Rossignol P., Ménard J., Fay R., Gustafsson F., Pitt B., Zannad F.,...., 2011,(19), 1958—1966
[54] Grune J., Beyhoff N., Smeir E., Chudek R., Blumrich A., Ban Z., Brix S., Betz I. R., Schupp M., Foryst⁃Ludwig A., Klopfleisch R., Stawowy P., Houtman R., Kolkhof P., Kintscher U.,, 2018,(4), 599—608
[55] Pitt B., Zannad F., Remme W. J., Cody R., Castaigne A., Perez A., Palensky J., Wittes J.,...., 1999,(10), 709—717
[56] Rossignol P., Claggett B. L., Liu J. K., Vardeny O., Pitt B., Zannad F., Solomon S.,.., 2018,(4), 407—414
[57] Cohen J. B., Schrauben S. J., Zhao L., Basso M. D., Cvijic M. E., Li Z. Y., Yarde M., Wang Z. Q., Bhattacharya P. T., Chirinos D. A., Prenner S., Zamani P., Seiffert D. A., Car B. D., Gordon D. A., Margulies K., Cappola T., Chirinos J. A.,, 2020,(3), 172—184
[58] Rossello X., Ariti C., Pocock S. J., Ferreira J. P., Girerd N., Mcmurray J. J. V., Van Veldhuisen D. J., Pitt B., Zannad F.,..., 2019,(5), 477—486
[59] Montalescot G., Pitt B., de Sa E. L., Hamm C. W., Flather M., Verheugt F., Shi H., Turgonyi E., Orri M., Vincent J., Zannad F.,.., 2014,(34), 2295—2302
[60] Pitt B., Anker S. D., Böhm M., Gheorghiade M., Køber L., Krum H., Maggioni A. P., Ponikowski P., Voors A. A., Zannad F., Nowack C., Kim S. Y., Pieper A., Kimmeskamp⁃Kirschbaum N., Filippatos G.,.., 2015,(2), 224—232
[61] Filippatos G., Anker S. D., Böhm M., Gheorghiade M., Køber L., Krum H., Maggioni A. P., Ponikowski P., Voors A. A., Zannad F., Kim S. Y., Nowack C., Palombo G., Kolkhof P., Kimmeskamp⁃Kirschbaum N., Pieper A., Pitt B.,.., 2016,(27), 2105—2114
[62] Filippatos G., Anker S. D., Agarwal R., Pitt B., Ruilope L. M., Rossing P., Kolkhof P., Schloemer P., Tornus I., Joseph A., Bakris G. L.,, 2021,(6), 540—552
[63] Diaz⁃Otero J. M., Yen T. C., Fisher C., Bota D., Jackson W. F., Dorrance A. M.,......, 2018,(5), H1304—H1315
[64] Armani A., Cinti F., Marzolla V., Morgan J., Cranston G. A., Antelmi A., Carpinelli G., Canese R., Pagotto U., Quarta C., Malorni W., Matarrese P., Marconi M., Fabbri A., Rosano G., Cinti S., Young M. J., Caprio M.,, 2014,(8), 3745—3757
Application of Mineralocorticoid Receptor Antagonists with Different Chemical Structures in Cardiovascular Diseases
LINZhongqiao1, CHENPeipei2, WANGLei1*
(,,,,030032,;,,,100190,)
Over-activation or over-expressions of mineralocorticoid receptors lead to cardiovascular disease and di-sease progression. Antagonizing mineralocorticoid receptor, inhibiting its over activation and blocking the biological effects mediated by mineralocorticoid receptor, which is effective treatment of those diseases. The different chemical structures of mineralocorticoid receptor antagonists determine the strength of antagonistic effect and clinical targeted application. With the development of the times, optimization of the chemical structure of mineralocorticoid receptor antagonists improves the pharmacological properties, increases the selectivity and reduce the side effects. At the same time, there are different emphases in the treatment of cardiovascular diseases. This paper summarizes the action mechanisms, pharmacological characteristics and clinical application advantages of different kinds of mineralocorticoid receptor antagonists: spironolactone, eplerenone and finerenone, in order to provide new ideas in subsequent clinical application and future new drug research and development.
Mineralocorticoid receptor; Steroid compounds; Non-steroid compounds; Cardiovascular disease
O625.45
A
10.7503/cjcu20220059
2022-01-23
2022-03-04.
王 蕾, 女, 博士, 主任医师, 主要从事高血压靶器官损伤的基础与临床的研究. E-mail: wang_leicn2021@163.com
山西省重点研发计划项目(批准号:201803D31145)和山西省留学人员科技活动择优资助项目(批准号:20200031)资助.
Supported by the Key R&D Projects of Shanxi Province, China(No.201803D31145) and the Shanxi Province Preferential Funding Projects for Returned Overseas, China(No.20200331).
(Ed.: L, H, W, K)

