类固醇糖尿病诊治研究进展
张芳,唐海飞,郭丛丛综述 张珊珊审校
类固醇糖尿病(steroid-induced diabetes mellitus,SDM)是由于体内糖皮质激素(glucocorticoids,GCs)过多引起的一种糖代谢紊乱综合征,具体分为外源性大剂量应用GCs治疗和内源性库欣综合征两大类。外源性方面:超生理剂量的糖皮质激素因具有强大的抗炎、抗过敏、抗休克和抑制免疫作用而广泛应用于自身免疫性疾病、过敏性疾病、炎性疾病及血液系统恶性疾病等,但随之并发的感染、骨质疏松、消化性溃疡、SDM等不良反应也引起了人们的关注[1]。统计发现,全球范围内2%~3%的人群正在使用GCs,发生糖尿病的风险增加36%~131%[2]。内源性方面:人体皮质醇的分泌遵循昼夜节律,并参与组织修复、免疫稳定性和代谢过程。库欣综合征是由于下丘脑—垂体—肾上腺轴调控失常,体内GCs分泌过量所致。调查显示,内源性类固醇激素增多的患者中高达90%会出现葡萄糖耐量受损,30%~40%将伴发SDM[3]。目前,管理SDM挑战源于餐后血糖波动幅度大和缺乏明确的治疗方案。本文通过总结近10年国内外文献,分析外源性大剂量应用GCs所导致的SDM发病特点、机制及治疗进展,以期为临床治疗提供借鉴和参考。
1 SDM特点
1.1 SDM临床特点 典型SDM患者可有与2型糖尿病相类似的“三多一少”表现,但多数学者认为除此之外,SDM还具有一些自身的临床特点:(1)起病较快,发病隐匿,临床症状不明显,肾脏排糖阈值降低,血糖值和尿糖值不呈正比,尿糖多为阴性;(2)病情相对较轻,酮症酸中毒比例低;(3)餐后血糖升高为主,夜间血糖逐渐下降,空腹血糖(fasting plasma glucose,FPG)大多数正常甚至出现低血糖情况,但随着GCs持续使用和疾病的进展,FPG也会逐渐增高[4];(4)血糖升高具有可逆性,对于短期应用GCs治疗的轻症患者,停药后血糖将可逆性地恢复至使用GCs前水平,但对于需长期应用GCs治疗的危重患者,在停药后仍然有持续高血糖风险,这往往提示病情不可逆转[4];(5)对胰岛素(insulin,INS)治疗反应不一,部分患者有拮抗现象,需要较大剂量的胰岛素才能有效控制血糖。
1.2 SDM高危因素 研究发现,与SDM病情轻重程度有关的高危险因素包括:(1)基础因素(性别、年龄、肥胖、遗传):随着年龄的增长,胰岛功能进行性衰退,胰岛素抵抗(insulin resistance,IR)更加明显,在此基础上应用GCs很容易导致糖代谢紊乱的发生,甚至诱发糖尿病;有关性别对类固醇糖尿病发病率的影响,各学者观点不一,但一些资料则显示女性发病率较高[5-6];肥胖人群发生IR几率更高[7],在应用GCs治疗时,与同年龄同种族的非肥胖人群相比更容易出现糖耐量异常;遗传易感性使有糖尿病家族史的人更易产生糖耐量异常和胰岛功能衰退。(2)GCs的剂量、疗程和制剂种类[8-9]:一般认为,GCs剂量越大、疗程越长则发病几率越高;不同给药途径所导致的SDM发病率也不相同,局部应用或关节内注射的发病率通常较低,而口服或静脉给药途径对葡萄糖代谢影响较大。(3)原发疾病的种类:这一影响因素的作用比较微弱,血液病、肝脏疾病等患者运用糖皮质激素后容易发生糖尿病,特别是肝病患者,小剂量通常即可诱发糖尿病,这可能与肝病患者肝脏内糖代谢受损有关。相对而言,结节病、血管病和溃疡性结肠炎患者则不易发生SDM。
1.3 GCs分类及特点 根据半衰期的长短,GCs可分为短效、中效与长效3类[10],3类GCs的用途及其对糖代谢的影响各不同。短效GCs(氢化可的松、可的松)生物半衰期多在8~12 h,抗炎效力较低,不适用于自身免疫性疾病,主要用于肾上腺皮质功能不全的替代治疗。中效GCs(泼尼松、泼尼松龙、甲泼尼龙和曲安西龙)生物半衰期为12~36 h,活性持续时间较短,适合短期治疗无液体潴留或电解质异常的患者,临床应用广泛,多用于风湿病、自身免疫性疾病、免疫移植等的治疗[11]。长效GCs(地塞米松、倍他米松)生物半衰期为36~54 h,抗炎效力强,作用时间长,但对下丘脑—垂体—肾上腺轴的危害较严重,不适合长期应用,只可作为临时性药物。短效GCs口服后能够在短时间内与机体内的相关转运蛋白相结合而到达全身,并通过促进蛋白质分解、降低葡萄糖利用率和增加糖原含量来干扰体内糖代谢过程。贾文娟等[12]在比较不同剂量的氢化可的松对成人腺垂体功能减退症患者糖脂代谢的影响后发现,每天生理替代量20 mg氢化可的松是安全的,对人体血糖水平影响不大,但每天30 mg可能引起空腹血糖升高。内源性GCs的分泌有昼夜节律,午夜时含量最低,清晨时含量最高。为了模拟内源性GCs的分泌节律,中效GCs一般在上午8时左右顿服,对糖尿病患者的血糖影响表现为阶梯状上升,高血糖状态主要集中在午餐后至睡前时间段内。在所有GCs种类中,服用长效GCs对人体的升糖作用最明显、血糖波动幅度最大、高血糖时间比率最高[13]。
2 SDM发生机制
SDM发病机制复杂,但最终都伴随着INS在体内生成减少或作用发挥受阻。骨骼肌、肝脏和脂肪组织是机体消耗葡萄糖的主要场所,胰岛是分泌体内调控血糖相关激素的关键组织,而其对葡萄糖的摄取及处理能力又与人体组织细胞对INS的敏感性密切相关。四者均在SDM的发生中发挥作用,见图1。超生理剂量的GCs通过糖皮质激素核受体调节基因表达而调控葡萄糖的摄取和代谢,具体机制分为:抑制胰岛素受体(IRS)、葡萄糖转运子及INS信号通路传导,降低组织细胞对INS的敏感程度,诱导外周IR的发生;增加糖异生,提高内源性葡萄糖水平;促进胰岛α细胞、抑制胰岛β细胞,使体内糖调节激素分泌紊乱,最终导致SDM的发生。
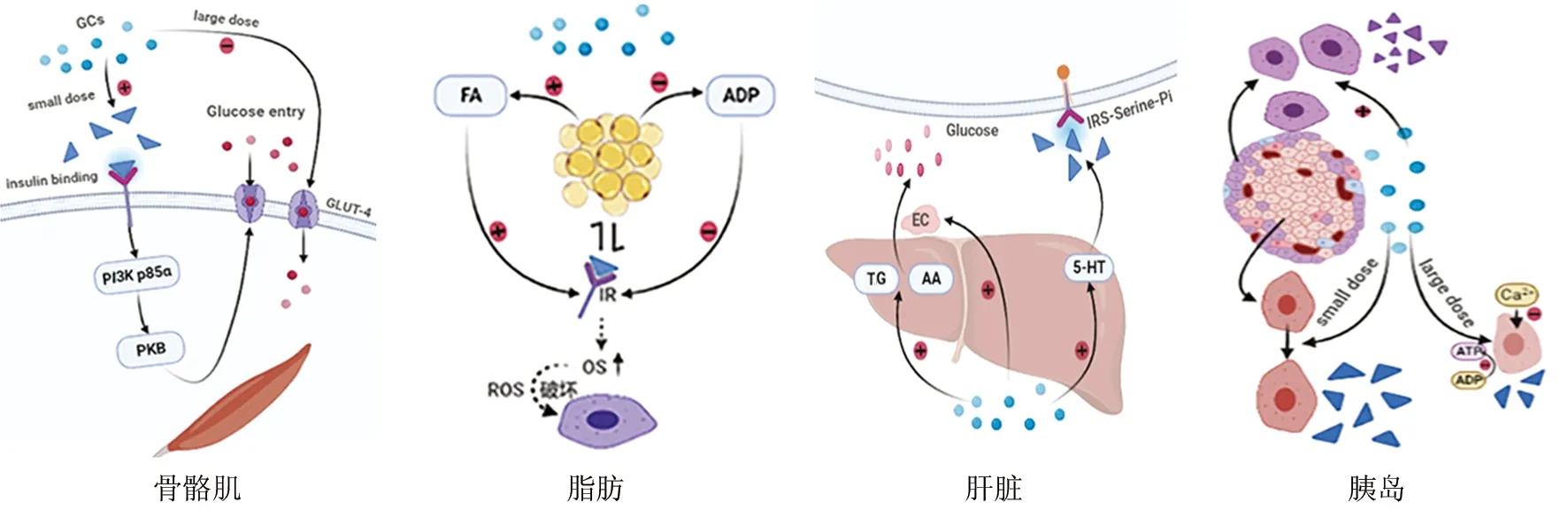
注:GCs.糖皮质激素;insulin binding.胰岛素结合;large dose.大剂量;small dose.小剂量;Glucose entry.葡萄糖进入;PI3K p85α.磷脂酰肌醇激酶蛋白基因;PKB.蛋白激酶B;GLUT4.葡萄糖转运蛋白4;FA.游离脂肪酸;ADP.脂联素;IR.胰岛素抵抗;OS.氧化应激;ROS.活性氧簇;AA.氨基酸;TG.三酰甘油;EC.烯醇化酶;5-HT.5-羟色胺;IRS-Serine-Pi.胰岛素受体底物丝氨酸磷酸化
2.1 骨骼肌 骨骼肌参与体内INS介导的80%以上葡萄糖的摄取利用。在骨骼肌细胞中,INS与胰岛素受体底物-1(IRS-1)结合后,激活下游细胞内磷脂酰肌醇激酶蛋白基因(PI3K p85α),随后蛋白激酶B(PKB)通过磷酸化激活,葡萄糖转运蛋白4(GLUT4)从细胞内囊泡到细胞膜的易位增强,进而促进了葡萄糖的摄取。研究发现,GCs对骨骼肌糖代谢的影响与应用剂量相关,大剂量的GCs可以直接抑制骨骼肌中GLUT4的表达,减少INS刺激葡萄糖摄取[14];并能促进蛋白质分解,使骨骼肌含量降低,进一步干扰葡萄糖的利用,诱导IR和SDM的发生。然而,另有研究证实,低剂量的GCs对成年小鼠空腹血糖几乎无影响,甚至表现为血糖降低。这可能与低剂量的GCs促进INS分泌、增加骨骼肌细胞糖处理能力有关[15]。这些研究提示,促进机体代偿性分泌的INS可一定程度上抵消部分GCs引起的骨骼肌胰岛素抵抗[16]。
2.2 脂肪 脂肪不仅是INS作用的靶组织,还是内分泌器官,可产生纤维生长因子、脂联素(ADP)和瘦素等一系列因子参与INS介导的糖代谢过程,其中脂肪分泌因子脂联素可缓解IR[17]。GCs的使用可以抑制脂联素的产生,并增加内脏脂质沉积及游离脂肪酸(FA)的含量,促使高活性反应分子产生,损伤胰岛β细胞的DNA和蛋白质;同时FA还可作为信号因子激活细胞内多种应激敏感信号通路,使机体糖代谢紊乱,导致IR和胰岛β细胞功能受损。当脂肪组织发生IR后,表现出膜IRS含量、酪氨酸激酶活性和胰岛素刺激的葡萄糖摄取降低;同时氧化应激(oxidative stress,OS)水平升高,抗氧化能力降低[18-19]。OS是SDM发病的基础与核心,能在活性氧簇(reactive oxygen species,ROS)的作用下导致细胞凋亡或坏死,破坏胰岛β细胞,使INS分泌量减少,进一步加重体内高糖代谢,形成恶性循环。
2.3 肝脏 在肝脏中,INS通过糖酵解、糖原合成和脂肪生成刺激葡萄糖利用和储存。同时通过抑制糖异生和糖原分解来减少肝葡萄糖的产生。GCs可降低组织细胞对INS的敏感性,并诱导5-羟色胺(5-HT)的合成增多,从而导致脂肪肝和IR。5-HT通过激活脂肪生成,使IRS抑制性丝氨酸磷酸化,INS的信号转导作用受阻,血糖代谢紊乱[20]。另外,GCs可促进糖异生底物如三酰甘油(TG)和氨基酸(AA)的释放,长期GCs暴露引起的脂肪分解和肌肉蛋白质降解也为糖异生提供了底物,同时烯醇化酶(糖酵解过程关键酶,EC)的表达增强,且血液循环中高水平的游离脂肪酸可促进肝糖原的输出,加速糖异生,抑制葡萄糖的利用,最终导致血糖升高[21-22]。
2.4 胰岛 GCs本身作为一种升糖激素,可调控体内高糖代谢,且与其他升糖激素如胰高血糖素、儿茶酚胺及生长激素具有协同作用。GCs通过调节胰岛α细胞中11β-羟类固醇脱氢酶(11β-HSD1)的局部再生,调控胰高血糖素的分泌,与INS的降糖作用产生拮抗作用[23]。Rafacho等[24]在研究大鼠胰岛α细胞功能与地塞米松干预下体内糖代谢的稳态时发现,GCs诱导的高胰高血糖素血症与α细胞中的分泌颗粒停靠比例增加有关,这种功能的改变有可能表现为α细胞质量的增加。
GCs对胰岛β细胞的损害主要分为降低胰岛β细胞功能和增加对胰岛β细胞毒性(主要以剂量依赖的方式损害胰岛β细胞)。具体机制包括:(1)早期β细胞通过增大体积、增加质量,代偿性产生更多的INS补偿GCs诱导的胰岛素抵抗[15],但长期超生理剂量水平的GCs刺激时,β细胞在高负荷状态下分泌的INS逐渐失代偿,最终出现高血糖。(2)胰十二指肠同源盒蛋白1(PDX-1)为胰岛素启动子因子,对胰岛β细胞特异性基因转录水平的调控起重要作用,从而促进胰岛素基因的转录和表达,调控INS的生成,而超生理剂量的GCs对PDX-1有明显的抑制作用[25],导致β细胞分泌功能退化,甚至结构损伤,产生去分化,功能性细胞数量减少,INS分泌不足,血糖水平升高。(3)GCs引起的血游离脂肪酸增多会破坏β细胞结构功能,导致细胞内分泌功能受损,INS生成减少。(4)GCs可以降低葡萄糖激酶(GK)与葡萄糖转运蛋白-2(SGLT-2)的水平,减少β细胞葡萄糖摄取,从而减少ATP合成和Ca2+流入,抑制胰岛β细胞的分泌功能,导致胰岛INS生物合成和释放减少[26]。
3 SDM药物治疗
饮食和运动仍旧是SDM降糖治疗的基石。在血糖控制仍不理想时,根据患者原发疾病特点、胰岛功能、肝肾功能水平,应用的GCs类型、剂量和给药频率,综合评估后选择合适的治疗药物。(1)因磺脲类、格列奈类、噻唑烷二酮类药物在发挥降糖作用的同时有低血糖、体液潴留及增加体质量、加重胰岛β细胞负担的不良反应,其降糖机制对于SDM的血糖特点不适用,故目前临床一般不作为常用药物[27]。(2)优先选择以餐后高血糖为靶点、起效迅速的药物,如二甲双胍、DPP-4抑制剂、SGLT-2抑制剂等。(3)SDM伴肝肾功能不全患者在选择降糖药物时,应考虑肝肾功能水平(表1),应用INS治疗时应根据需要减量使用,因肝肾功能的减退对INS灭活能力下降,INS在体内蓄积,容易导致低血糖的发生。(4)对于空腹血糖≥11.1 mmol/L的患者,INS通常是首选药物。(5)对短期应用GCs所导致的血糖升高者,应在停用6周后检测FPG或进行葡萄糖耐量(OGTT)试验,3个月后测定HbA1c进行判断;需长期应用GCs治疗的慢性病患者,应在开始用药之前评估危险因素,并进行多点血糖的检测,对高危患者或血糖异常升高者,应力求在病情控制的前提下采用最小有效剂量,同时配合使用降糖药物。

表1 肝肾功能水平对SDM患者常用降糖药物限制情况(以下为推荐使用)
3.1 二甲双胍 二甲双胍通过增加外周组织对于胰岛素敏感性和胰岛素介导葡萄糖利用、抑制肝糖异生和葡萄糖在肠道的吸收来抵消GCs的作用。从目前的研究来看,在口服降糖药中,二甲双胍的作用机制与GCs的作用最为接近,作为治疗2型糖尿病的一线首选和全程用药,其在安全疗效方面有着明显优势。Seelig等[28]在SDM成人患者的对照试验中发现,服用二甲双胍患者餐后2 h血糖明显低于安慰剂组,且在减少代谢并发症方面疗效确切(P<0.05)。二甲双胍的优势包括低成本、不增加体质量、不导致低血糖、降低心血管事件(UKPDS)等方面;同时二甲双胍是目前唯一一个既兼顾疗效,又兼顾费用及安全性的降糖药物[29],但在用于治疗SDM时,仍需关注其相对或绝对禁忌证,包括胃肠道刺激、缺氧和肝肾损伤等。
3.2 α-葡萄糖苷酶抑制剂 α-葡萄糖苷酶抑制剂通过抑制小肠绒毛中分解寡糖为单糖的葡萄糖苷酶活性而发挥降低和延缓餐后血糖的上升作用,在调节餐后血糖方面优于其他降糖药物;同时可减轻餐后高糖状态对胰腺的刺激,起到保护胰腺的作用。由于α-葡萄糖苷酶抑制剂主要控制饮食以碳水化合物为主的餐后血糖升高,因此,特别适合传统中国饮食结构的以餐后血糖升高为主要表现的糖尿病人群。关于α-葡萄糖苷酶抑制剂治疗SDM的临床及基础研究较少,但在降低2型糖尿病患者餐后血糖方面疗效确切[30-31]。阿卡波糖类药物不良反应有胃肠胀气,与含碳水化合物的食物一起服用时会产生严重的胃肠道反应[32],故服用该类药物时应注意调整饮食结构。在新诊断SDM患者中,以餐后血糖升高为主的患者比例可达90%以上,因此α-葡萄糖苷酶抑制剂是良好选择。
3.3 肠促胰素 肠促胰素类降糖药物目前分为胰高血糖素样肽-1(GLP-1)受体激动剂和二肽基肽酶-4(DPP-4)抑制剂2类。GLP-1受体激动剂通过葡萄糖依赖性的促进INS分泌,保护胰岛功能,延缓胃排空、抑制食欲,从而维持血糖稳定;DPP-4抑制剂能提升内源性GLP-1水平,抑制胰岛α细胞分泌胰高血糖素而控制血糖。Katsuyama等[33]通过给予口服西格列汀干预治疗SDM患者,前后比较其平均空腹血糖、糖化血红蛋白及平均体质量方面均较前明显改善(P<0.001)。同时,Kalra等[34]研究发现,艾塞那肽与西格列汀相比,前者在增加胰岛素分泌、减少餐后胰高血糖素分泌和降低餐后血糖方面均表现出更高的优势。Elseady等[35]在研究利拉鲁肽对地塞米松引起的胰腺细胞毒性和高血糖的保护作用中发现,利拉鲁肽可防止地塞米松和高血糖引起的胰腺损伤,抑制氧化还原和胰腺自噬反应,通过激活PI3K/Akt/Nrf2信号通路和动态自噬来减缓向SDM的病程进展。故临床对于口服降糖药物控制不佳、应用INS后出现体质量增加及频发低血糖等不良反应时肠促胰素可作为良好替代方案。这与GLP-1受体激动剂对受体的选择性可能绕过GCs对葡萄糖的处理,减轻对下丘脑—垂体—肾上腺轴活性的有害影响和全身炎性反应,改善葡萄糖耐量和胰岛素敏感性有关[36]。
3.4 钠—葡萄糖协同转运蛋白2(SGLT-2)抑制剂 SGLT-2主要分布在肾脏近曲小管S1段,是一种低亲和力、高转运能力的转运体,参与了肾小球滤过液中90%葡萄糖的重吸收(其余10%由SGLT-1完成)。SGLT-2抑制剂作为降糖药新靶点,高选择性作用于肾脏特异性部位后,每日可排出肾糖140 g,且除泌尿生殖系统感染的风险外,没有明显的其他不良反应。Klarskov等[37]研究发现,将GCs治疗后的新发糖尿病患者随机分为SGLT2抑制剂(恩格列净)组与中效胰岛素(NPH)组,通过比较患者平均每日血糖水平及血糖波动情况发现,SGLT-2抑制剂治疗并不逊色于NPH胰岛素治疗,且在远期预后、一定时间内血糖变异平均值、低血糖风险方面均表现出了良好疗效。
3.5 胰岛素 INS主要通过与靶器官细胞膜受体结合后发挥效应,是类固醇糖尿病治疗的首选药物[38]。对于住院患者GCs治疗期间高血糖的检测和管理建议,应开始使用门冬胰岛素或其他胰岛素方案治疗[39]。因NPH的起效时间和达峰时间与GCs血药浓度变化一致,因而相比于其他INS,较低剂量的NPH与GCs同时使用就可使患者的平均血糖和中位血糖值达到预期水平,而且发生低血糖的几率更低[40]。临床INS的选择应考虑GCs的持续时间,使INS的持续时间尽量覆盖GCs的效应时间,减少GCs失效后的低血糖风险。指南推荐[2],泼尼松用量为10 mg/d时,以体质量为基础的NPH初始值为0.1 U/kg,日增剂量10%~20%,至最高剂量为0.4 U/kg,如果高血糖持续至夜间,可考虑给予基础胰岛素。
4 小结与展望
GCs因其多种生物学作用被广泛用于临床多种疾病的短期或长期治疗,但也不可避免地引起一些不良反应,血糖异常便是其中常见的情况之一。长期高血糖的危害包括血管受损、动脉硬化和慢性糖尿病微血管病的发生风险增加,随着病情的进一步发展,出现血管通透性改变和闭塞性疾病或组织长期缺氧导致的心脏、肾脏、眼等众多脏器的损伤,并出现失明、伤口愈合缓慢、慢性皮肤溃疡或截肢等情况。SDM虽然不如1、2型糖尿病多见,但仍应引起各学科医师的关注。了解其发病规律、临床特性及治疗策略对于在临床上、安全合理运用激素类药物,避免或者有效控制高血糖具有重要意义。现在能用于SDM的治疗药物较多,其中二甲双胍、GLP-1受体激动剂、DPP-4抑制剂、SGLT-2抑制剂、胰岛素等降糖药物均在治疗SDM的临床研究中得到了肯定的疗效,而α-葡萄糖苷酶抑制剂等药物在SDM治疗中的研究较少,期待更多的临床数据证明其治疗SDM的安全性及有效性。随着相关基础和临床研究的深入,SDM的发病机制将逐渐明确,确切的机制将为未来SDM预防工作和靶向治疗提供参考,相信SDM的临床疗效和远期预后也将更上一个层次。

