治疗糖尿病的新技术:胰岛细胞移植
殷浩
什么是胰岛
胰腺位于胃的后方,是身兼内分泌调控血糖和外分泌帮助消化的重要器官。人类对胰岛(Islet)的认知始于近150年前:1869年德国病理学家保罗•朗格汉斯(Paul Langerhans)首次在显微镜下观察到了散布在胰腺中的不规则细胞团,犹如汪洋大海中的无数座小岛(图1),胰岛也因而得名朗格汉斯岛(Islets of Langerhans),彼时的他尚未认识到这些细胞团的作用。
图1 胰腺中散在的“胰岛”
之后科学家们逐渐发现,胰岛能分泌胰岛素与胰高血糖素等激素。根据染色和形态学特点,人类胰岛细胞主要分为α细胞、β细胞、δ细胞、ε细胞及PP细胞。其中,α细胞约占胰岛细胞的20%,可分泌胰高血糖素,升高血糖;β细胞占胰岛细胞的60%~70%,可分泌胰岛素,降低血糖。上述各类细胞组成了一个个大小不等的胰岛细胞团,直径多在50~500微米之间;总数约100~200万个,仅占胰腺总细胞数量的1%~2%。在进食、运动等各种环境下,上述细胞发挥协同作用,将人体的血糖控制在正常范围内。
胰岛移植与糖尿病
2017年的临床数据显示中国成人糖尿病患者数量已高达1.12亿, 而糖尿病前期的患病率超过了35% 。血糖长期控制不佳会引起心脑血管病变、失明、终末期肾病等严重并发症, 甚至威胁生命。以糖尿病导致的终末期肾病为例,2011年仅占上海长征医院终末期肾病的10%, 而2016年已快速上升到30%,愈发接近欧美发达国家的比例。由于血糖管控不利而造成的各种并发症中,糖尿病肾病已取代慢性肾小球肾炎,成为我国慢性肾脏病的首位病因。2015发布的《中国肾脏疾病年度科学报告》曾经发出警告:若不在特定人群范围内给予干预,未来10~20年,中国会迎来糖尿病肾病导致尿毒症的高峰。对于1型糖尿病患者以及胰岛功能受损严重的2型糖尿病(脆性糖尿病)患者而言, 采用胰岛素强化治疗方案或胰岛素泵治疗虽然可在一定程度上调控血糖, 但这些治疗方法的疗效极为有限, 无法有效阻止糖尿病并发症的发生发展。因此, 探索更加符合人体生理功能的治疗方法一直是糖尿病研究的前沿热点。
胰岛移植,是指将供体捐献的胰腺,在符合产品生产质量管理规范(GMP)的实验室中通过消化、分离、纯化等步骤,获得高纯度的胰岛细胞团,并移植给患者的手术。胰岛移植完全不同于创伤较大的实体器官移植(如肝移植、肾移植),仅需在局部麻醉下,借助超声及数字化处理血管造影(DSA)的影像引导,穿刺注射到患者体内。胰岛移植手术后的患者借助新的胰岛细胞,能够在体内重新分泌胰岛素和胰高血糖素,进而达到长期脱离胰岛素和稳定血糖的效果。胰岛移植可以用于治疗胰岛素绝对分泌不足的糖尿病患者(脆性1型、2型晚期胰岛功能显著衰退类型、3C胰源性糖尿病等)。

图2 胰岛分离-胰岛移植示意图
根据2012年国际胰岛移植注册中心(CITR)报道的数据显示, 1999年至2010年全球共为677例患者实施了胰岛移植术, 共计进行了2 000余次胰岛细胞分离。早期阶段(1999年至2002年)胰岛移植术后3年脱离胰岛素的患者比例为27.1%(58/214);中期阶段(2003年至2006年)提高至36.8%(94/255);近期阶段(2007年至2010年)更是高达到44.2%(92/208), 需接受二次移植的患者比例降低, 且糖化血红蛋白、C肽、糖耐量试验等糖尿病临床指标均明显改善, 低血糖及其他不良事件的发生率亦显著降低。这说明胰岛移植术经历了数十年的不断改良,已进入了全新的发展阶段, 经过临床实践证明是治疗糖尿病的有效方法。
国际胰岛移植的发展历程
1966年, 威 廉•凯 利(William Kelly)教授等实施了世界首例胰腺整体器官移植, 术后可有效控制糖尿病,但胰腺移植手术对机体损伤程度大、外科并发症多且费用高, 患者接受度低。1969年豪厄尔(Howell)等研究发现多数1型糖尿病患者的胰腺外分泌功能正常, 无须行胰腺整体器官移植, 提出用胰岛移植来代替胰腺整体器官移植的新理念, 这一观点很快得到学术界的认可。1974年, 萨瑟兰(Sutherland)等开展了世界首例人胰岛移植, 术后患者胰岛素的用量明显减少, 取得了一定的疗效。此后胰岛移植相关的临床和基础研究逐渐增多。1980年, 科尔布(Kolb)等首次报道1型糖尿病患者接受胰岛移植后, 完全脱离胰岛素。
胰岛移植技术的难点在于胰岛细胞的分离与纯化, 研究初期主要依靠单一的葡萄聚糖或聚蔗糖密度梯度的胰岛分离纯化技术。第一个里程碑出现在1989年, 里科尔迪(Ricordi)等发明的半自动胰岛分离系统, 克服了胰岛细胞分离和纯化中的关键技术难题, 推动了胰岛移植由实验研究进入大范围临床应用。同年, 莱克(Lake)等发明的COBE2991细胞分离机实现了一次性大容量的连续密度梯度离心, 操作简便,成为纯化人及动物胰岛细胞的良好工具。1990年, 沙普(Scharp)等率先为肾移植术后1型糖尿病患者进行联合胰岛移植来治疗糖尿病肾病, 这6例患者均在术后6个月随访期间内完全脱离外源性胰岛素, 且肾功能也得到很好的保护。由此提示, 对于糖尿病肾病患者, 肾移植联合胰岛移植的疗效优于胰岛细胞单独移植。
CITR的报道数据显示, 1990年至1995年胰岛移植迎来了第一个高峰, 这期间全世界共进行了180余例胰岛移植。但文献显示, 这部分患者在移植后一周内约53%有胰岛功能, 但移植术后一年,26%的患者有部分疗效, 仅有7%的患者可不使用外源性胰岛素。移植后胰岛细胞不能长期存活,导致临床疗效不佳,是其后一段时间一直未能大规模开展胰岛移植的主要原因。
直至2000年,夏皮罗(Shapiro)等制定了胰岛移植的一系列完整标准,包括供者选择、移植胰岛当量、术后免疫抑制剂方案等。标准建议采用多个胰腺分离得到大量的胰岛细胞进行移植, 并在术后采用无糖皮质激素和降低钙神经蛋白抑制剂剂量的新免疫抑制方案——埃德蒙顿方案(Edmonton protocol)——即西罗莫司、低剂量他克莫司和达克珠单抗, 临床效果明显改善, 在胰岛移植发展史上具有极为重要的意义, 引起全世界广泛关注, 至此胰岛移植迎来了第二个高峰。2004年由美国国立卫生研究院(NIH)主导创立的CITR, 是全世界最大规模跨国多中心的联合研究组织,全球约有50家临床胰岛移植中心参与, 目的是提高临床胰岛移植的安全性及长期疗效。2005年美国糖尿病学会(ADA)年会公布的国际多中心胰岛移植临床研究报道显示, 采用Edmonton方案进行的胰岛移植在术后3年内脱离胰岛素的患者比例高达53%。2014年世界移植大会资料表明, 国际上大部分中心的胰岛移植术后5年脱离胰岛素的患者比例已达到50%以上, 部分中心甚至超过60%, 与胰腺移植长期疗效相近。
我国胰岛移植的发展历史与现状

图3 国际胰岛移植发展历程
我国胰岛移植的临床应用发展一直紧跟国际步伐,但早期由于胰岛细胞分离纯化技术难度大、GMP实验室建设昂贵、团队培养周期长等诸多因素,发展道路颇为曲折。早在1982年,上海市第一人民医院胡远峰等即实施了中国首例人胚胎胰岛组织移植。此后国内多家医院也尝试开展。2000年,原南京军区福州总医院谭建明团队联合美国迈阿密大学成功完成了我国首例成人胰岛移植治疗1型糖尿病患者。2005年,南京医科大学附属无锡人民医院谢平等首先采用胶原酶灌注消化胰腺和聚蔗糖分离液建立连续密度梯度,使用分层纯化的方法获得了理想数量的胰岛细胞。2009年,谭建明等率先使用美国Ricordi人胰岛分离技术,开展胰岛移植联合肾移植治疗了22例糖尿病肾病患者,3年随访期间的胰岛功能和安全性评价显示了较好疗效。2011年,中国医科大学附属第一医院刘永锋等为3例2型糖尿病合并肾衰竭的患者共进行了4次胰岛移植,临床疗效良好。对于胰岛素依赖性2型糖尿病患者,若出现肾功能损伤表现,给予胰岛移植可获得显著的治疗价值。2016年,海军军医大学上海长征医院殷浩团队率先开展亚洲首例全胰腺切除及自体胰岛移植术,至今已完成200余例胰岛移植,随访超过1年的患者中,60%完全脱离胰岛素,糖化血红蛋白从(9s4)%降至(6s1)%,平均C肽增量为0.96nmol/L,短期临床疗效已达到欧美一流移植中心的水平。
胰岛移植面对的挑战及应对策略
胰岛移植治疗胰岛素依赖性糖尿病具有良好的疗效和较高的安全性,但目前仍存在诸多影响因素制约其发展。尤其在国内胰岛移植仍处于起步阶段,面临着许多问题和挑战,需要临床医师与科研人员共同协作创新来积极应对。
胰腺供者器官短缺器官短缺是困扰全世界移植领域的难题,也同样严重限制了胰岛移植的大范围开展。随着Edmonton临床方案推广加上胰岛细胞分离技术的不断改良,世界多个移植中心从最初需由3~4例供者胰腺移植给1例受者,到目前使用单个胰腺供者分离胰岛并成功移植。活体胰岛移植对胰岛细胞分离技术则提出更高的要求,世界首例活体胰岛移植是由日本京都大学报道的1例27岁1型糖尿病女性患者,接受了其母亲远端胰腺来源的胰岛移植,随访一年后供、受者均维持良好的血糖水平。相对于肝脏和肾脏等器官移植,胰腺供者匮乏的形势较为严峻。由于胰腺中存有大量的外分泌腺细胞,胰腺供者对于冷缺血的耐受度较差,通常冷缺血时间大于10小时的供者其胰腺就无法用于分离,且胰腺供者的糖化血红蛋白、C肽必须达正常水平。数据表明,美国每年约有8000余例器官捐献者,其中不到30%的胰腺可被用于移植。我国胰腺利用率则更低,根据笔者经验,受制于年龄、胰岛功能、冷缺血时间等因素,目前低于30%的供者胰腺能达到临床移植要求,而有条件及技术开展的胰岛移植中心仍较少。为了进一步提高胰腺器官的利用率,我们在稳步推进公民逝世后器官捐献、扩大供者来源的同时,加快国内各大移植中心胰岛分离实验室的筹建,建立胰腺和胰岛细胞冻存技术及资源库,加强对胰岛移植专业医师和实验技术人员的培训,显得尤为重要。

图4 国内胰岛移植发展历程
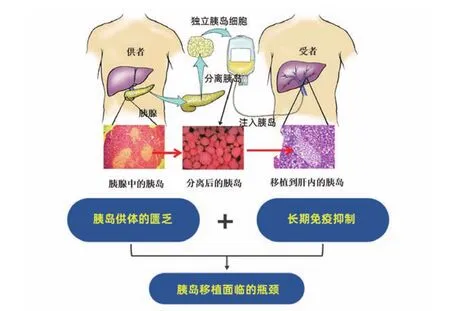
图5 胰岛移植面临的瓶颈问题
干细胞移植可能是解决器官短缺的另一条有效途径, 目前用于糖尿病治疗的干细胞主要包括间充质干细胞(MSC)和诱导性多能干细胞(iPSC)。MSC是具有较强多向分化和自我更新能力的成体干细胞, 可通过潜在的免疫调节与抗炎作用, 在外周组织中改善胰岛素抵抗,以及促进胰岛β细胞再生和保护β细胞。也有研究表明, 由于MSC可促进胰岛细胞的血管再生, 同时减轻胰岛细胞在移植早期受到的固有免疫损伤, 因此胰岛细胞与MSC联合移植可提高胰岛细胞的存活率。iPSC是一种具有无限增殖潜力的全能干细胞, 在一定条件下可分化为胰岛β细胞或胰岛素合成细胞。但胰岛在体内发挥生理功能需具备完整结构及细胞比例, 目前iPSC来源的胰岛细胞的临床应用还存在多项技术和伦理障碍有待克服。同时, 国内外的学者也在积极研究异种胰岛移植。1994年格罗思(Groth)等首次将猪来源的胰岛移植到人体, 进行异种移植临床试验。此后多个机构也相继开展了相关研究, 中南大学湘雅三医院王维等在国内率先实施了异种胰岛移植, 并取得了一定的效果。上述多项技术的研究和开展, 将有助于改善器官匮乏的问题。
胰腺获取、转运及胰岛消化分离纯化暂无标准流程胰岛分离纯化技术的不断改良使获取的胰岛细胞质量及数量大幅提高, 但国内仍无适合我国国情的统一标准流程, 尤其在供受者选择、胰腺获取、保存运输等多个关键环节上基本处于空白。各胰岛移植中心在操作细节上各有差异, 而胰岛细胞数量的损失可能发生于上述多个环节。我们可以借鉴美国胰腺供者评分系统以及CITR制定的有关临床胰岛移植物制备、评分及质控流程等标准, 加快制定国内统一的相关质控及操作标准。
胰岛细胞早期排斥丢失及药物不良反应胰岛移植术后早期排斥反应及免疫抑制剂的药物不良反应, 仍是导致远期临床疗效差的主要原因。胰岛移植早期,炎症反应、缺氧以及免疫排斥反应会导致胰岛细胞损失。炎症反应和缺氧可能导致约50%的胰岛细胞凋亡、死亡。胰岛移植术后常口服免疫抑制剂来控制免疫排斥反应, 然而免疫抑制剂本身也会引起诸多不良反应, 直接造成胰岛细胞凋亡。因此, 进一步优化免疫抑制方案,减少免疫系统对胰岛的攻击以及降低药物对胰岛的损伤, 有利于提高胰岛移植的疗效。
胰岛移植经肝门静脉穿刺的手术方式目前临床上90%的胰岛移植手术方式是经皮门静脉穿刺, 将胰岛细胞注入其内。其优势在于肝脏作为体内最大的免疫特惠器官, 是胰岛素的生理活性作用器官, 且血供丰富。因此与其他移植部位相比, 胰岛细胞能更好地在肝窦内存活。然而, 由门静脉注射胰岛细胞会出现较多并发症, 如血管栓塞、术后出血、门静脉高压症、门静脉周围脂肪变性,尤其是其引起的经血液介导的急性炎症反应, 会造成移植术后极早期移植物大量丢失。当前有多种方案可减轻经血液介导的急性炎症反应, 例如使用低分子肝素钠或肝素钠涂抹胰岛、凝血酶抑制剂、烟酰胺等, 但仍无法完全避免。经门静脉注射移植后, 胰岛细胞可能出现血管化不利和供氧不足等情况, 而胰岛β细胞对缺氧尤其敏感, 将导致胰岛细胞大量凋亡和相应的胰岛素分泌显著减少。总之, 肝脏并不是胰岛移植的最理想场所, 最佳的胰岛细胞移植部位仍需进一步探索。
结语
胰岛移植极大地推动了糖尿病细胞治疗技术的快速发展,尤其对脆性胰岛素依赖糖尿病、糖尿病合并终末期肾病具有重要的治疗价值, 使患者可不再依赖外源性胰岛素, 并且避免相关并发症的发展,保护肾脏等重要器官。随着胰腺供体获取、胰岛分离纯化、移植部位的选择以及免疫抑制方案等各方面的创新研究, 并制定一系列标准化流程, 必将推动这一技术的进步。
同时随着新技术的不断研发,通过“干细胞+基因编辑技术“制备的通用型再生胰岛有望彻底解决供体来源紧缺和免疫排斥的两大问题,成为胰岛素依赖糖尿病的最佳治疗手段,造福更多患者。

