生物降解Mg增强PLA复合膜用于引导骨再生的抗菌性能研究
王 萍,王先丽,吴 迪,白 晶,路萌萌,汤春波*
1南京医科大学附属口腔医院口腔种植科,江苏省口腔疾病研究重点实验室,江苏省口腔转化医学工程研究中心,江苏 南京 210029;2江苏省东南大学先进金属材料重点实验室,江苏 南京 211189
在口腔种植修复中,对于种植位点存在骨缺损者(尤其在上颌前牙区),可通过引导骨再生(guided bone regeneration,GBR)[1]后同期或延期种植的方法解决。但GBR 在颌骨及牙槽骨缺损较严重患者的应用中仍存在显著的局限性。GBR 以屏障膜为基础,抑制骨缺损区成纤维细胞的优先长入,为骨组织生长创造足够空间。目前用于GBR 的屏障膜分为生物可降解和不可降解两大类[2]。生物可降解屏障膜包括动物源性成分(如胶原膜)和脂肪族聚酯[如聚乳酸(polylactic acid,PLA)],而不可降解的屏障膜通常包括聚四氟乙烯(polytetrafluoroethylene,PTFE)膜和钛膜[3-4]。一般认为,用于临床的GBR膜应具有良好的生物相容性和适当的可降解性,以避免二次手术取出。除此之外,GBR 术后骨再生失败与手术部位的污染和感染密切相关[5-6]。细菌在创面或植入物表面定植引起的感染和生物膜的形成,对局部骨再生和种植的成功都是致命的打击。临床现有的大多数产品不能抑制细菌定植,更不能预防组织感染,可能导致种植失败。虽然胶原膜在GBR 中具有优异的性能,并被广泛应用,但其强度差,不能保持良好的成骨空间,也没有抗菌作用[3]。
PLA 是一种生物可降解的高分子生物材料,具有良好的生物相容性,经美国食品和药品管理局(FDA)批准作为一种生物医用材料,已用于伤口敷料、医用可吸收缝线、可吸收钢板、可吸收螺钉和食品包装等[7-11]。与天然的生物聚合物(胶原蛋白、透明质酸等)相比,PLA没有潜在的抗原性和免疫原性[12]。但是,PLA 的低冲击韧性使其不适于在高机械强度环境下使用[13]。总之,PLA存在硬度差、降解率低、疏水性高、缺乏抗菌性能等局限性,限制了其作为生物医学材料的应用[14]。因此,开发具有抗菌性能、避免植入后严重感染甚至导致植入失败的PLA 基复合生物材料,是提高PLA 性能的一个研究方向。
镁(magnesium,Mg)是一种生物可降解金属,是人体必需元素之一。镁离子(Mg2+)在蛋白质合成、肌肉功能、神经和免疫调节等生化水平的代谢中也是必不可少的,而且多余的Mg2+可以从尿液中排出[15]。研究表明,Mg及其氧化物具有广泛的抗菌谱和生物降解能力[16-17]。它还能促进成骨细胞分化和增殖,刺激内皮细胞招募和炎症反应平衡[18]。近年来,Mg 及其合金作为植入物被广泛研究,其中一些已成功应用于生物医学领域[17,19]。Mg 增强PLA复合材料可能成为潜在的医用生物可吸收材料,改善聚合物低力学性能,同时降低了Mg 基材料快速降解释放H2带来的有害影响[20-22]。在耐药菌不断进化的时代,采取这种非抗生素应对微生物定植的替代策略势在必行。
我们假设,在良好的生物相容性的前提下,Mg 含量较高的PLA 在增强机械性能的同时可以达到植入后的局部抗菌作用。这些作用可以极大地促进GBR 膜的屏障功能,保持良好的生物稳定性。本研究旨在制备一种具有抗菌性能的GBR复合膜,该复合膜结合了聚乳酸的低降解速率和Mg 持续降解所赋予的抗菌活性的优势,将不同比例的Mg 颗粒负载于PLA 基质中,通过对材料表面革兰阳性金黄色葡萄球菌(S.aureus)和革兰阴性大肠杆菌(E.coli)的生长情况来评价不同含量Mg 颗粒增强PLA复合膜的抗菌效果。
1 材料和方法
1.1 材料
实验中使用的小鼠上皮样成纤维细胞系(L929)和小鼠胚胎成骨前体细胞系(MC3T3-E1)以及金黄色葡萄球菌S.aureus(ATCC 25923)和大肠杆菌E.coli(ATCC 25922)来自南京医科大学江苏省口腔疾病研究重点实验室样本库。磷酸盐缓冲液、α-MEM 培养基、DMEM 培养基、胎牛血清、青霉素和硫酸链霉素(Gibco公司,美国);CCK-8检测试剂盒(同仁公司,日本);2.5%戊二醛(上海碧云天);二氯甲烷、无水乙醇(南京国药集团);LB培养基(北京Solarbio);扫描电子显微镜(LEO 1530VP,德国);电子万能试验机(Zwick Roell Z1.0,德国);pH 计(PHSJ-4A,上海雷磁);酶标仪(Bio-tek公司,美国);超声波清洗机(深圳洁盟)。
1.2 方法
1.2.1 样品的制备
为制备Mg/PLA 复合膜,将数均分子量≈40,黏度=2.66 dL/g 的PLA 颗粒溶于二氯甲烷后,将溶液与10%wt、20%wt 和40%wt 的球形Mg 颗粒(平均粒径≈27 μm)充分混合。将该悬浮液在室温下倒入直径为150 mm 的玻璃器皿中,直至二氯甲烷完全挥发。最后,将0.3 mm厚的圆盘状复合膜在50 ℃下干燥24 h。在接下来的实验中,将从PLA 膜和3 种复合膜上切割的不同形状样品用环氧乙烷灭菌,切割尺寸为50 mm× 10 mm 的工字形试样进行拉伸试验。切取直径15 mm 的圆盘样品,用于评价其抗菌性能。
1.2.2 样品表面形貌观察
用扫描电子显微镜(scanning electron microscope,SEM)对喷金后不同样品的表面形貌进行观察分析。
1.2.3 样品的力学性能
为了研究不同试样的基本力学性能,采用电子万能试验机在室温下以2 mm/min的速度和0.1 N的预负荷进行拉伸试验,同时记录应力-应变曲线。强度和应变值是3次测量的平均值。复合膜抗拉强度的计算公式:δ=Fmax/A;Fmax为最大荷载值(N),A为试验试件的横截面积(mm2)。计算拉伸应变的公式:ε(%)=ΔL0/L0×100%;L0为试件的标尺长度(mm),ΔL0为L0的增量(mm)。
1.2.4 浸没实验
将样品在磷酸盐缓冲液(phosphate buffered saline,PBS)中以1∶10的表面积/体积比浸泡24 h,用pH计记录每个时间点的pH值。
1.2.5 细胞培养与培养基制备
小鼠上皮样成纤维细胞(L929)和小鼠胚胎成骨前体细胞(MC3T3-E1)在含有下述培养基的细胞培养皿中培养。细胞在37 ℃、95%相对湿度,5%CO2浓度的培养箱中培养。
为了研究Mg/PLA 复合膜的生物相容性,制备了以下培养基。完全培养基:α-MEM和DMEM分别添加10%胎牛血清(fetal bovine serum,FBS)、1%青霉素(100 U/mL)和硫酸链霉素(100 mg/mL)制备α-MEM 完全培养基和DMEM 完全培养基。条件培养基:按照ISO-10993 标准,用两种完全培养基、浸提标准为1.25 cm2/mL,获取样品24 h 的浸提液。其中,α-MEM 完全培养基用于MC3T3-E1 细胞的培养,DMEM完全培养基用于L929细胞的培养。
1.2.6 细胞增殖
用MC3T3-E1和L929细胞系评价样品的生物相容性。细胞接种24 h 后,用两种条件培养基代替原培养基,以两种完全培养基作为对照,条件培养1、3、5 d后测定细胞增殖。按CCK-8试剂盒要求,将细胞与CCK-8 试剂共孵育2 h,用酶标仪在450 nm波长下测定吸光度。
1.2.7 抗菌性能评价
用革兰阳性的S.aureus(ATCC 25923)和革兰阴性的E.coli(ATCC 25922)评价复合膜的抗菌性能。将E.coli和S.aureus的单菌落分别置于LB液体培养基中,摇晃过夜(37 ℃,220 r/min),培养至对数生长期,用于后续实验。
为了直观地观察细菌细胞膜形态的变化及材料表面细菌的生长情况,将E.coli和S.aureus悬液(1×104CFU/mL,1 mL/孔)接种于材料表面,37 ℃孵育24 h。PBS 洗涤3 次,用2.5%戊二醛4 ℃固定过夜,采用乙醇(30%、50%、70%、90%、100%)对微生物进行梯度脱水后4 ℃保存,金溅射涂层后用扫描电镜观察。
将1 mLE.coli和S.aureus悬液(1×106CFU/mL)接种于复合膜表面,37 ℃孵育24 h。用PBS 轻轻冲洗复合膜表面3次,然后在1 mL PBS 中超声分离黏附在膜表面的细菌(50 Hz,5 min)。将得到的菌液分别稀释1×103、1×104倍,将稀释后的菌液100 μL均匀涂抹于LB固体培养基平板上,24 h后计数。抑菌率计算如下:抑菌率(%)=(对照组CFU-实验组CFU)/对照组CFU×100%。
1.3 统计学方法
实验共进行3 个重复,数据以均数±标准差()表示。对于两组以上的比较,使用Tukey’s或Dunnett’s事后检验的单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 Mg/PLA复合膜的表征
本研究制备了负载不同含量Mg颗粒的Mg/PLA复合膜。SEM 观察显示复合膜的表面形貌与PLA膜相似,相对较为平坦,但复合膜表面粗糙度较大(图1)。在10 000 倍的放大倍数下,复合膜粗糙表面更明显(图1)。与PLA 膜相比,复合膜的表面粗糙度增加,应该与球形Mg颗粒的加入有关。

图1 PLA膜和Mg/PLA复合膜的SEM图像(标尺1 μm)Figure 1 SEM images of PLA membrane and Mg/PLA composite membranes(scale 1 μm)
膜的拉伸应力-应变曲线如图2所示。随着复合膜中Mg含量的增加,复合膜机械强度呈现出先增加后降低的趋势。10%wt Mg/PLA 复合膜的抗拉强度显著提高,而负载40%wt Mg颗粒者机械强度降低。
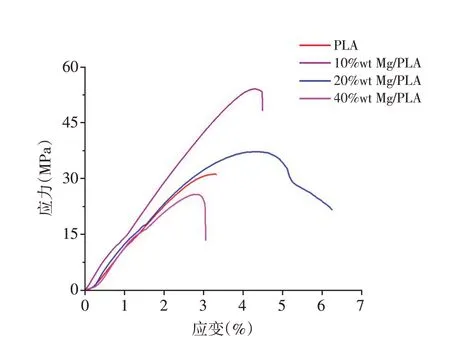
图2 PLA膜与Mg/PLA复合膜的典型应力-应变曲线Figure 2 Typical stress-strain curves of PLA membrane and Mg/PLA composite membranes
将PLA 膜和3 种复合膜样品浸泡在PBS 溶液中进行浸没试验,检测24 h 内PBS 溶液pH 值的变化。如图3 所示,PLA 的pH 值基本稳定在7.35~7.40,而复合膜组pH 值均呈现缓慢的升高状态,10%wt Mg/PLA 和20%wt Mg/PLA 组pH 变化相似,40%wt Mg/PLA 组pH 升高相对明显,最高时达7.65±0.01。

图3 PLA膜与Mg/PLA复合膜在PBS中随时间的pH值变化Figure 3 pH values of PLA membrane and Mg/PLA composite membranes immersed in PBS at different times
2.2 生物相容性和抗菌性能
用CCK-8 试剂盒评价复合膜降解产物对MC3T3-E1 和L929 细胞的生物相容性。考虑到Mg的初始降解不利于细胞黏附,我们使用24 h 的材料浸提液进行评价。结果表明,与空白对照相比,无论是PLA 降解产物还是复合膜降解产物对细胞生长和增殖均没有毒性作用(图4)。综上所述,PLA 和Mg/PLA 复合膜的降解产物具有良好的生物相容性。
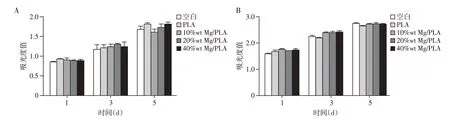
图4 CCK-8检测24 h材料浸提液中MC3T3-E1(A)、L929(B)的增殖情况(n=3)Figure 4 The proliferation of MC3T3-E1(A)and L929(B)in 24 h membrane extract was determined by CCK-8(n=3)
SEM 显示,细菌与膜材料共培养24 h 后,复合膜组细菌黏附减少。随着Mg 颗粒负载增加,复合膜组S.aureus黏附减少,20%wt Mg/PLA 和40%wt Mg/PLA复合膜组黏附细菌见胞膜膨胀,细菌变形。同时,复合膜组E.coli鞭毛减少,细菌活性降低,20%wt Mg/PLA和40%wt Mg/PLA复合膜组E.coli表面出现了明显的变形、收缩甚至溶解现象(图5)。结果表明,pH值和离子浓度的升高会引起细菌胞膜肿胀、变形甚至破裂,抑制细菌生长增殖,甚至导致细菌死亡。同时复合膜的抑菌效果可能也与材料表面不利于细菌的附着有关。

图5 SEM观察材料表面金黄色葡萄球菌和大肠杆菌生长情况(×5 000,比例尺1 μm)Figure 5 SEM images of S.aureus and E.coli incubated on membranes(×5 000,scale 1 μm)
Mg 颗粒的添加量与膜的抗菌效果有显著的相关性。菌落计数的结果显示,PLA 的菌落数最高,随着Mg 颗粒负载量的增加,菌落数逐渐下降。图6 为直接接触材料表面的菌落计数结果。与PLA 相比,10%wt Mg/PLA、20%wt Mg/PLA 和40%wt Mg/PLA 对S.aureus的抑菌率分别为(40.83±7.54)%、(67.63±10.21)%和(82.73±2.68)%。对E.coli的抑菌率分别为(42.07±4.05)%、(80.63±1.34)%和(91.58±4.44)%,其中20%wt Mg/PLA、40% wt Mg/PLA 的抑菌率显著高于10%wt Mg/PLA 复合膜组。这可能是Mg 颗粒降解所释放出的Mg2+与所创造的碱性环境综合作用的结果。
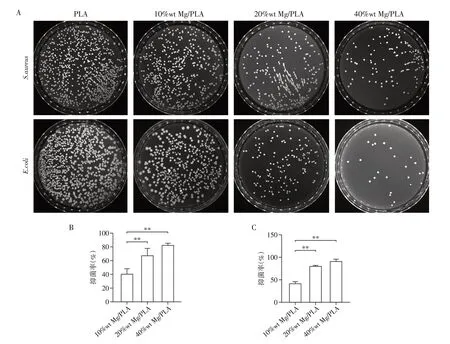
图6 金黄色葡萄球菌和大肠杆菌菌落的LB平板计数照片(A)及相应样品对金黄色葡萄球菌(B)和大肠杆菌(C)的抑菌率的定量分析Figure 6 LB plate counting photos of S.aureus and E.coli colonies(A)and quantitative analysis of bacteriostasis rate of corresponding samples against S.aureus(B)and E.coli(C)
3 讨论
目前已有关于Mg 增强聚合物作为骨移植材料的制备方法、力学性能和生物相容性等方面的研究[20-23]。但是以往研究中较低的Mg添加量(≤10%wt)往往不足以实现良好的抗菌性[24]。本研究在PLA中负载较高含量的Mg,制备具有抗菌功能的复合膜。本研究表明,Mg的添加量在一定范围内有利于提高PLA膜的机械强度,而较高的Mg含量(40%wt)减弱了这种增强效果(图2)。从Cifuentes等[21]的研究可以看出,Mg/PLA 复合材料填料强化系数随Mg含量的增加而减小,Mg颗粒有效地促进了PLA分子的热降解。当填料对热降解的影响大于其增强效果时,其在PLA基质内的机械性能下降。本研究也与这一结果相吻合,说明一定范围内Mg 增强PLA是可行的。已经证实,Mg增加了聚合物塑性流动的阻力,略微降低PLA 的结晶度,在一定程度上调控PLA 劣化降解的时间[25]。Mg 颗粒的载入无疑对复合材料的力学性能有一定的调节作用。
细胞生物相容性的结果显示,PLA膜与Mg/PLA复合膜均有良好的生物相容性,对MC3T3-E1 和L929细胞的增殖没有不利影响。这一结果说明,本研究范围内的镁添加量并未形成真正的“高镁”环境,打破了以往较高含量Mg 颗粒加入会造成“高镁”环境抑制细胞生长[22]的猜想。对于抗菌实验结果,无论是扫描电镜下观察还是菌落计数均表现出明显的抑菌作用(图5、6)。一般来说,材料的抗菌作用机制主要为以下两个方面:①细菌胞膜通透性的变化,是逸出的抗菌金属离子与细菌外膜相互作用造成的;②细菌与抗菌材料产生的自由基的相互作用[26-28]。在本研究中,Mg颗粒降解产生的氢氧根离子可以提高局部pH 值,有望在一定程度上抵消PLA持续降解晚期产生的酸性产物。在体外降解实验中,复合膜组的pH 值均有所升高(图3),最终形成了更有利于抗菌的碱性环境。本研究的抑菌机制可能是抑菌金属离子的释放和碱性微环境对细菌外膜的影响,导致外膜上形成膨胀和变形。这些结构形态的改变引起膜通透性的改变,导致脂多糖分子和膜蛋白的不断释放,最终导致细菌死亡[26]。这一推测也与复合膜表面细菌的微观形态相一致(图5)。根据SEM 下观察到的细菌黏附形态的变化,我们推测细菌对材料表面的黏附随着Mg 的添加量的增加而减少。结果表明,细菌对Mg/PLA 复合膜的初始亲和力较低,这可能与Mg 颗粒的部分降解导致的H2释放有关。
细菌在生物材料表面的初始黏附是生物膜形成的关键阶段。研究表明,生物膜中细菌对抗生素的耐药性是浮游细菌的10~1 000 倍[29]。通过有效阻断抗生素的进入,生物膜的形成对宿主的防御和抗生素治疗变得更加耐药,从而促进耐药细菌的发展[30-31]。本研究的结果表明,复合膜对细菌的抑制作用随着Mg 负载增加而升高,包括一定的杀菌效果和抑制细菌生长和繁殖的作用。
本研究将Mg/PLA 复合膜作为GBR 膜对其力学性能进行了改良,并对其抗菌性进行了评价。本研究重点研究了Mg 增强PLA 的抗菌性能,然而仍有一些局限性。首先,由于体内降解环境的复杂性,涉及酶促反应、炎症反应等,其降解特性与体外不尽相同。除此之外,作为GBR 屏障膜的替代生物材料,评估这种复合膜的成骨效果是下一步研究的重点。
本研究将抗菌的金属Mg 颗粒负载到生物惰性PLA 基体中,制备了具有抗菌性的功能复合膜。20%wt Mg/PLA和40%wt Mg/PLA复合膜的表面粗糙度、抗菌性均显著高于PLA,其中,40%wt Mg/PLA的Mg 含量最高,抗菌性也优于其他复合膜组,但过量的Mg 添加降低了复合膜的力学性能。在24 h的降解实验中,复合膜组降解溶液的pH 不同程度地升高,但均处于生理范围。综上所述,20%wt 的Mg 负载量为Mg/PLA复合材料作为GBR屏障膜使用提供参考。

