体素内不相干运动成像鉴别肺部鳞、腺癌并评估Ki-67表达
冯鹏洋,孟楠,黄准,方婷,付芳芳,杨阳,袁健闵,高海燕,王梅云,*
1.河南大学人民医院(河南省人民医院)医学影像科,河南 郑州 450003;2.河南省人民医院医学影像科,河南 郑州 450003;3.联影中央研究院,北京 100094;4.联影中央研究院,上海 201815;*通信作者 王梅云 mywang@zzu.edu.cn
肺癌是全球死亡率最高的肿瘤之一[1],其中腺癌和鳞癌是最常见的病理学亚型[2]。靶向治疗对肺腺癌具有较好的治疗效果,但对鳞癌疗效欠佳,甚至会导致严重的不良反应[3]。目前,获取病理分型主要依靠有创活检,但活检易受临床操作者的操作经验以及取样等多种因素的影响。正电子发射型电子计算机断层(positron emission tomography,PET)[4]和体素内不相干运动成像(intravoxel incoherent motion,IVIM)[5]均可用于肿瘤的诊断和鉴别,前者能反映组织的代谢情况,后者可以反映组织的血流灌注和扩散等生理信息。目前,已有多项研究探讨单独使用IVIM或PET诊断肺部鳞、腺癌,但很少有关于IVIM与PET在肺部病变的比较研究。本研究拟应用PET/MR[6]评估18F-FDG PET和IVIM对肺部鳞、腺癌的鉴别诊断价值,并分析各参数与Ki-67的相关性,为肺癌的诊断和治疗提供更多的帮助。
1 资料与方法
1.1 研究对象 前瞻性分析2020年7月—2021年2月河南省人民医院经CT检查怀疑肺部占位并行胸部PET/MR扫描的68例患者。排除标准:①病理证实为小细胞肺癌或非肺癌患者;②有PET/MR扫描禁忌证,如植入心脏起搏器、金属支架、幽闭恐惧症等;③扫描前已接受过手术、药物或放化疗等治疗;④PET/MR未完整扫描以及图像显示不清者。最后纳入41例,其中男24例,女17例,年龄35~79岁,平均(60.6±10.1)岁,腺癌27例,鳞癌14例。本研究经伦理委员会批准(2020116),患者均签署知情同意书。
1.2 检查方法 采用12通道相控阵体线圈的混合3.0T PET/MR扫描仪(uPMR790)进行扫描。建议患者检查前24 h内不进行剧烈运动,禁食6 h以上,早晨空腹血糖<8 mmol/L。注射前要求患者平躺休息5~10 min,然后按标准剂量0.11 mCi/kg静脉注射PET示踪剂18FFDG。图像采集在注射后静息40~60 min。扫描过程中患者保持静躺,自主呼吸。PET扫描采用1个床位,每次采集时间为27 min,采用有序子集最大期望值迭代法(OSEM)重建图像。MR扫描序列如下,轴位T1WI:TR 3.54 ms,TE 1.51 ms,层厚5 mm,FOV 400 mm× 300 mm,层数35,激励次数1;轴位T2加权压脂像:TR 3 315 ms,TE 90.2 ms,层厚5 mm,FOV 380 mm× 300 mm,层数42,激励次数2;IVIM序列:TR 3 315 ms,TE 90.2 ms,层厚5 mm,FOV 400 mm×300 mm,b值取0、25、50、100、150、200、400、600、800、1 000 s/mm2,激励次数为1、1、2、2、4、4、6、6、8、10。
1.3 图像分析 采集到的PET/MR原始数据导入UWS-MR:R005工作站,利用相关软件对PET图像和IVIM图像进行处理和分析,在后处理软件中通过PET半自动化的肿瘤感兴趣体积(volume of interest,VOI)进行分析,对肿瘤周围手动绘制VOI,自动计算肿瘤的最大标准化摄取值(SUVmax)、肿瘤代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion glycolysis,TLG)。将IVIM各参数的伪彩图与扩散加权成像(DWI)图像相融合,以轴位T1WI、T2WI和DWI序列为参考,对包含肿瘤的每个层面的图像勾画感兴趣区(ROI),避开明显出血、坏死和囊变等区域,同时,所勾画每个层面的ROI与PET图像上病灶范围一致。收集每个层面的ROI,记录扩散系数(D)、假扩散系数(D*)及灌注分数(f)值,最后计算IVIM各参数的平均值。上述所有定量参数由2名放射科医师采用盲法独立完成测量。所有患者均在PET/MR扫描后1周内接受活检或手术获取标本。
1.4 病理分析及免疫组化检查 经手术切除的肿瘤组织离体后送至我院病理科进行脱水、浸蜡、包埋、切片以及常规HE染色,最终确定病理类型。Ki-67以细胞核出现棕黄色颗粒或褐色颗粒为阳性细胞,每张切片随机选择10个高倍视野进行观察。
1.5 统计学方法 采用SPSS 23.0软件和MedCalc 15.0软件,采用组内相关系数(ICC)评价2名放射科医师测量结果的一致性。采用Kolmogorov-Smirnov检验各参数值是否符合正态分布,符合正态分布者用±s表示,采用独立样本t检验;不服从正态分布者用M(Q1,Q3)表示,采用Mann-WhitneyU检验。SUVmax、MTV和TLG值与D、D*和f值间的相关性以及各参数与Ki-67间的相关性采用Pearson相关分析。用受试者工作特征(ROC)曲线评价各参数对肺部鳞癌和腺癌的诊断效能;用Delong方法比较不同参数下ROC曲线下面积(AUC)的差异。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组肺癌患者年龄、性别、肿瘤直径、淋巴结转移、分化程度、吸烟、饮酒及辅助治疗比较,差异均无统计学意义(P>0.05),见表1。
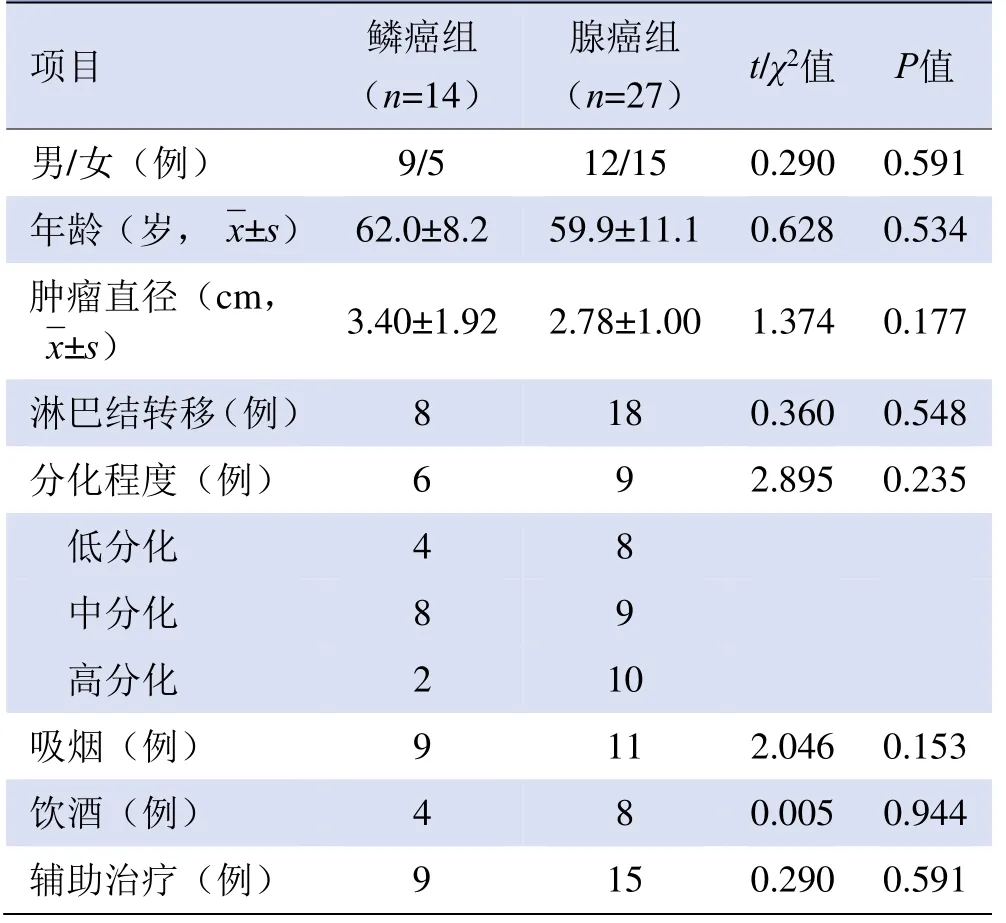
表1 两组肺癌患者基本信息
2.2 一致性分析 2位医师测量SUVmax、MTV、TLG、D、D*和f值均具有较高的一致性(ICC=0.895、0.834、0.857、0.883、0.783、0.799)。取两者的平均值作为最终结果。
2.3 两组各参数对比18F-FDG PET和IVIM各参数伪彩图见图1。鳞癌组的SUVmax和TLG高于腺癌组(P均<0.05)。腺癌组的D、D*和f值高于鳞癌组(P均<0.05),见表2。
2.4 诊断效能评估 D、SUVmax、f、D*和TLG诊断肺部鳞、腺癌的AUC见表3,各参数AUC两两比 较,差异均无统计学意义(P>0.05),见图2。
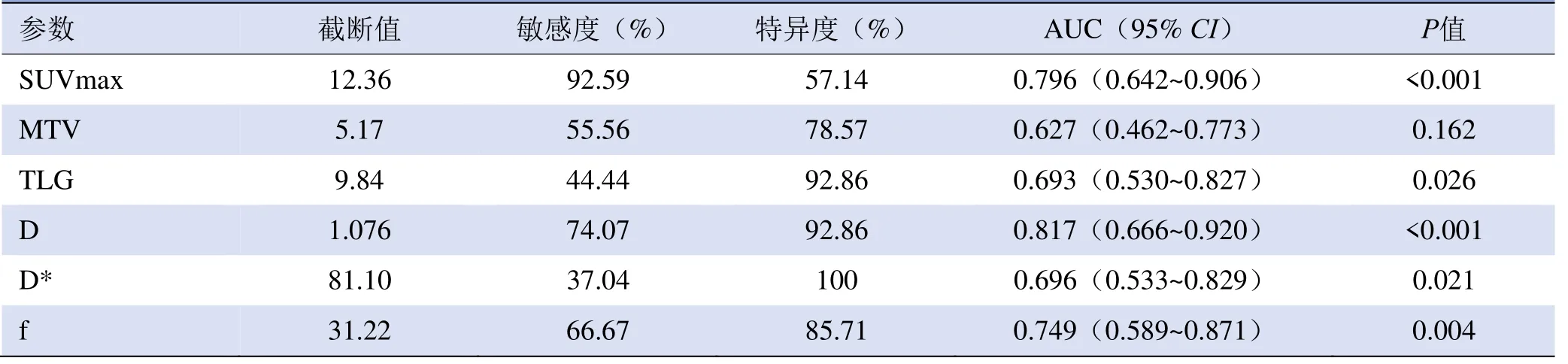
表3 各参数鉴别诊断肺部鳞癌、腺癌的效能
2.5 相关性分析 SUVmax与Ki-67呈正相关(r=0.354,P=0.023),D值与Ki-67呈负相关(r=-0.371,P=0.017)。f值与SUVmax、MTV和TLG均呈负相关(r=-0.359、-0.315、-0.331,P均<0.05)。
3 讨论
3.1 IVIM评估肺部鳞、腺癌的价值 IVIM由DWI延伸而来,通过多b值采集图像以及对测量值进行算法拟合,从而定量评估组织血流灌注和水分子扩散等信息[5]。D值反映水分子的真实扩散,其大小主要受细胞密度和细胞外基质成分的影响。本研究中,腺癌的D值大于鳞癌,推测其原因是腺癌的肿瘤细胞倾向于气管外生长或沿肺泡壁生长,而鳞癌细胞以团块状生长为主[7],鳞癌的肿瘤细胞密度高于腺癌,因此鳞癌的D值更小。D*与f值均反映组织内微循环灌注,但是各自的侧重点却不相同,D*值大小主要受血管数量、毛细血管长度及血流速度的影响,而f值则反映微循环灌注效应占整体扩散效应的比值。本研究发现,腺癌D*与f值均大于鳞癌,表明两者均可以用于鉴别鳞、腺癌。然而既往研究中,D*与f值的可靠性一直存在争议[8-9]。理论上,随着肿瘤分化程度降低,肿瘤血管密度增加,微循环会更加丰富,肿瘤灌注增大,D*与f值均会增加,因此鳞癌D*与f值应该大于腺癌。但本研究结果与其相反,推测与鳞癌的肿瘤细胞增殖水平高、细胞排列密集、毛细血管血流易受压减速相关,同时,肿瘤细胞的异质性、肿瘤坏死元素增多以及扫描参数的选择差异均会对研究结果产生影响。
3.218F-FDG PET评估肺部鳞、腺癌的价值 PET是一项无创的功能成像技术,通过特异性标记放射示踪剂分辨正常组织与肿瘤组织的葡萄糖代谢差异,从而对肿瘤进行诊断和鉴别[4]。SUVmax是临床上最常用的半定量诊断指标,反映肿瘤最活跃部位的葡萄糖代谢程度。本研究中,鳞癌的SUVmax大于腺癌,与既往研究结果相似[10],可能与鳞癌的倍增时间短、增殖速度快以及葡萄糖转运蛋白(facilitative glucose transporter,Glut)表达高于腺癌有关[11]。MTV与TLG均可以反映肿瘤的代谢体积,后者能够同时反映肿瘤的代谢活性[12]。本研究发现,鳞癌的TLG高于腺癌,推测与鳞癌的Glut蛋白表达高于腺癌有关[13],在缺血、缺氧情况下,Glut1表达增加,由于腺癌的微血管密度高于鳞癌,因此缺氧导致鳞癌的Glut1表达增加,最终导致TLG升高。然而,本研究中两组MTV并无显著差异,其原因可能是本研究纳入样本量有限,还需大规模前瞻性研究进一步评估。与SUVmax相比,MTV与TLG反映肿瘤的信息更加全面,对癌症患者预后的评估意义更加显著[14]。然而本研究中并未显示出更好的诊断效能,推测可能是由于鳞癌与腺癌的体积类似,没有SUVmax改变灵敏,而且可能与VOI勾画时存在的误差相关。
3.3 各参数与Ki-67的相关性 Ki-67是评估肿瘤细胞增殖活性的良好指标[15]。本研究中,Ki-67分别与SUVmax和D值呈中度正相关和中度负相关,与既往研究[16-17]结果一致,其原因为较高的Ki-67往往代表肿瘤细胞增殖能力强,这不仅会导致组织能量需求增加,FDG摄取增多,而且会引起细胞密度增大,水分子扩散受限[18],因此SUVmax增高且D值降低。将体积代谢参数与Ki-67进行相关性分析,能够克服肿瘤的异质性、高低代谢分布不均以及肿瘤采样误差。已有研究表明[19],肿瘤细胞增殖能力越活跃,肿瘤体积及细胞密度也会增大,从而需要摄取的18F-FDG也随之增多,MTV与TLG亦增大。然而本研究中并未发现MTV、TLG与Ki-67有显著相关性,推测其原因可能是本研究纳入样本量有限。此外,本研究显示,Ki-67与D*、f值无明显相关性。Wang等[20]在一项膀胱癌研究中也证实了这一观点,认为水分子的扩散受限可以反映增殖程度,但是血流灌注不具备此优势,充血、水肿等良性反应均可以使血流灌注发生改变。因此,这一结果证实D*、f值受干扰因素过多并不能反映肿瘤的侵袭性。
3.4 本研究的局限性 ①本研究纳入样本量较少,腺癌数量明显多于鳞癌,尚需大样本研究进一步验证研究结果。②肺部扫描受呼吸运动、心脏搏动和磁敏感的影响,导致部分图像质量稍差。③IVIM的b值选取目前无统一标准,因此IVIM序列难以确定最佳b值的数量及大小。
综上所述,18F-FDG PET和IVIM均有利于肺部鳞癌和腺癌的诊断,两者的诊断效能相似,部分参数与Ki-67存在一定的相关性,可为预测非小细胞肺癌的恶性程度及预后提供更多信息。

