超声引导经皮微波消融治疗T2期乳腺癌的探索性研究
姜剑,戴雨晴,陈思彤,梁萍,于晓玲,于杰*
1.解放军医学院,北京 100853;2.解放军总医院第五医学中心介入超声科,北京 100853;*通信作者 于杰 jiemi301@163.com
乳腺癌是目前全球发病率最高的癌症,也是女性癌症死亡的主要原因[1],目前临床治疗方案以外科手术为主,虽然手术创伤随技术发展逐渐减小,但对于高龄、身体状况差,或具有美观学要求、心理负担重的患者,微创且能彻底消灭肿瘤的疗法尤为重要[2-3]。超声引导下经皮微波消融(microwave ablation,MWA)已经应用于肝癌[4-6]、肾癌[7-8]、甲状腺癌[9-10]等领域并得到认可,而微创消融仅在部分T1期乳腺癌中进行探索性研究[11-12]。本研究拟回顾性分析经超声引导下MWA治疗的T2期乳腺癌患者,进一步研究MWA治疗乳腺癌的应用范围与疗效。
1 资料与方法
1.1 研究对象 回顾性纳入2015年12月—2020年12月在解放军总医院第五医学中心接受超声引导下经皮MWA治疗的T2期女性乳腺癌患者18例。所有患者均行常规超声、超声造影和增强MRI检查,最终通过穿刺活检结果确定病理类型。除1例消融目的为减瘤外,其他均为身体状况差无法手术或拒绝手术患者。纳入标准:①单侧乳腺单发肿瘤;②最大径2.0~5.0 cm(T2期乳腺癌);③穿刺活检证实为乳腺癌;④对系统治疗不敏感或拒绝系统治疗。排除标准:①妊娠或哺乳期女性;②有凝血功能障碍者;③严重高血压、糖尿病及心肺功能不全者;④全身其他任何部位存在急性或活动性感染性疾病;⑤超声检查显示肿瘤边界不清。本研究经本院医学伦理委员会批准(S2019-154-01),患者均签署知情同意书。
1.2 仪器与方法
1.2.1 超声检查 使用GE LOGIQ E9超声诊断仪,同时用于常规超声检查、超声造影检查与微波消融过程,探头频率6.0~15.0 MHz。采用KY-2000型微波治疗仪(南京康友),频率2 450 MHz;消融针直径1.6 mm(16G),长度10 cm,发射前端为3 mm。使用16G全自动活检枪(巴德公司)进行活检。超声造影剂采用声诺维。
1.2.2 MRI检查 使用GE Discovery 750 3.0T MR扫描仪,患者取俯卧位,双乳悬垂于线圈内。平扫扫描参数:脂肪抑制T2WI轴位,TR 5 800 ms,TE 80 ms;扩散加权成像轴位,TR 2 230 ms,TE 8.6 ms。采用双扩散敏感系数b=1 000 s/mm2和b=1 500 s/mm2。增强扫描采用三维容积内插快速扰相梯度回波序列+T1WI压脂轴位检查,先扫蒙片,TR 4.0 ms,TE 1.1 ms,然后以2.5~3.0 ml/s团注钆喷酸葡胺,同时立即连续采集5期图像,间隔1 min后,扫描第6期图像。术前对患者进行常规超声、超声造影、超声引导下穿刺活检及增强MRI检查。术前常规检查凝血、血常规及术前8项。
1.2.3 消融过程 患者仰卧,充分暴露乳腺并全面扫查,确定肿块部位及毗邻,观察肿块大小、形态、回声、边界,用彩色多普勒超声观察病灶内及周边血流。常规消毒铺巾,于病灶后方及皮肤下局部麻醉;当结节靠近(≤1 cm)或侵犯皮肤/胸肌浅筋膜等危险部位时,在病灶与危险部位间注入适量生理盐水形成液体隔离带。超声引导消融针刺入肿瘤,在肿瘤内部用较高消融功率(30~50 W)提升消融疗效与效率,靠近危险部位则使用20 W功率降低损伤风险,消融范围包括肿瘤及周边0.5~1.0 cm的正常组织。全程超声动态观察至肿瘤被高回声完全覆盖后,再次用超声造影评估血流信号,确认完全消融后结束治疗。随后局部冷敷,在观察室监测4~5 h,确认正常后返回病房。
对于有可疑淋巴结转移的患者,进行超声造影和穿刺活检确认为恶性淋巴结后,依据患者状态选择消融治疗时机。
1.3 观察指标 收集患者人口学资料、MWA前的治疗情况、腋窝淋巴结转移和消融原因。观察肿瘤部位、最大径、体积、特殊侵袭部位、病理类型、分子分型和TNM分期。记录消融功率、时间、穿刺次数、生理盐水注入量等。记录术后并发症、住院时间、技术成功率、技术有效性、患者美容满意结果和预后等。技术成功率指消融区完全覆盖预计范围的患者的比率,由术后即刻超声造影检查进行评估;技术有效性指MWA治疗1个月后无残留肿瘤的比率,由术后3个月及每6个月的超声造影检查联合增强MRI检查评估,标准为消融区无血流灌注且周边无结节样增强。另外,术后由患者填写评价表评估美观满意度:1.非常满意;2.满意;3.一般;4.不满意;5.非常不满意。
1.4 统计学分析 采用SPSS 26.0软件,符合正态分布的计量资料以±s表示,非正态分布者以M(Qr)表示。计数资料以例表示。以Kaplan-Meier模型计算消融后患者中位生存时间。
2 结果
2.1 患者一般资料 18例患者年龄33~83岁,平均(61.8±11.9)岁。3例术前化疗敏感性差,15例术前未行其他治疗;13例不适合行外科手术,5例拒绝外科手术和其他系统治疗。18例共19枚肿瘤,最大径2.1~5.0 cm,平均(3.1±0.9)cm;体积1.7~43.0 cm3,平均(10.5± 10.3)cm3,见表1。
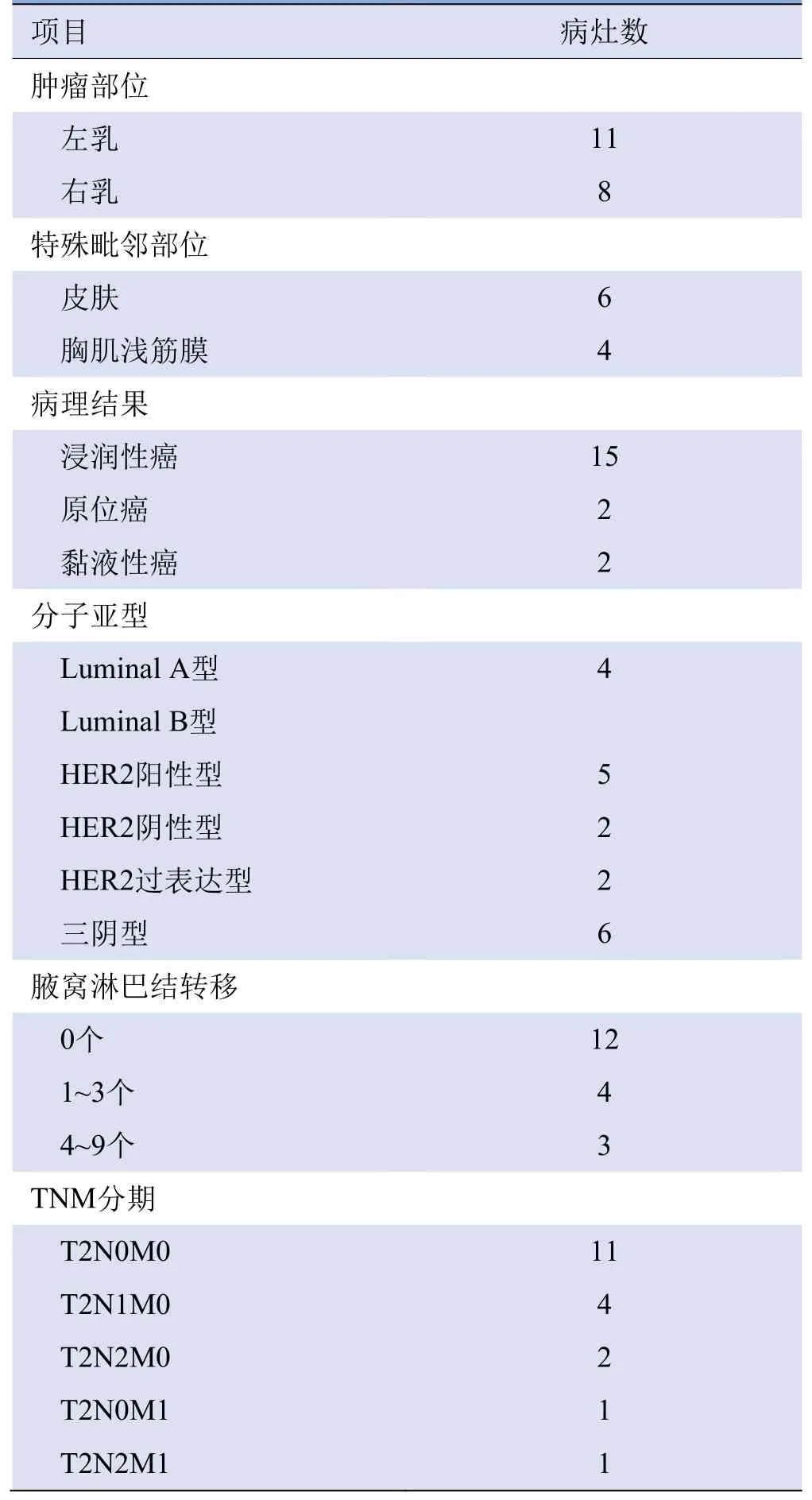
表1 19枚T2期乳腺癌病灶的基本信息(枚)
2.2 微波消融治疗参数 患者的MWA均在局部麻醉下进行,13枚结节进行1次消融,6枚结节进行2次消融;中位消融时间为17.5(4.8~87.4)min,中位消融总能量为30.9(6.5~242.3)kJ;肿瘤内累计穿刺1~11次,平均(3.9±3.0)次。对靠近皮肤或胸壁的肿瘤,消融前均进行液体隔离带保护注射,生理盐水中位注射体积为60(20~150)ml。
7例证实淋巴结转移后,4例于乳腺癌病灶消融后即刻、3例于消融后2 d内进行淋巴结消融。共消融27枚淋巴结。消融淋巴结最大径0.4~3.9 cm,平均(1.4±0.8)cm;消融时间为1.4(0.4~10.7)min,中位消融总能量为1.7(0.4~14.0)kJ。
2.3 疗效评价与术后随访 MWA的技术成功率和技术有效性均达到100%,见图1。
患者中位术后住院时间为3(1~15)d,中位随访时间为30(11~49)个月。此外,术后9例患者接受化疗,4例接受放疗,5例接受内分泌治疗,1例接受免疫治疗,1例接受靶向治疗(部分患者同时接受以上多项治疗);4例未接受任何其他治疗。
随访期内,4例患者死亡,1例死于心脑血管意外;另外3例为三阴型乳腺癌,1例术前发生脑转移、1例术前全身转移与1例术后17个月对侧乳腺复发患者分别于术后43、15、29个月死亡。4例发生肿瘤复发,其中3例三阴型乳腺癌、1例Luminal B型。患者中位生存时间为11.5(3~35)个月。
复发患者中,1例三阴型乳腺癌与1例Luminal B型患者于术后11、12个月行手术切除,另外2例患者拒绝手术,常规行系统治疗。对MWA术后未接受外科手术切除治疗患者的生存率进行Kaplan-Meier分析,MWA消融治疗T2期乳腺癌后,随访期内(截至2021年12月)患者的中位无瘤生存期为41个月,中位总生存期为47个月(图2)。
2.4 微波消融相关并发症与美观满意度 患者术中生命体征平稳,术区未出现明显不适;术后3例出现轻度红肿,2例轻度压痛、2例轻度烫伤,除常规冰敷外未进行特殊治疗,出院前康复。1例患者由于肿瘤侵犯皮肤且体积较大,术后出现皮肤破溃,彻底清创并规律消毒换药后4个月内愈合创口。17例患者美观满意度高(评级为1或2),仅1例认为一般但可接受。
3 讨论
3.1 乳腺癌消融治疗的可行性 随着医学影像技术的发展及患者对乳腺癌认识的加深,乳腺癌的检出率逐渐提高[13]。目前尚无完全治愈乳腺癌的方法和药物,但乳腺具有一定的特殊性,除疾病本身带来的身体伤害外,乳腺外观改变与乳腺切除手术对女性患者造成的精神负担显著增加,乳腺癌患者焦虑和抑郁症状与其他肿瘤患者相比较为突出[14],微创的消融治疗成为临床需求。
相关研究证实无论是单发还是多发乳腺良性肿瘤,在符合适应证的条件下,微波消融治疗均可以达到较好的结节治疗效果,且适用于对美观度要求高的患者[15-17];既往研究通过活检或手术病理结果,对微波消融病灶坏死治疗乳腺癌的疗效进行探索[18-20],以上研究结果为微波消融治疗应用于乳腺癌的可行性提供了一定证据。
目前MWA治疗乳腺癌主要应用于≤3 cm的病灶,且随访时间相对较短;同时在大多数消融治疗研究中,由于消融有引起潜在热损伤的风险,主要纳入标准均包括当患者取仰卧位时,肿块距离皮肤和胸壁>5 mm。而在实际临床工作中,需要MWA治疗的患者很多,如患者高龄、基础状况差或拒绝手术等,对精准微创的微波消融治疗提出了机遇和挑战。
3.2 本研究的优势 本研究通过相对较长时间的随访,发现MWA治疗对非三阴型乳腺癌预后相对较好,且随访期内大部分患者在美观满意度较高的同时,获得了较好的技术成功率和技术有效性。为探索MWA乳腺癌更广泛的应用与相关研究开展提供证据与思路。
MWA术中重要的技术要点包括:①向肿瘤与特殊部位之间的间隙内注射生理盐水形成液体隔离带保护正常组织;②合理规划消融方案,结合移动消融技术灵活调整的不同消融功率(20~50 W)与必要时多针多点消融,保证治疗效果与安全性。
3.3 本研究的局限性 ①疗效判断是各类消融治疗争议的热点,微创治疗损伤低的特点使其无法像手术一样通过病理分析结果直观证明消融灶的坏死情况及外周组织学特征。对此,结合增强影像学检查具有重要意义。术后即刻超声造影与规律随访过程中的增强影像检查也可以用于评估乳腺肿瘤各类治疗后的实际疗效[21-23]。②MWA治疗在T2期乳腺癌中的应用仍处于早期阶段。虽然MWA技术的安全性和可行性已经得到一定证明,但仍需要更大样本量和长期随访的前瞻性研究以及与外科手术的对照研究进行深入探索。其主要难点在于选择MWA治疗的患者往往年龄大、病情差,甚至耐受放化疗,因此难以匹配的基线使常规的队列对照研究成为挑战。
总之,MWA治疗对非三阴型T2期乳腺癌可行,且创伤小、恢复快,在适当的方案下,既可以实现消融治疗效果,又能保护周围正常组织,为无法手术的患者提供了微创治疗的机会。未来,大规模的前瞻性研究将有机会为无法手术的非三阴型中晚期乳腺癌患者选择MWA作为治疗方案提供更多的支持证据。

