心肺复苏后继发高钾血症对心脏节律影响的临床研究
刘超 邹鑫森
高钾血症引起心脏骤停(CA)报道较多。而继发于CPR 的高钾血症逐渐引起重视,研究发现继发CPR 的重度高钾血症患者的比例达到35.4%[1]。CA 后因无氧代谢增加引起代谢性酸中毒,细胞内钾转移形成高钾血症。CPR 后心脏经历缺血再灌注(ischemia/reperfusion,I/R)损伤,研究发现控制性高钾抑制钙超载有改善心脑I/R 损伤的效果[2-3]。然而立即处理CA 后高钾血症,是否影响复苏后心功能仍不明确,为指导临床实践,本研究将探讨这一问题。
1 临床资料
1.1 一般资料(1)纳入标准2018 年1 月-2021年5 月,重庆大学附属三峡医院重症医学科收治的患者,在住院期间给予CPR 者且复苏后1 小时血钾提示高钾血症者。(2)排除标准高钾血症所致CA,CPR 前有高钾血症者,CPR 后血钾正常或低于正常者。CPR 前12 小时内无血钾且血钾>7.0 mmol/L,无心电图资料者。(3)诊断标准高钾血症:动脉血气分析血钾5.5 mmol/L-7.0 mmol/L。(4)新发心律失常标准:与CPR 前心律不一致者(由心电图结果对比确定)。该临床研究经医院伦理委员会批准(编号:重庆大学附属三峡医院2021 年科研第(120)号),患者均签署知情同意书。
1.2 方法CPR 操作程序(按照CPR2015 版指南进行[4])。将复苏后符合纳入排除标准的患者按数字表法随机分为处理组和观察组。处理组给予50%葡萄糖+10%葡萄糖酸钙20 ml 缓慢静脉推注及5%碳酸氢钠125 ml 静脉滴注;观察组:密切监测血钾。CPR 成功后均进行呼吸、循环支持。
1.3 观察指标(1)基本情况:并记录性别,年龄,ApacheⅡ评分、基础疾病等。CPR 前12 小时内的血钾,复苏前心电图;(2)监测相关指标:CPR 时间,监测CPR 后1 小时、3 小时、12 小时血钾、新发心律失常以及再次CPR 例数(≥1 次),24 小时预后等情况。
1.4 统计学方法采用SPSS 16.0 统计软件分析。计量资料正态或近似正态分布以(±s)表示,两组比较采用完全随机设计两样本t检验;各组前后对照采用配对t检验,方差不齐采用近似t检验;计数资料的比较采用χ2检验;P<0.05 为差异有统计学意义。
2 结 果
2.1 患者基本资料见表1。
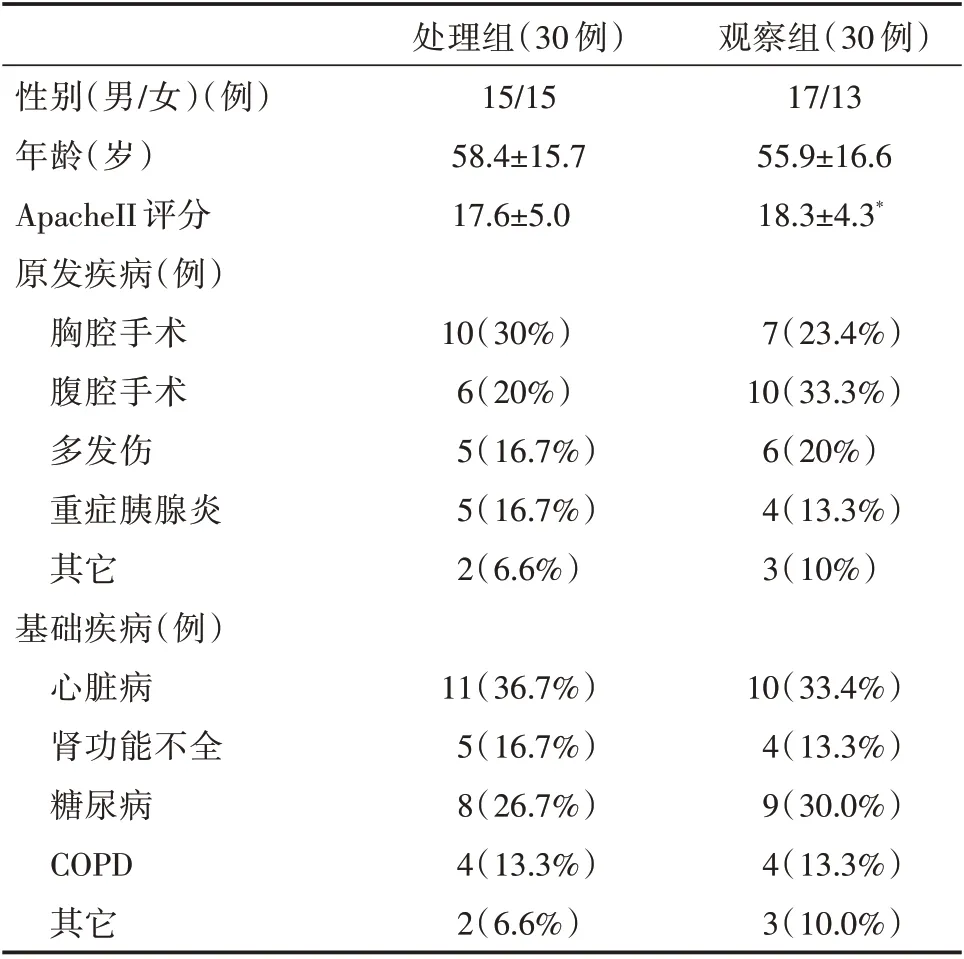
表1 入组患者基本资料
2.2 各组各时间点血钾情况见表2。
表2 各组各时间点血钾比较(mmol/l,±s)
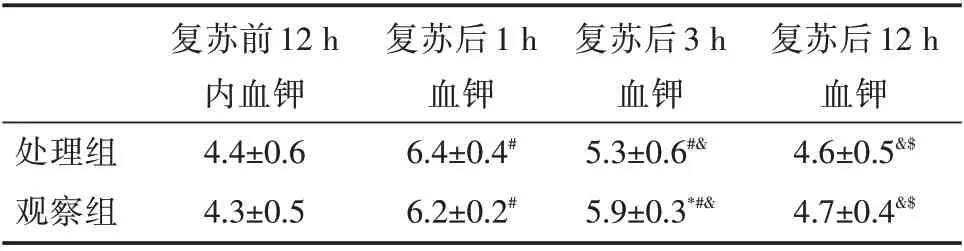
表2 各组各时间点血钾比较(mmol/l,±s)
注:与处理组比较,*P<0.05;与复苏前12 h 比较,#P<0.05;与复苏后1 h 比较,&P<0.05;与复苏后3 h 比较,$P<0.05。
处理组观察组复苏前12 h内血钾4.4±0.6 4.3±0.5复苏后1 h血钾6.4±0.4#6.2±0.2#复苏后3 h血钾5.3±0.6#&5.9±0.3*#&复苏后12 h血钾4.6±0.5&$4.7±0.4&$
2.3 各组新发心律失常及预后情况比较见表3。
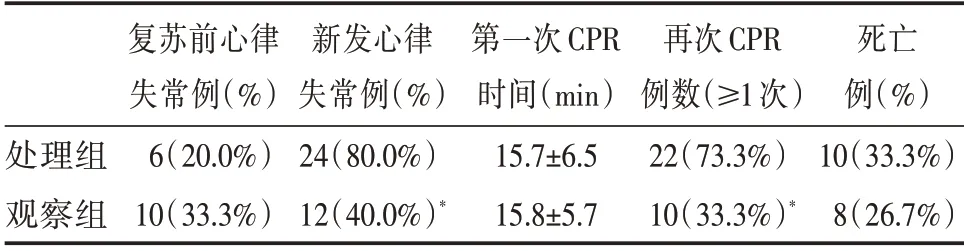
表3 各组新发心律失常及预后情况比较
3 讨 论
CA 使细胞急性严重的缺血缺氧,引起细胞膜、线粒体、溶酶体等的病理损伤。细胞膜通透性增高,导致K+离子顺浓度差透过细胞膜,膜电位下降;线粒体钙离子内流,其呼吸功能降低使ATP 生成减少,Na+-K+泵失活,细胞内K+外流。细胞内缺钾导致酶合成减少,影响ATP 的生成和离子泵的功能。糖酵解增强,乳酸生成增多,脂肪氧化不全使其中间代谢产物酮体增多,导致酸中毒。pH 降低引起磷脂酶活性增高,使溶酶体膜磷脂被分解,膜通透性增高,促进K+进一步外流,形成恶性循环。我们的研究CPR 后1 h 动脉血钾升高与细胞内K+外流有关。
是否积极处理CPR 后高钾血症,尚有争议。观察组血钾逐渐下降趋势,3 h,12 h 血钾均较复苏后1 h 下降。且12 h 后血钾浓度逐渐恢复,与复苏前血钾比较无统计学意义(P>0.05)。说明通过CPR 后积极的呼吸、循环支持,改善细胞的氧供,继发性高钾得到控制。
虽然两组均有同样的降钾效果,但是在复苏后所表现的12 h 新发心律失常以及再次CPR 例数观察组较处理组明显减少。心脏经历I/R 损伤程度与CA 持续时间有关,但两组第一次CPR 时间比较无统计学意义(P>0.05)。说明两组患者缺血时间基本一致。然而复苏后心律失常差异考虑与处理组积极的降钾抵消了高钾的保护性作用以及降钾过程中使用的药物,加重了心肌的I/R 损伤有关。
适度高钾有减轻心脏I/R 损伤作用。目前使用的高钾停跳液是使细胞外的K+浓度升高,跨膜K+梯度下降,Na+内流速度减慢,动作电位的上升速度、幅度及传导速度均减小,利于心脏的舒张。另高钾使钙通道关闭,减少钙内流,抑制心肌收缩,减少心肌氧耗[5]。
处理组使用葡萄糖酸钙拮抗高钾血症引起的心肌毒性,在对I/R 损伤的实验研究中发现,以无钙溶液灌流离体大鼠心脏2 min 后再以含钙溶液灌注时,心肌电信号异常、心脏功能、代谢及形态结构发生异常变化。CPR 后能量贮存被消耗,心肌细胞钙泵衰竭,肌浆网及线粒体不能维持钙隔离的作用,细胞外钙进入细胞内引起钙超载。激活钙依赖性磷脂酶等,引起细胞(器)膜损伤;影响线粒体ATP 的合成;与原肌球蛋白结合,引起心肌挛缩,甚至心肌纤维断裂;激活更多黄嘌呤氧化酶,产生氧自由基,造成细胞损害。
处理组静滴碳酸氢钠(sodium bicarbonate,SB)纠正酸中毒,但是CPR 后有效的呼吸循环支持可减轻酸中毒。因此相关指南不推荐常规使用SB[6]。报道复苏中使用SB 增加自主循环恢复率与出院存活率,但室颤型的CA,使用SB 降低除颤成功率和存活率,且引起高钠血症与不良预后有关[7]。但吴彩军发现复苏后使用SB 减轻心肌细胞内线粒体损伤和细胞呼吸代谢链损伤[8],尽管基础研究结论矛盾,但是否给予SB 仍持慎重态度。
血钾在5.5-7.0 mmol/l 时,[K+]in/[K+]EX 下降,静息电位负值减少,心肌兴奋性增高,当>7 mmol/l,引起心肌兴奋性、传导性、自律性、收缩性下降[9]。本研究入组病例复苏后1 小时血钾均<
7.0 mmol/l。而继发增高的极限尚不明确,需进一步研究。本研究未将复苏后1小时血钾>7.0 mmol/l 纳入观察,因为如血钾>7.0 mmol/l 后,患者出现再次CA 风险未知,而观察组不给予特殊处理,临床医生面对的医疗风险大,所以将其排除在外。观察组通过积极的呼吸、循环支持可起到血钾下降。如果给予常规的降钾处理虽可降低血钾,但降钾药物可能会加重I/R 损伤,引起再灌注性心律失常。
综上所述,本研究发现CPR 后可继发高钾血症,对稳定心律有一定作用。但失去保护性作用的继发性高钾临床界值仍然不清,需进一步研究。

