cid-miR-146a在LCDV-cn感染中的差异表达及其调控作用
胡海浩,黄鉴涛,马嘉霖,杨 硕,闫秀英,简纪常
(广东海洋大学水产学院/广东省水产动物病害防控与健康养殖重点实验室/水产经济动物病害控制广东普通高校重点实验室,广东 湛江 524088)
鱼淋巴囊肿病毒中国株(Lymphocystis disease virus China,LCDV-cn)是牙鲆(Paralichthys olivaceus)淋巴囊肿病的病原[1],致使患鱼在皮肤、鳍、尾部等长有囊肿,给牙鲆养殖造成了重大损失。对LCDVcn 及牙鲆淋巴囊肿病的研究已取得一定进展[2-6],但牙鲆淋巴囊肿病的有效防控依然是水产养殖业中的难题,其原因之一是LCDV-cn 的致病机制知之甚少[7]。微小RNA(miRNA)可通过与靶基因结合对靶基因的转录进行调控,从而参与多种病理、生理过程[8]。因此,对LCDV-cn 感染过程中miRNA 的调控作用进行研究,可在miRNA 层面解析LCDV-cn的致病机制。
研究发现不同物种miR-146a的序列高度保守,提示miR-146a在生物体的生理、病理过程中可能发挥重要作用[8]。已有研究表明miR-146a在多种肿瘤中高度表达,调控肿瘤发生发展的许多生物学过程,而且miR-146a 的调控具有促肿瘤发展的作用,抑制miR-146a 的表达可使肿瘤细胞的致瘤性和侵袭力下降[9-10]。更有研究表明miR-146a 调控病毒的感染过程,如在乙型肝炎病毒(Hepatitis B virus,HBV)感染过程中,miR-146a 通过抑制机体抗病毒反应促进HBV 复制和蛋白表达[11];丙型肝炎病毒(Hepatitis C virus,HCV)感染可诱导miR-146a 的表达上调,从而促进病毒感染[12];在人乳头瘤病毒(Human papilloma virus,HPV)感染中,miR-146a 发挥多重作用,调控HPV 的感染进展[13];还有研究发现,miR-146a 的上调与EB 病毒(Epstein-Barr virus,EBV)感染引起的肿瘤细胞增殖相关[14-15]、有些病人miR-146a 的下调可能与新型冠状病毒(Corona covid-19 virus,COVID-19)感染引起的严重症状有关[16]、miR-146a 可调控人类免疫缺陷病毒(Human immunodefdiciency virus type 1,HIV-1)感染[17]、miR-146a 的表达上调可促进石斑鱼虹彩病毒(Singapore grouper iridovirus,SGIV)感染[18],等。上述研究表明miR-146a 在病毒感染和肿瘤发生中起着重要的调控作用。
本课题组前期研究[19]表明,草鱼miR-146a(Ctenopharyngodon idellamiR-146a,cid-miR-146a)在LCDV-cn 感染草鱼卵巢细胞系(grass carp ovary cells,GCO)过程中存在显著差异表达。因此,本研究在LCDV-cn感染GCO 过程中,对cid-miR-146a进行鉴定和表达特性分析,并探索cid-miR-146a 的调控作用,为在miRNA 层面解析LCDV-cn 的致病机制等提供基础。
1 材料与方法
1.1 材料与试剂
LCDV-cn 分离自患淋巴囊肿病的牙鲆,保存于本实验室;GCO细胞购买于深圳检验检疫局。
本研究所用引物见表1,在上海生工生物技术有限公司合成。
1.2 LCDV-cn感染GCO细胞
用25 cm2细胞培养瓶于28 ℃培养GCO 细胞,具体操作参照文献[2,19],所用培养基为MEM 培养基[含体积分数10%胎牛血清(FBS)],正常传代约48 h 单层细胞铺满瓶底时,吸出培养液,取1 mL 的LCDV-cn 悬液(滴度浓度105.5TCID50/mL[19])进行感染(同时设未感染组为对照组),于20 ℃下孵育1 h后,取出病毒悬液,加入4 mL 维持液(含体积分数2%FBS 的MEM 培养基)于20 ℃下继续感染实验,并定时取样。
1.3 电镜负染
取10 mL 滴度浓度(105.5TCID50/mL)的LCDV-cn悬液[19],于室温和-80 ℃反复冻融4 次,于4 ℃、1 000g条件下离心30 min,取上清用质量分数3%磷钨酸进行染色,于广东医科大学附属医院进行电镜观察。
1.4 颈环(Stem-loop)RT-PCR
取LCDV-cn感染GCO 72 h时样品1瓶(细胞培养瓶),胰酶消化后取1×106个细胞,于室温、1 000g条件下离心3 min,弃上清后,加入1 mL Trizol,按照TRIzol™LS试剂盒说明书提取RNA,并用10 mg/mL琼脂糖凝胶电泳检测RNA 完整性。用提取的RNA和颈环反转录引物RT-cid-miR-146a(表1),按照反转录试剂盒PrimeScript™RTreagent Kit with gDNA Eraser 说明书进行特异性反转录,制备颈环RT-PCR模板cDNA,保存于-80 ℃备用。

表1 引物序列Table 1 Primers used in this study
根据前期研究结果[19],采用颈环RT-PCR 扩增cid-miR-146a,所用引物cid-miR-146a-F 和cid-miR-146a-R 见表1。PCR 扩增体系为50 μL,包含EX-Taq 25 μL、cDNA 3 μL(质量浓度约为50 μg/mL)、cid-miR-146a-F 2 μL、cid-miR-146a-R 2 μL 和ddH2O 18 μL。PCR 反应条件为95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸60 s,循环40 次。然后用3%(质量体积比)琼脂糖凝胶电泳进行检测。颈环RT-PCR 扩增获得目的片段的长度为60 bp,包括上游序列4 bp(5′-GCGC-3′)、cid-miR-146a序列23 bp(5′-TGAGA ACTGAATTCCATAGATGG-3′)、颈环序列33 bp(5′-GTGCAGGGTCCGAGGTATTCGCACTGGATC GAC-3′)。将cid-miR-146a 插入至pMD18-T 载体,然后转化至DH5α,于37 ℃下进行培养。按蓝白斑筛选方法选取阳性菌落[1],并将阳性菌落送往上海生工生物技术有限公司进行测序。
1.5 定量PCR
收集LCDV-cn 感染GCO 细胞后0、4、8、16、24、48、72、144 和196 h 样品,然后制备cDNA(同前)用于定量PCR。所用引物cid-miR-146a-F、cid-miR-146a-R、U6F和U6R见表1,定量PCR总体积为10 μL,包含TB Green Premix Ex Taq II 5 μL、cDNA 1 μL、cid-miR-146a-F 1 μL、cid-miR-146a-R 1 μL 和ddH2O 2 μL。反应条件为95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火30 s,循环40次。
上调下调实验中,cid-miRNA-146a 在GCO 细胞的表达定量。上调下调实验包括4 组:上调组(转染cid-miR-146a mimics 模拟物,转染浓度为20 nnmol/L)、下调组(转染cid-miR-146a inhibitor 抑制物,转染浓度为20 nnmol/L)、阴性对照(NC组:转染NC,转染浓度为20 nnmol/L,)和阳性对照(LCDV-cn 正常感染组,无转染)。cid-miR-146a mimics、cid-miR-146a inhibitor 和NC的序列分别为5′-UGAGAACUGAAUUCCAUAGAUGG-3′、5′-CCAUCUAUGGAAUUCAGUUCUCA-3′和5′-UUGUACUACACAAAAGUACUG-3′,于上海生工生物技术有限公司合成。用不含抗生素的MEM(含体积分数10%FBS)培养GCO细胞,当GCO细胞于12~16 h 单层生长至70%~90%时,使用Lipo‐fectamineTMRNAiMAX 将cid-miR-146a mimics、cidmiR-146a inhibitor 和NC 分别转染至GCO 细胞,培养24 h后,用LCDV-cn进行感染,于20 ℃继续培养。然后,收集LCDV-cn 感染GCO 细胞0、4、8、16、24、48、72、144 和196 h 样品,制备cDNA 用于cid-miR‐NA-146a 的定量。定量PCR 所用引物、定量PCR 体系和反应条件同上述cid-miRNA-146a的表达定量。
cid-miRNA-146a 靶基因Flt1的表达定量。样品制备同上述上调下调实验。定量PCR 所用引物RT-Flt-F、RT-Flt-R、18s-F 和18s-R 见表1,定量PCR体系和反应条件同上述cid-miRNA-146a 的表达定量。
根区温度对嫁接黄瓜苗叶绿素荧光参数的影响…………………………… 刘念奇,宋 阳,孙世君,高 宇,吴佳旺,崔晓晗(118)
LCDV-cnmcp(主要衣壳蛋白,major capsid protein)的表达定量(代表LCDV-cn 的复制[7])。样品制备同上述上调下调实验。定量PCR 所用引物RT-LCDV-MCP-F、RT-LCDV-MCP-R、18s-F 和18s-R见表1,定量PCR 体系和反应条件同上述cid-miR-146a的表达定量。
1.6 统计分析
应用SPSS 24 软件,用2-ΔΔCt法[23]进行单因素方差分析,并统计差异显著与否(P<0.05或P<0.01)。
1.7 cid-miR-146a靶基因预测
应用RNAhybrid(https://bibiserv.cebitec.unibielefeld.de/rnahybrid/)、miRanda(http://www.microrna.org/)和TargetScan(http://www.targetscan.org/fish_62/)软件预测cid-miR-146a的靶基因。3 个软件预测到的共同靶基因作为靶向目标进行后续研究。
1.8 双荧光素酶系统验证cid-miR-146a的靶基因
应用RNA22 预测cid-miR-146a 靶基因的靶位点,根据靶位点设计扩增靶基因片段的引物为pmirGLO-Flt1-F和pmirGLO-Flt1-R(表1)。RT-PCR总体积为50 μL,包含ExTaq™酶25 μL、pmirGLOFlt1-F 2 μL、pmirGLO-Flt1-R 2 μL、cDNA 3 μL、ddH2O 18 μL。PCR 反应条件为95 ℃3 min;95 ℃30 s、55 ℃30 s、72 ℃1 min,35 个循环;最后72 ℃延伸5 min。将PCR 产物与pMD18-T 载体连接,进行亚克隆。通过菌落PCR(引物见表1)和测序进行验证。将验证正确的靶基因片段插入至双荧光素酶启动子pmirGLO 载体上,构建pmirGLO-Flt1 载体,并进行亚克隆。通过菌落PCR和测序进行验证。将正确构建的pmirGLO-Flt1载体分别与cid-miR-146a mimics、cid-miR-146a inhibitor 和NC 共转染至GCO细胞,于20 ℃培养48 h,检测各组细胞荧光素酶活性。
1.9 生物信息学方法预测cid-miR-146a调控LCDV-cn感染的信号通路
应 用GO(http://geneontology.org/)和KEGG(https://www.genome.jp/kegg/)数据库对cid-miR-146a可能参与的信号通路进行富集分析。
2 结果与分析
2.1 LCDV-cn感染GCO细胞的过程
LCDV-cn感染GCO细胞后,呈现的细胞病变效应(cytopathic effect,CPE)与文献[2]一致。LCDVcn 感染GCO 细胞后3 d,细胞聚集、呈现明显的“疤痕”现象,“疤痕”一直持续到约感染后6 d,6 d 之后细胞逐渐脱落、裂解,出现空洞(图1)。

图1 LCDV-cn感染GCO细胞Fig.1 GCO cells challenged with LCDV-cn
2.2 感染用LCDV-cn悬液电镜负染
LCDV-cn 以滴度浓度105.5TCID50/mL[19]进行后续感染实验,感染用病毒悬液进行电镜负染可看到病毒粒子(直径约110 nm)(图2)。
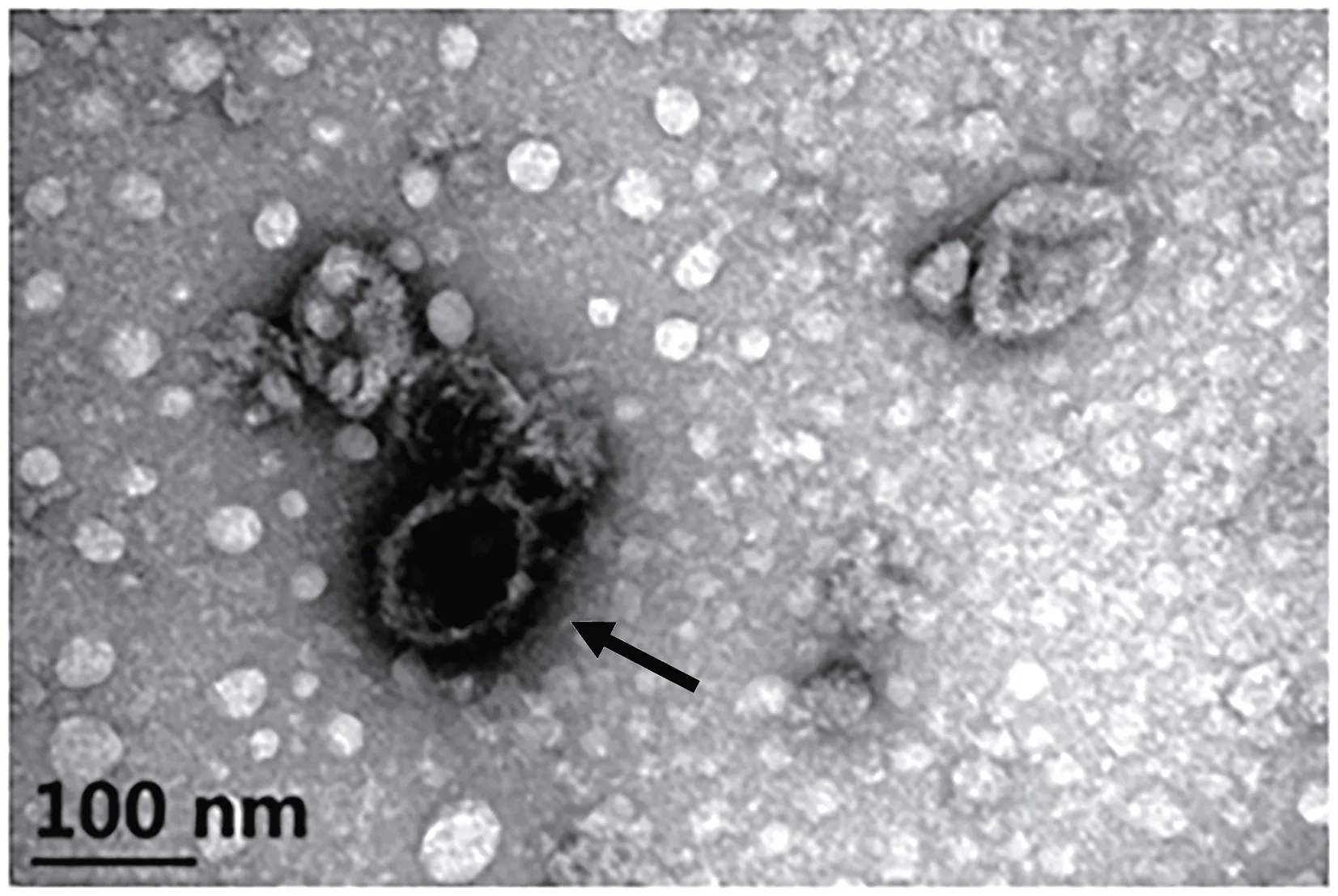
图2 感染用LCDV-cn悬液电镜负染Fig.2 Electron microscope of negative staining with LCDV-cn suspension for infection
2.3 cid-miR-146a的扩增
电泳结果表明28S、18S和5S rRNA条带完整清晰(图3),说明提取的样品总RNA 无降解,可用于后续实验。颈环RT-PCR 扩增后,电泳检测表明获得目的片段(图4(a))。经菌落PCR(图4(b))和测序验证获得的片段是正确的,即为cid-miR-146a。cidmiR-146a 的序列为5′-UGAGAACUGAAUUCCAU‐AGAUGG-3′(23 bp),经序列比对发现,cidmiR-146a与其他物种miR-146a同源(表2)。

表2 已知的miR-146a序列Table 2 Known miR-146a sequences

图3 提取的样品总RNAFig.3 Extracted total RNA of samples

图4 cid-miR-146a颈环RT-PCR和菌落PCRFig.4 Stem-loop RT-PCR and colony PCR of cid-miR-146a
2.4 cid-miR-146a 在LCDV-cn 感染GCO中的表达特性
依据LCDV-cn 感染GCO 细胞出现CPE 现象的变化特点,选取LCDV-cn 感染后0、4、8、16、24、48、72、144和196 h样品,进行差异表达分析。由图5可知,从0 到72 h,cid-miR-146a 的表达量逐渐增加,144和196 h时cid-miR-146a的表达量下降。

图5 cid-miR-146a在LCDV-cn感染GCO过程中的表达Fig.5 Expression of cid-miR-146a in GCO cells infected with LCDV-cn
2.5 cid-miR-146a靶基因的预测
RNAhybrid 预测到cid-miR-146a 的靶基因为Gimap8(GTP 酶免疫相关蛋白8,GTPase immuneassociated protein 8)、LEPR(瘦素受体,leptin receptor)、Flt1(Fms 相关酪氨酸激酶1,Fms-related tyrosine kinase 1)和DLGAP5(Discs 大同源相关蛋白5,Discs large homologous affinity protein 5),其总评分值分别为-0.41、-0.01、-0.32和-0.046(评分值为负数,靶基因的概率大)。miRanda 预测到cid-miR-146a 的靶基因为PDIA3(蛋白质二硫键异构酶A3,protein disulfide-isomerase A3)、irak1(细胞介素-1受体相关激酶-2)、LOX(赖氨酰氧化酶,lysyl oxidase)和Flt1(Fms 相关酪氨酸激酶1,Fms-related tyrosine kinase 1),其总评分值分别为-0.013、-0.046、-0.19和-0.31。TargetScan 预测到cid-miR-146a 的靶基因为DIO-1(碘代甲状腺氨酸脱碘酶1,iodothyronine deiodinase 1)、Flt1(Fms 相关酪氨酸激酶1,Fmsrelated tyrosine kinase 1)和Gimap8(GTP酶免疫相关蛋白8,GTPase immune-associated protein 8),其总评分值分别为-0.18、-0.32和-0.41。预测到的靶基因与癌症和肿瘤发生、抗原呈递和感染反应相关。
此3 个软件均预测到Flt1是cid-miR-146a 的靶基因,因此后续以Flt1为靶标开展实验。应用RNA22 预测到Flt1含有 结合cid-miRNA-146a 的位点(折叠能为-72.38 kJ/mol,P值为0.353),Flt1与cid-miRNA-146a 结 合 的 位 点 序 列 为:5′-UACA‐AAAGGGAGGUUCAGUUCUC-3′(图6),位于Flt1mRNA(GenBank 编码:XM_039667029)的280-302碱基(图6)。

图6 cid-miR-146a靶向Flt1基因的结合位点Fig.6 Binding sites of the gene Flt1 targeted with cid-miR-146a
2.6 cid-miR-146a的靶基因Flt1验证
选取含靶位点的Flt1片段,其长度为456 bp,位于Flt1mRNA 的249-704 碱基。经RT-PCR 扩增后将目的Flt1片段插入至pmirGLO 载体,菌落PCR、XhoⅠ和SalⅠ双酶切(图7)和测序结果说明目的片段是正确的,成功构建pmirGLO-Flt1,并应用双光素酶报告基因系统验证靶基因。双荧光素酶报告系统检测双荧光素酶的活性结果显示(图8):共转染cid-miR-146a mimics 和pmirGLO-Flt1 后,双荧光素酶活性显著下降,并与其它两组(共转染cid-miR-146a inhibitor 或NC)差异显著(P<0.05),表明Flt1确实是cid-miR-146a的靶基因。

图7 pmirGLO-Flt1双酶切Fig.7 Double enzyme digestion of pmirGLO-Flt1
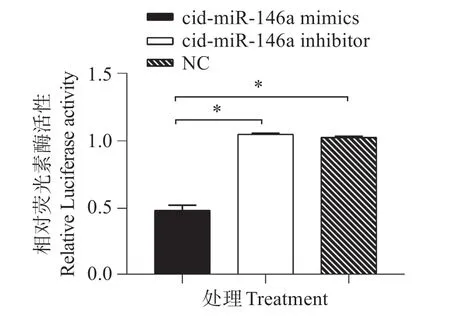
图8 双荧光素酶活性检测Fig.8 Detection of luciferase activity
2.7 cid-miR-146a在上调下调GCO细胞中的表达量
对cid-miR-146a 进行上调下调后,定量PCR 结果表明(图9):在cid-miR-146a 上调和下调的GCO细胞中,cid-miR-146a 的表达量与阳性对照组和阴性对照组中的表达量存在显著差异(P<0.05);cidmiR-146a 上调组中,cid-miR-146a 的表达量明显升高(P<0.05),而在cid-miR-146a 下调组中,cid-miR-146a 的表达量明显下降(P<0.05)。由此也说明转染cid-miR-146a mimics 和cid-miR-146a inhibitor 的浓度20 nnmol/L 是合适的,后续研究按此浓度20 nnmol/L进行。

图9 上调下调实验中cid-miRNA-146a在GCO细胞的表达Fig.9 Expression of cid-miRNA-146a in GCO cells for the up-down regulation experiment
2.8 cid-miR-146a对其靶基因Flt1的调控
对cid-miR-146a 进行上调下调后,靶基因Flt1定量PCR 结果表明(图10):在cid-miR-146a 上调组,Flt1的表达量最少,与其它组的表达量存在显著差异(P<0.05);在cid-miR-146a下调组,Flt1的表达量最多,与其它组的表达量存在显著差异(P<0.05);在阳性对照组,Flt1的表达量先下降然后上升,在72和144 h时最少。
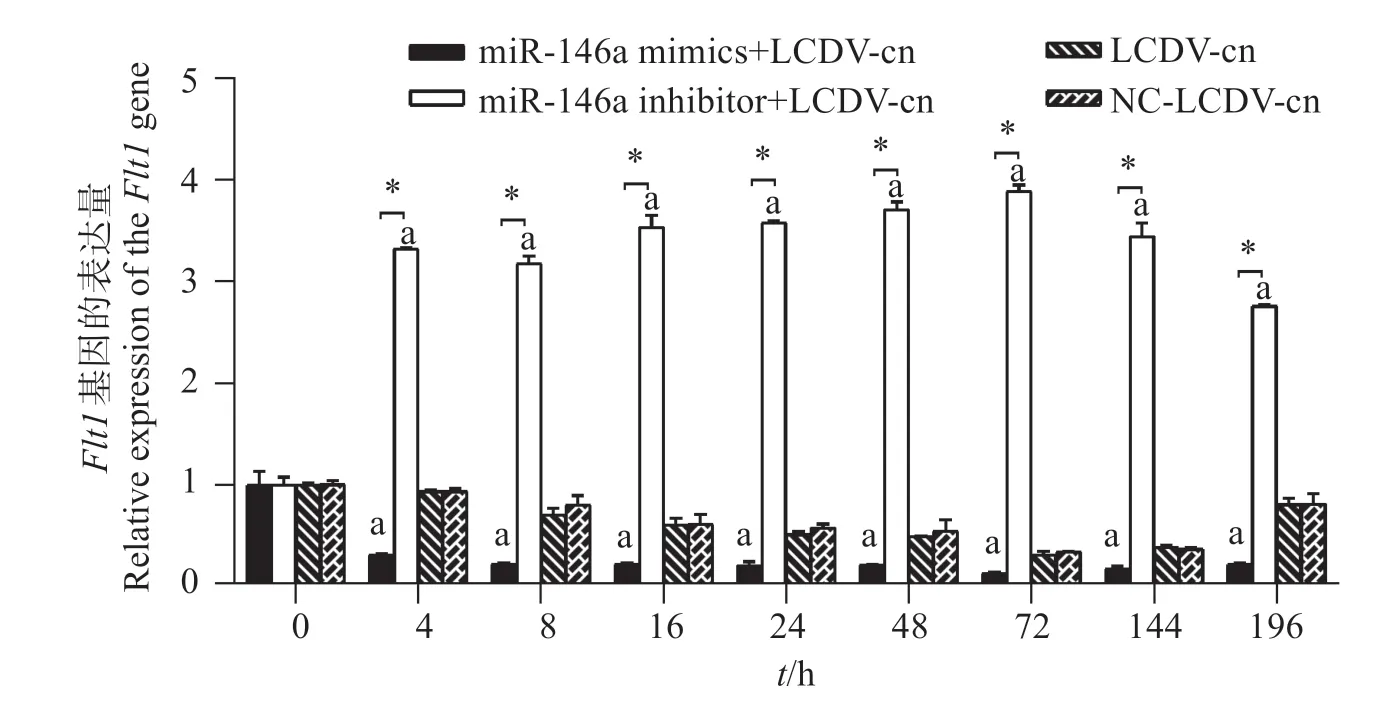
图10 GCO细胞中Flt1的表达Fig.10 Expression of the gene Flt1 in GCO cells
2.9 cid-miRNA-146a对LCDV-cn复制的调控
对cid-miR-146a 进行上调下调后,LCDV-cnmcp基因定量PCR 结果(mcp的表达代表LCDV-cn的复制)表明(图11):在cid-miR-146a 上调组,mcp基因的表达量最多,峰值在72 h,与其它组的表达量差异显著(P<0.05);在cid-miR-146a下调组,mcp基因的表达量最少,与其它组的表达量差异显著(P<0.05);在阳性对照组(LCDV-cn 正常感染),mcp基因的表达量先上升后下降,与上调组趋势一致,峰值在72 h。由此说明,cid-miR-146a 上调促进LCDV-cn 在GCO 细胞的复制,cid-miR-146a 下调后LCDV-cn在GCO细胞的复制降低。

图11 GCO细胞中mcp基因的表达Fig.11 Expression of the mcp gene in GCO cells
2.10 生物信息学预测cid-miR-146a 在LCDV-cn 感染过程中调控的信号通路
应用GO 和KEGG 预测到cid-miR-146a 调控的信号通路可能包括Toll样受体(Toll-like receptor)信号通路(P值为0.005 6)、NF-кB(nuclear factor κB)信号通路(P值为0.009 4)和ErbB(receptor tyrosine kinases)信号通路(P值为0.0266 7)等。Toll 样受体可识别病原体、快速激活先天免疫,NF-кB可调节涉及免疫、细胞存活等的基因,ErbB 可调控细胞增殖、分化和存活等(https://www.genome.jp/kegg/)。
3 讨论
miRNA 在病毒感染和肿瘤发生中起着重要的调控作用,miR-146a 作为不同生物中比较保守的miRNA,已成为抗病毒感染和抗肿瘤等研究的热点[9-18]。高通量测序表明在LCDV-cn感染GCO 过程中,cid-miR-146a 的表达存在显著差异[19],本研究以cid-miR-146a 为目标miRNA,探索cid-miR-146a 对其靶基因和LCDV-cn复制的调控作用。
LCDV-cn 感染GCO 后的CPE 现象呈现出“疤痕”和空洞,与Zhang等[2]的研究一致。在本研究中,LCDV-cn 感染GCO 后CPE 现象的变化与cid-miR-146a的表达变化时间点呈正相关:在LCDV-cn 感染GCO 后,细胞聚集“疤痕”形成的过程(图2),cidmiR-146a 的表达一直上调(图4);细胞脱落、裂解、“疤痕”消失的过程(图2),cid-miR-146a的表达下调(图4)。总之,在LCDV-cn 感染GCO 细胞过程中,cid-miR-146a的表达先上升(3 d前)后下降(6 d后)。在病毒感染的不同时期,cid-miR-146a 呈先上调后下调的表达模式,这在其它病毒感染中也得以发现,如,在HPV感染中,在感染的起始阶段miR-146a表达上调,在感染后期miR-146a表达下调[13]。
本研究表明cid-miR-146a靶向Fms相关酪氨酸激酶1 (FLT1)的编码区而发挥其调控作用。FLT1是血管内皮生长因子(VEGF)受体之一,Flt1广泛表达于肿瘤细胞,与血管生成和肿瘤发生相关[24]。在本研究中,LCDV-cn 感染后引起的淋巴囊肿病是一种皮肤瘤(可自愈),在较大的囊肿上有肉眼可见的红色血管[25],说明在LCDV-cn 引起的皮肤瘤发展过程中确实存在着血管生成。研究表明在多种肿瘤中Flt1的表达异常,如,在神经胶质瘤中Flt1的表达高度上调[24]、在头颈鳞状上皮细胞癌中Flt1选择性上调表达[26]等。本研究发现在LCDV-cn 感染GCO细胞过程中,cid-miR-146a 对其靶基因Flt1的表达起着负调控作用(图10),与HPV 感染中miR-146a的调控相似。在HPV 感染引起的肿瘤中,miR-146a靶向调控表皮生长因子受体(EGFR),且miR-146a负调控EGFR的表达[27]。在其它一些肿瘤研究中,也发现了miRNA 对Flt1的负调控作用,如,miR-139-5p 靶向Flt1抑制Flt1的表达,从而调控人类神经胶质瘤的发展[24]。此外,研究发现降低或抑制Flt1的表达可控制肿瘤的发展等:乳腺癌中Flt1的抑制可以降低肿瘤转移效率[28],敲降Flt1的表达可以阻止胶质瘤细胞的传播[29],在绒膜癌细胞中Flt1基因是特定类型细胞肿瘤的抑制剂[30]。而且,血管生成对肿瘤发展来说是必不可少的,FLT1是血管生成和肿瘤发生的主要调控因子之一[24,31],因此,Flt1已成为一种新型潜在的肿瘤治疗靶点[28-29]。虽然本研究表明cid-miR-146a对Flt1的表达起着负调控作用,但其对LCDV-cn感染的调控机制有待深入研究。
本研究结果进一步表明LCDV-cn的复制与cidmiR-146a 的表达呈正相关(图11),随着cid-miR-146a 的上调下调而变化。在其它病毒感染中,也发现miR-146a的表达与病毒复制呈正相关,并促进病毒复制。如,miR-146a 促进HBV 的复制,可提高HBV 引起肝癌的风险[32-33]。此外,目前研究表明在病毒感染中,miR-146a 调控免疫相关等信号通路,从而调控病毒的复制。如,在流感病毒H1N1 和H3N2 感染中,miR-146a 参与的信号通路包括Toll样受体信号通路、先天免疫反应、细胞因子的产生和凋亡[34];在EBV 感染过程中,miR-146a 参与淋巴细胞信号通路和干扰素信号通路等[35]。本研究应用生物信息学方法预测到cid-miR-146a可能参与调控Toll 样受体信号转导通路、NF-кB 信号通路和ErbB信号通路,这些信号通路与免疫和肿瘤发生相关。因此,推测cid-miR-146a 调控的LCDV-cn 致病机制可能涉及与宿主免疫因子的互作、肿瘤发生发展等,cid-miR-146a 对LCDV-cn 感染的调控机制还有待深入研究。本研究还发现Flt1的表达与LCDVcn 的复制呈负相关,但Flt1对LCDV-cn 复制的调控机制有待解析。

