槲皮素对杂交石斑鱼生长性能、抗氧化能力和肠道菌群的影响
罗 君,付伟杰,杨二军,黄建盛,2,谢瑞涛,陈 刚,2
(1.广东海洋大学水产学院,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3.广东恒兴饲料实业股份有限公司,广东 湛江 524022)
杂交石斑鱼(Epinephelus fuscoguttatus♀×Epi‐nephelus polyphekadion♂)是褐点石斑鱼(Epinephelus fuscoguttatus)和清水石斑鱼(Epinephelus polyphek‐adion)的杂交子一代,市场价值较高,已在中国广东、海南等地广泛养殖[1]。然而,水产病害频发,严重危害了石斑鱼养殖产业的健康持续发展[2]。用于水产病害防治的抗生素类药物易导致耐药菌产生和抗生素残留,甚至危害人类健康,因此,学界致力于寻求抗生素替代品[3]。黄酮类化合物有提高养殖鱼类抗病性和抗逆能力的作用,可提高水产动物生长性能和免疫能力,调节肠道微生物群组成[4-5],是有效且环保的抗生素替代品[6-7]。槲皮素(3,3′,4′,5,7-五羟基黄酮,C15H10O7;QE)是植物中广泛存在的黄酮类化合物,有抗氧化、抗炎、抗癌、抗菌和抗病毒等生物学功能[8],对虹鳟(Oncorhynchus mykiss)[9]、斑马鱼(Danio rerio)[10]、克琳雷氏鲇(Rhamdia quel‐en)[11]、金头鲷(Sparus aurataL.)[12]、牙鲆(Paralich‐thys olivaceus)[13]和 草 鱼(Ctenopharyngodon idel‐la)[14]等生长和免疫有有益作用。然而,QE 的副作用亦有报道,如QE 可转化为有细胞毒性的邻半醌和邻醌活性氧化产物[15];QE可增加斑马鱼大脑中炎症介质和细胞因子水平,表现出促炎活性[10]。QE的有益或有害作用可能涉及各种机制。为进一步了解QE 对海洋鱼类生长和免疫的影响,本研究分析饲料中QE 对杂交石斑鱼(E.fuscoguttatus♀×E.polyphekadion♂)生长、免疫和肠道健康的影响,为QE在石斑鱼饲料中的应用提供基础数据。
1 材料和方法
1.1 实验材料
槲皮素(二水合物,质量分数97%)购自上海麦克林生化有限公司。
1.2 实验设计
杂交石斑鱼饲料营养需求参考文献[16-17],基础饲料组成及营养水平见表1。QE 添加量参考文献[18-19],分别在基础饲料中添加0、0.80、1.60、3.20 mmol/kg QE(表2)。将所有原料粉碎,过孔径250 μm筛,用F-26型双螺杆挤条机(华南理工大学)制备粒径4.0 mm 的颗粒饲料,阴凉处风干,于-20 ℃保存备用。

表1 基础饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diets %

表2 基础饲料中不同水平QE的添加量Table 2 Different levels of QE supplementation in the basal diets
1.3 实验用鱼与饲养管理
实验鱼为广东海洋大学湛江海洋高新科技园养殖所培育的杂交石斑鱼子一代幼鱼,选取健康幼鱼运至广东恒兴饲料实业股份有限公司863养殖基地。以基础饲料暂养2 周。停饲24 h,取体质量(10.10±0.02)g 的幼鱼300 尾,随机放入12 个0.5 m3圆柱形玻璃钢养殖桶(25 尾/桶)。一共设4 个处理,每处理3 个重复。每日08:00、17:00 按照体质量5%~8%饱食投喂。各处理组间饲养管理措施相同。实验期间,每日记录死亡率、体质量及饲料投喂量。水温25~29 °C,pH 7.5~8.0,盐度28.0~32.0,溶氧6~8 mg/L,氨氮0.03±0.01 mg/L。
1.4 样品采集
饲养实验结束后停饲24 h。每个养殖桶随机取鱼9 尾,经MS-222 麻醉,3 尾鱼剖取长度1 cm 的后肠(距肛门2 cm处)用于基因表达分析,取肝脏用于抗氧化酶活测定;6 尾鱼在无菌条件下剖取全肠,去肠道外脂肪组织,3 尾鱼全肠用于肠道菌群分析,3尾鱼全肠于抗氧化酶活测定。所取组织用液氮速冻后于-80 ℃保存备用。
1.5 生长指标分析
实验8 周后,分别统计增重率(weight gain rate,WGR,%)、特定增长率(specific growth rate,SGR,%/d)、存活率(survival rate,SR,%)和饲料系数(feed coefficient rate,FCR):
WGR=(终末总体质量-初始总体质量)/初始总体质量;
SGR=(ln 终末总体质量-ln 初始总体质量)/饲养时间;
SR=终末数量/初始数量;
FCR=摄食饲料干质量/(终末总体质量+死亡个体总体质量-初始体质量)。
1.6 肝脏及肠道抗氧化能力测定
肝脏和肠道组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT)和丙二醛(MDA)水平测定按照南京建成生物工程研究所试剂盒说明书进行。
1.7 实时定量PCR检测
采 用TransZol UP Plus RNA Kit(Transgen Biotech,北京)从杂交石斑鱼后肠中提取总RNA,TranScript cDNA Synthesis SuperMix 试剂盒(Transgen Biotech,北京)合成第1 链cDNA。用Primer 5.0软件设计各基因的上、下游引物序列并由上海生工生物股份有限公司合成;所有引物经过验证后用于后续正式实验。所有引物序列如表3 所示,以β-actin为内参基因。

表3 实时荧光定量PCR引物序列Table 3 Sequences of primers for quantitative real-time PCR
使用荧光定量试剂盒(PerfectStart Green qPCR Su-perMix,Transgen Biotech,北京)在Roche LightCycler®96 SW1.1 平台上进行检测。10 μL 反应体系包括5 μL SYBR Green Supermix,上下游引物各0.5 μL,3.5 μL ddH2O 和0.5 μL cDNA。以溶解曲线验证引物特异性。PCR 扩增程序:94 ℃30 s;94 ℃5 s,58 ℃15 s,72 ℃10 s,循环40 次。每个样本重复验证3次。按照2–ΔΔCt方法计算相对表达量。
1.8 肠道菌群
使用DNA 提取试剂盒(MN NucleoSpin 96 Soi)提取微生物DNA;通用引物对(正向引物338F:5′-ACTCCTACGGGAGGCGCAGCA-3′;反向引物806R:5′-GGACTACHVGGGTWTCTAAT-3′)PCR扩增各样品16S rRNA 基因的V3‒V4 区序列。使用百迈客(北京)的Illumina Hiseq 2500 平台对纯化的样品进行高通量测序分析。
使用FLASH 软件(version 1.2.11)对原始数据进行拼接,Trimmomatic 软件(version 0.33)将拼接的序列进行质量过滤,UCHIME 软件(version 8.1)鉴定并去除嵌合体,成一条标签(tags)。使用USE‐ARCH(version 10.0)在相似性97%的水平上对tags进行聚类,获得运算分类单位(OTU)。基于百迈客云平台进行微生物多样性分析,得到α 多样性指数(Ace、Chao1、Shannon、Simpson)、β 多样性、物种注释及分类学分析结果。
1.9 统计分析
使用SPSS 22.0 对实验数据进行单因素方差分析(one-way ANOVA),采用Duncan 法进行多重比较。存活率数据则先进行平方根反正弦转换再进行统计分析。实验结果以平均值±标准误(mean±SE)表示,P<0.05时差异显著。
2 结果
2.1 QE对杂交石斑鱼生长性能的影响
从表4 可知,与FM 组比较,QEH 组终末体质量、增重率和特定增长率显著提高(P<0.05);QE 添加存活率显著降低,QEM 和QEH 组间存活率无显著差异(P<0.05)。

表4 QE对杂交石斑鱼生长性能的影响Table 4 Effect of QE on growth performance of hybrid grouper
2.2 抗氧化活性
表5 表明,与FM 组相比,QEM 组肝脏SOD 和GPX 活性显著提高(P<0.05),QEH 组肝脏GPX 和CAT活性显著提高(P<0.05)。FM 与QE组MDA水平无显著差异(P>0.05)。所有处理组肠道SOD、GPX、CAT和MDA参数均无显著差异(P>0.05)。

表5 QE对杂交石斑鱼肝脏及肠道抗氧化指标的影响Table 5 Effects of QE on the antioxidant indexes of liver and intestine of hybrid grouper
2.3 肠道中相关基因的表达
图1显示各处理组杂交石斑鱼肠道NF-κB 信号通路相关基因的表达水平。与FM 组相比,QE 组TRAF-2、TNFRSF1A和IFN-γ表达量显著上调(P<0.05),IκB-α表达量显著下调(P<0.05)。此外,与FM 组相比,QEL 和QEH 组TNF-α表达量显著上调(P<0.05),QEM 和QEH 组NF-κBp65表达量显著上调(P<0.05)。

图1 QE对杂交石斑鱼后肠NF-κB信号通路相关基因表达水平的影响Fig.1 Effects of QE on the expression levels of genes related to the NF-κB signaling pathway in the hindgut of hybrid grouper
2.4 饲料中添加QE对杂交石斑鱼肠道菌群的影响
2.4.1 肠道菌群多样性 杂交石斑鱼肠道微生物的16S rRNA高通量测序分析得知,样品的平均干净读数为79 384,平均有效读数为73 989。图2表明,4组共享的OTU 数目为598;FM 组中特有OTU 最多,为149,QSM 组中特有OTU 数量最少,为73。表明QE添加使杂交石斑鱼肠道微生物群落数量显著降低。

图2 OTU比较韦恩图Fig.2 Venn diagram of OTU comparison
Alpha 多样性指数分析中,所有样本的Good’s覆盖率均高于99.6%,表明数据涵盖了大多数细菌物种。表6 表明,与FM 组相比,QEM 和QEH 组的OTU数目显著下降(P<0.05),ACE、Chao1、Simpson、Shannon 指数无显著差异(P>0.05)。偏最小二乘判别分析法分析的Beta 多样性结果显示(图3),FM、QEL和QEH组间存在显著差异(P<0.05)。
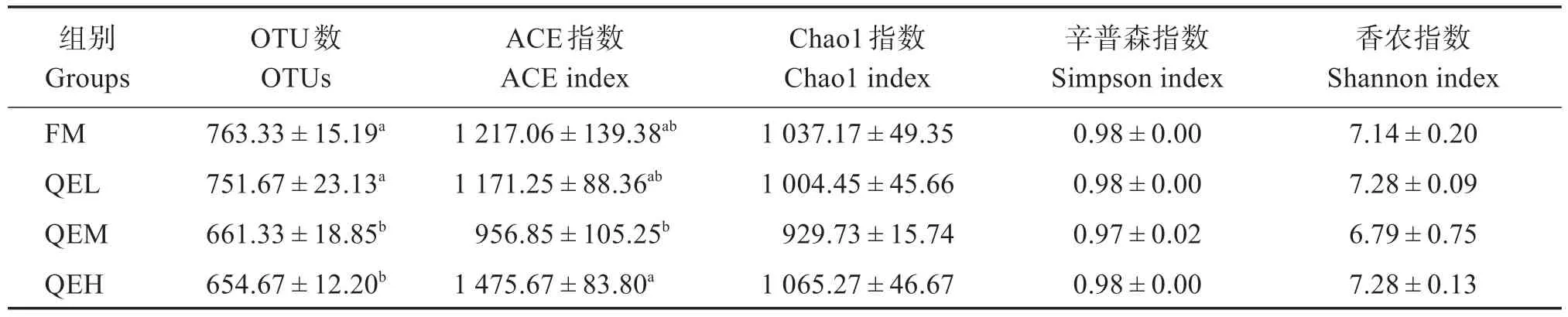
表6 QE对杂交石斑鱼肠道菌群的α多样性指数的影响Table 6 Effects of QE on the alpha diversity index of the intestinal microflora of hybrid grouper

图3 杂交石斑鱼肠道微生物的β多样性指数Fig.3 β diversity index of hybrid grouper gut microbes
2.4.2 肠道菌群组成 图4(A)显示,在门水平上,4组中相对丰度大于5%的门共有5个,分别为厚壁菌门(Firmicutes,23.86%~37.04%)、变形菌门(Proteo‐bacteria,19.09%~29.56%)、拟杆菌门(Bacteroidetes,8.37%~15.95%)、放线菌门(Actinobacteria,8.71%~21.67%)和疣微菌门(Verrucomicrobia,5.26%~8.05%)。方差分析显示,与FM 组相比,QEM 拟杆菌门显著降低(13.92%vs.8.37%,P<0.05),放线菌门显著提高(8.71%vs.21.67%,P<0.05)。
除属水平上未命名的菌群外,丰度比例高于0.1%的前10个属(图4(B))包括艾克曼菌属(Akkermansia,3.67%~7.74%)、双歧杆菌属(Bifidobacterium,1.42%~17.25%)、拟杆菌属(Bacteroides,2.76%~6.00%)和脱硫弧菌属(Desulfovibrio,1.23%~3.83%)。方差分析显示,与FM 组相比,QSM 组双歧杆菌属显著增加(1.42% vs.17.25%,P<0.05),拟杆菌属显著降低(2.76%vs.4.96%,P<0.05)。

图4 饲喂不同QE水平的4组鱼在门和属水平上的物种相对丰度Fig.4 Relative abundance of species at phylum and genus levels among the four groups of fish fed with different QE levels
3 讨论
3.1 QE对杂交石斑鱼生长性能的影响
黄酮类化合物是药用植物最有效的成分之一,可提高鱼类的生长速度、增强机体的免疫力[4,20]。投喂含不同质量分数(200、400、800 和1 600 mg/kg)QE 饲料的罗非鱼(Oreochromis niloticus)特定增长率有所提高,且高剂量组更有效[19]。饲喂补充质量分数0.25%或0.50%的QE 饲料的牙鲆增重率显著提高,饲喂60 d比30 d 效果更佳[13,21],表明长期摄入QE 可显著提高QE 的生物利用度。本研究中,饲料中添加3.2 mmol/L的QE显著提高了杂交石斑鱼的FW、WGR 和SGR,与上述研究结果一致。目前,QE 对养殖动物的促生长机制尚不清楚,不同物种QE 最适添加范围不同。研究发现,QE 在体内发挥作用的能力取决于机体摄入后的吸收程度及其在机体各组织中的分布[22]。在罗非鱼中,QE 被吸收后主要以苷元形式沉积在体内[23]。此外,动物模型研究表明,肠道是QE 吸收的主要场所[24]。QE 及其衍生物在消化系统中发生多种生化反应,在小肠中,QE可被微生物群转化,随后通过肝门静脉输送到肝脏,在肝脏中形成硫酸盐或葡萄糖苷酸[8]。QE 及其衍生物的存在形式在促进生长中可能发挥重要作用。本研究中,QEH 组的WGR 比QEM 组显著增加,但SR 一致,表明WGR 增加可能与存活率无关。综上,一方面QE 的潜在毒性可能使杂交石斑鱼的存活率下降[15];另一方面QE 也随着剂量增加也表现出促生长作用。但由于研究对象、饲养条件和使用剂量不尽相同,QE 促生长和潜在毒性的具体机制仍需进一步研究。
3.2 QE对杂交石斑鱼抗氧化能力的影响
QE 可清除自由基和活性氧物质并与金属离子形成络合物,阻碍金属氧化产生活性氧物质[25]。因此,QE 可能通过减少杂交石斑鱼的氧化损伤对机体免疫力发挥积极作用。作为机体中重要的抗氧化酶,SOD 催化O2-转化为O2和H2O2,CAT 和GPX进一步将H2O2分解为O2和H2O 以去除过多的自由基[26]。MDA是脂质过氧化作用的产物,其含量间接反映了机体中活性氧自由基的含量以及组织细胞中脂质过氧化作用的程度[27]。本研究中,QEM 和QEH 组显著提高杂交石斑鱼肝脏中SOD、GPX 和CAT的活性。QE可显著提高斑马鱼[28]、克琳雷氏鲇(R.quelen)[29]肝脏SOD、CAT 和GPX 活性,降低克琳雷氏鲇脂质过氧化,与本研究结果一致。研究发现,QE 可有效抵抗结肠上皮中脂肪酸氢过氧化物(LOOH)等营养因素诱导的氧化应激损伤,但可能无法防止内源性H2O2的形成;在无外源压力情况下QE 对机体几乎无保护能力,甚至会引起组织损伤[30]。此外,过量的QE 可能会被氧化形成QE-苯醌,产生遗传毒性,从而降低机体的抗氧化能力[31]。本研究中,QE 对肠道抗氧化指标无显著影响,GPX和CAT 活性随QE 添加剂量的增加有潜在的下降趋势,推测高剂量使用QE会造成肠道氧化损伤。
3.3 QE对肠道NF-κB信号通路的影响
过量的活性氧(ROS)会对组织和细胞造成氧化损伤,而适量的炎症因子参与损伤组织再生,可修复和愈合伤口[32-33]。NF-κB 通路在促炎基因表达中起主要作用[34]。本研究中,石斑鱼肠道抗氧化水平有潜在下降趋势,这可能会导致肠道NF-κB 信号通路的激活[34-35],因此检测了NF-κB 通路相关基因在肠道中的表达。结果表明,杂交石斑鱼肠道NF-κB信号通路被激活,TNF-α在QE 添加组中显著上调,QEH 组差异最显著。在肉鸡(Gallus domestiaus)脾脏[36]中亦有类似现象。QE 可能通过增加肠道中ROS 含量直接或间接激活了NF-κB 信号通路[35]。TNF-α是早期炎症发生过程中的重要成分。目前已证明草本饲料添加剂对鱼类炎症基因的表达有促进作用,可上调TNF-α基因在鱼肠道中的表达[37-38]。据此推测,QE 可能作为介质参与了炎症反应。草本饲料添加剂与鱼类炎症反应间的联系仍需进一步研究。
3.4 QE对杂交石斑鱼肠道菌群的影响
肠道是鱼类的消化和免疫器官,肠道菌群在维持宿主肠道功能,促进营养物质吸收、代谢,调节机体免疫功能等方面有重要作用[39]。在人类肠道中,微生物参与黄酮类化合物的转化[40],因此,QE 可能会改变肠道菌群的组成。本研究中,杂交石斑鱼肠道菌群在门水平主要为厚壁菌门、变形菌门、拟杆菌门、放线菌门和疣微菌门,与He 等[41]的珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceolatus♂)肠道优势菌群研究结果一致。这些菌群通常是杂交石斑鱼的肠道核心菌群。研究发现,厚壁菌门、变形菌门、拟杆菌门在海洋和淡水鱼类肠道微生物群中占90%[42-43],在宿主肠道的营养吸收和免疫反应中发挥重要作用。因此,QE 未改变杂交石斑鱼肠道核心菌群组成。
通常,肠道菌群的多样性越高,微生态系统越稳定,肠道菌群多样性降低可能导致细菌群落功能稳定性降低,增加机体患病风险[44]。在对虾(Lito‐penaeus vannamei)的研究中发现,疾病会导致其肠道菌群组成显著改变[45]。本研究中,与FM 组相比,QEM 和QEH 组的OTU 数目显著下降,这可能会影响杂交石斑鱼的肠道健康状况。肠道微生物有塑造炎症微环境的潜力,炎症可能会影响微生物的组成[46]。研究发现,益生菌补充剂通过抑制NFκB 的激活改善肠道微生物紊乱[47]。这意味着肠道微生物失衡可能激活NF-κB。本研究中,TNF-α表达水平在FM 与QEM 组间无显著差异;QEM 组拟杆菌门菌群的相对丰度显著降低,放线菌门占比显著增加。放线菌门细菌可产生丰富的生物活性物质,其代谢的活性物质具有抗菌、抗肿瘤、抗病毒等活性,放线菌门还有调节肠道菌群的平衡和缓解肠道炎症反应的作用[48],此外,肠道炎症常伴随着拟杆菌门相对丰度下降[49]。因此,QE 可能通过调节拟杆菌门和放线菌门菌群的占比,对NF-κB 通路的激活产生影响。变形菌门细菌包括许多病原菌,肠道微生态失衡的过程中常伴随着变形菌门的增加[50]。本研究中,变形菌门在QEL 和QEH 组中占比增加,TNF-α 表达显著上调,推测变形菌门可能参与了对NF-κB 通路的调控。在属水平上,QEM 组双歧杆菌属占比显著增加。研究证实,双歧杆菌CCFM683 显著降低炎性因子的表达来缓解DSS 诱导的小鼠结肠炎[51]。同时,灭活双歧杆菌可诱导巨噬细胞分泌抗炎因子[52]。与FM 组相比,在QEL 和QEH 组中,脱硫弧菌属和艾克曼菌属占比增加。脱硫弧菌属会破坏肠黏膜上皮细胞,损伤肠黏膜的屏障功能[53]。艾克曼菌属定殖丰度过高的小鼠更易导致过敏性腹泻[54]。可见,QE 可通过调节肠道菌群结构,具有塑造肠道炎症微环境的潜力。
4 结论
1)本实验范围内,饲料中添加0.8~3.2 mmol/kg QE 可降低杂交石斑鱼存活率,提高肝脏抗氧化能力。
2)QE 可激活肠道中NF-κB 信号通路,降低肠道微生物多样性,有肠道促炎活性。

