一株微藻附生菌的分离鉴定及藻菌体系的氮吸收特性
陈永志,黄翔鹄,朱春华,莫 峰,温其交,张玉蕾
(1.广东海洋大学水产学院,广东 湛江 524088;2.廉江市养虾集团有限公司,广东 湛江 524499)
水产养殖水体往往残留大量的氮,主要以氨氮(NH4+-N)、亚硝酸盐氮(NO2–-N)、硝酸盐氮(NO3–-N)和有机氮的形式存在[1]。微藻在利用CO2进行光合作用的同时可从环境中吸收利用N、P 等物质[2],对水质有一定调控作用。藻细胞生存环境中存在大量微生物,藻菌相互作用形成藻际环境:藻光合作用可向环境释放碳源等有机物,细菌吸收这些物质进行自身生长繁殖,产生的无机盐等物质释放到环境中又可被藻吸收利用[3-5],微藻为细菌提供可附着栖息地,并通过释放胞外产物促进细菌生长,确保细菌的生长环境有利且稳定;细菌对氧气的消耗可缓解氧气对微藻的抑制作用,增强藻类生命活动,促进对水环境中氮磷等营养盐的吸收[6-8]。由微藻与细菌组成的体系可更有效吸收水中的氮、磷等污染物,比单一微藻在水环境调控方面效果更佳[9],有效率高、成本低、二次污染小的特点,有较好的应用前景。利用小球藻(Chlorellasp.)、隐藻(Cryp‐tophytasp.)与污水细菌的藻菌体系比纯藻体系对氮磷去除效果更佳,藻生物量更大[10];在高温、高盐和强光环境中,侧孢短芽孢杆菌(Brevibacillus lat‐erosporus)和威氏海链藻(Thalassiosira weissflogii)构建的藻菌体系可有效吸收对虾池塘中过量的氨氮[11];固定化的蛋白核小球藻(Chlorella pyre‐noidosa)和光合细菌对PO43–-P 和NH4+-N 的去处效果显著高于二者单独培养体系[12]。但是,Kato 等[13]从沿海海水分离的一株单胞菌会分泌物质抑制骨条藻(Skeletonemasp.)的生长;当某些细菌增多时,会与藻类在营养物质上形成竞争[14]。因此,利用藻菌互利共生关系,构建合理并有特定功能的藻菌体系,是生物法调控养殖水环境的一个重要环节。波吉卵囊藻(Oocystis borgei)是广泛分布于对虾养殖池塘、河口等水域的绿藻,有广温广盐性,其种群增长稳定,在对虾养殖池塘的中后期可成为优势种,能稳定池塘水质,已广泛应用于对虾养殖水环境调控[15-16]。本研究拟从波吉卵囊藻藻际环境中分离、鉴定附生细菌,构建分离细菌与波吉卵囊藻的藻菌体系,研究该体系的氮吸收特性,为藻菌体系在水生态环境调控上的应用研究提供基础。
1 材料与方法
1.1 材料
波吉卵囊藻由广东海洋大学藻类资源开发与养殖环境生态修复实验室提供,培养于改良的f/2海水培养基;使用2216E 固体培养基进行菌株分离纯化和菌落形态观察,使用2216E 液体培养基进行菌株的活化及培养。
收集培养7 d 的波吉卵囊藻藻细胞,用无菌海水适当稀释,采用涂布平板法将藻液接种于2216E固体培养基,于恒温培养箱中30 ℃无光倒置培养,挑出优势单菌落培养,经多次平板划线纯化,获得菌株OA-1。
1.2 菌株OA-1的生长及鉴定
1.2.1 菌落形态观察、生长曲线 将菌株OA-1 划线接种于2216E固体培养基,于30 ℃恒温培养箱培养1~2 d,观察菌落形态。该菌株接种于2216E 液体培养基,于30 ℃摇床培养,每3 h 取样测定600 nm 处的光密度值D,直至进入衰亡期,绘制生长曲线。
1.2.2 菌株OA-1 的生化鉴定 根据杭州微生物试剂有限公司的细菌微量生化反应管说明书进行,包括革兰染色、尿素、甘露糖、ONPG(β-半乳糖)、蔗糖、水杨酸、山梨醇、山梨糖、葡萄糖胺、半乳糖、葡萄糖、木糖、乳糖、丙二酸盐、七叶苷、硝酸盐还原、接触酶、MR-VP试验。
1.2.3 16S rDNA鉴定及系统发育分析 取对数生长期的菌液,离心,用细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取基因组DNA,用细菌通用引物(27F 和1492R)扩增OA-1 的16S rDNA 基因。PCR 产物送至广州生物工程股份有限公司测序,将测序结果在NCBI 上进行BLAST 同源性比对,选取相似度较高的基因序列,用MEGA10.0的邻近法构建OA-1 系统发育树,Bootstraps 重复检验1000次,将OA-1鉴定至种。
1.3 菌株OA-1与波吉卵囊藻藻菌体系的氮吸收特性分析
1.3.1 藻菌体系对微藻生长的影响 设置纯藻对照组和藻菌联合组,检测各组叶绿素a 含量变化。培养体系为200 mL,对照组接入初始藻细胞密度为106mL-1的波吉卵囊藻,藻菌联合组按藻菌比例1∶1(藻细胞密浓度为106mL-1,细菌浓度为106cfu·mL-1)接入波吉卵囊藻和所分离细菌[17],连续培养10 d,每2 d 测定各组的叶绿素含量。采用体积分数95%乙醇萃取藻细胞中的色素,取5 mL藻液,以5 000 r/min离心10 min,弃上清,加入5 mL 体积分数95%乙醇重悬,于黑暗环境常温萃取24 h,离心,以体积分数95%乙醇为参比,使用分光光度计测定萃取液上清在波长630、647 和664 nm 处的光密度(D),计算藻细胞叶绿素a含量[18]:

1.3.2 不同氮源条件下藻菌体系的氮吸收速率 配制盐度为30的人工海水[19。以f/2培养基为基础,配制无氮海水培养基。实验前将波吉卵囊藻和OA-1用无氮培养基进行氮饥饿处理24 h。实验设置藻菌体系、纯藻体系和纯菌体系,分别以硝酸钠、亚硝酸钠、氯化铵和尿素为氮源,参照f/2 培养基的氮浓度设置(氮元素起始浓度为0.88 mmol/L),共12 个处理组,每组设置3 个重复。将饥饿处理后的微藻和细菌按106mL-1或cfu/mL 分别接入纯藻体系组和纯菌体系组,藻菌体系按照藻菌1∶1构建,培养水体为100 mL 的f/2 海水培养基,置于光照培养箱中恒温恒光(25 ℃,2 000 lx)培养4 h[20]。培养结束后将培养液过0.22 μm 滤膜,用Multi N/C 2100 测定滤液中的氮浓度。氮吸收速率计算公式[21]:
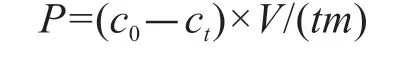
式中,P为氮吸收速率(μmol·h-1·g-1),c0、ct分别为实验前后水体中氮营养盐浓度(μmol/L),V为水体体积(L),m为生物的干质量(g),t为时间(h)。
1.3.3 不同氮浓度条件下藻菌体系的氮吸收速率在f/2 无氮海水培养基(同1.3.2)中分别以硝酸钠、亚硝酸钠、氯化铵和尿素为氮源,配制初始氮浓度为1、3、5、7 mmol/L 的四种培养基。氮饥饿处理同1.4.2,将饥饿处理后的微藻和细菌按106mL-1或cfu/mL 接入100 mL 上述不同氮浓度的培养基中,构建1∶1 藻菌体系,置于光照培养箱中恒温恒光(25 ℃,2 000 lx)培养4 h,每组设置3 个重复。氮吸收速率测定及计算同1.3.2。
2 结果
2.1 菌株OA-1的形态和生长特征
菌株OA-1 橘红色,圆形,隆起,边缘整齐,略透明,表面光滑,湿润;随着培养时间的延长,菌落颜色逐渐加深(图1)。OA-1 的生长曲线见图2,在0~3 h处于延滞期,3~18 h处于指数生长期,18 h后达到稳定期,33 h时进入衰亡期。

图1 OA-1菌株的菌落形态Fig.1 Colony morphology of OA-1 strain
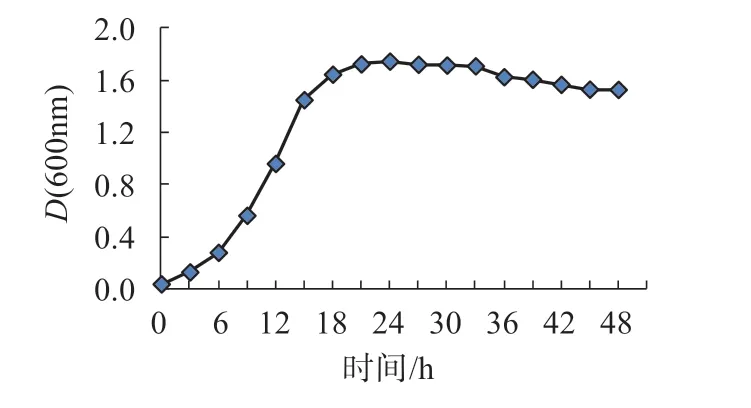
图2 菌株OA-1的生长曲线Fig.2 Growth curve of strain OA-I
2.2 菌株0A-1的生理生化特性
OA-1的生理生化鉴定结果如表1所示。该菌革兰染色呈阴性,尿素、ONPG、蔗糖、葡萄糖、葡萄糖胺、硝酸盐还原和MR-VP反应阳性,甘露糖、半乳糖、木糖、乳糖、丙二酸盐、水杨酸、山梨醇、山梨糖、七叶苷和接触酶反应阴性。可见,该细菌可利用有机氮源尿素,对硝酸盐有还原作用,可应用于构建藻菌体系,处理水体中的氮。

表1 OA-1菌株生理生化鉴定Table 1 Physiological and biochemical identification results of OA-1 strain
2.3 16S rDNA鉴定及系统发育分析
PCR扩增获得片段大小为1 410 bp的16S rDNA序列,NCBI GeneBank 数据库序列号OM276863,序列为


经Blast 比对,所构建系统发育树见图3。图3显示,该菌株与多株居海噬冷菌(Algoriphagusmarincola)聚为一支,同源性达99%,结合形态特征及生化鉴定,将该菌株确定为居海噬冷菌。

图3 基于16S rDNA基因序列同源性的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA gene sequence homology
2.4 藻菌体系对微藻生长的影响
居海噬冷菌与波吉卵囊藻共培养10 d 后,叶绿素a含量均高于纯藻培养对照组(图4),藻菌体系组的叶绿素a 质量浓度最高达2.74 mg/L,对照组仅为1.88 mg/L,增加45.74%,表明居海噬冷菌促进了波吉卵囊藻叶绿素a 的积累,在该藻菌体系的条件培养下,微藻生长更快,该菌株可用于构建与波吉卵囊藻的藻菌体系。

图4 藻菌体系对波吉卵囊藻叶绿素a含量的影响Fig.4 Effects of algae-bacteria system on chlorophyll a content of Oocystis borgei
2.5 不同氮源条件下藻菌体系的氮吸收速率
在4种氮源条件下,藻菌体系、纯藻体系和纯菌体系之间氮吸收速率差异均显著(P<0.05)(图5),藻菌体系组均显著高于单独培养的微藻或细菌。以亚硝酸钠和氯化铵为氮源时,藻菌体系组氮吸收速率高于纯藻和纯菌体系之和,说明在对这两种氮源的利用过程中,居海噬冷菌和波吉卵囊藻存在协同作用。

图5 不同培养体系对氮的吸收速率Fig.5 Nitrogen absorption rates in different culture systems
2.6 不同氮源及氮浓度条件下藻菌体系的氮吸收速率
图6表明,在4 种不同的氮源中,藻菌体系氮浓度水平对氮吸收速率显著影响(P<0.05)。在以硝酸钠为氮源的培养基中,在7 mmol·L-1的最高氮浓度时,藻菌体系吸收速率达36.93 μmol·h-1·g-1。在以亚硝酸钠为氮源的培养基中,在3 mmol·L-1氮浓度时的吸收速率最高,为6.28 μmol·h-1·g-1。在以氯化铵为氮源的培养基中,在氮浓度3 mmol·L-1时有吸收速率平均值最高,为20.09 μmol·h-1·g-1,与5 mmol·L-1氮浓度时差异不显著,但氮浓度达7 mmol·L-1时,吸收速率显著下降(P<0.05)。在以尿素为氮源的培养基中,随着氮浓度的升高吸收速率先升后降,在5 mmol·L-1氮浓度时最高,为63.58 μmol·h-1·g-1,随后下降。可知,相较于其他三种氮源,该藻菌体系在以亚硝酸钠为氮源时,对氮的吸收速率明显偏低,说明此藻菌体系对亚硝态氮的吸收效果不明显;该藻菌体系对硝酸钠的耐受性较高,以硝酸钠为氮源时,随着氮浓度的升高,吸收速率也升高。

图6 藻菌体系在不同氮源及氮浓度中的氮吸收速率Fig.6 Nitrogen absorption rate of algae-bacteria system in different nitrogen sources and concentrations
3 讨论
3.1 藻菌体系构建及其功能
微藻为水生环境中最重要的初级生产者,对水体的稳定有不可替代的地位。微藻细胞向环境中释放营养物质,吸引众多细菌在其周围生活,形成以藻细胞为核心的富营养区域——藻际环境。不同的微藻向环境释放的物质不同,形成的藻际环境存在差异。细菌的数量和种类对微藻的影响较大。假单胞菌(Pseudomonassp.)BB1-a 可促进普通小球藻的生长[22];固氮螺菌(Azospirillum brasilense)会接受小球藻释放的信号物质诱导分泌吲哚乙酸(IAA),促进小球藻的生长[23];从黄化的螺旋藻(Spirulinasp.)体内分离的一株盐单胞菌(Halomonassp.)则会明显抑制螺旋藻的生长[24]。在养殖环境中存在多种细菌,一些细菌的硝化和反硝化作用等可有效利用水体中的无机氮,而有害细菌则会危害养殖动物,造成经济损失。因此,建立和维持稳定的藻菌群落结构是生态健康养殖的基础,合理利用水体中微藻和细菌的互利、共生关系,增加水中元素利用率可减少养殖过程中的污染,是提高养殖成活率和经济效益的有效途径。
同一种微藻会随所处环境的改变而影响藻际微生物的群落结构[25],不同微藻和细菌对不同水质环境的适应性有较大差别,其生长和对水体营养物质的吸收能力亦有不同[26],因此,在养殖环境中构建藻菌体系时,宜优先选用本土分离的微藻和细菌种类。试验用波吉卵囊藻分离自对虾养殖池塘[27],在实验室稳定环境中长时间培养,其藻际微生群落结构相对固定,分离的居海噬冷菌长期附生于波吉卵囊藻。通过分离藻际菌群中的促生菌,可构建有价值的藻菌体系,探究藻菌相互作用机制等。段露露等[28]发现,在分离自杜氏盐藻(Dunaliella salina)的盐单胞菌与杜氏盐藻的藻菌体系中,杜氏盐藻叶绿素a 含量相比对照组提高36.3%,β-胡萝卜素增加56.4%。王书亚等[29]将微小杆菌(Exiguobacterium collins)、假单胞菌(Pseudomonadaceaesp.)和枯草芽孢杆菌分别与小球藻构建藻菌体系,发现叶绿素a 含量比纯培养的小球藻提高了1.79 倍、1.49 倍和1.58 倍。在本研究构建的藻菌体系中,波吉卵囊藻的叶绿素a 含量达到2.74 mg/L,比对照组增加45.74%。微藻和细菌之间存在复杂的相互作用关系,藻菌的种类、所处环境、自身生长状况等因素均影响微藻和细菌的相互作用效果,所以藻菌间相互作用并非一致,可能存在着互利共生、偏利共生、竞争或拮抗的关系,营养环境与营养交换对二者间相互作用似起重要作用[30-31]。本研究中,在不同溶解态氮环境中,藻菌体系的氮吸收速率均高于纯藻或纯菌体系,本研究表明,居海噬冷菌可利用有机氮源尿素,对硝酸盐有还原作用,所以在以尿素或硝酸钠为氮源时,藻与菌对这两种氮的利用均较高,藻菌体系协同效果不如在以亚硝酸钠或氯化铵为氮源时明显。综上,居海噬冷菌OA-1 可显著促进波吉卵囊藻的生长,且二者的藻菌体系对氮的吸收速率显著高于单独培养体系,其作用机制、具体功能及应用需进一步探索。
3.2 藻菌体系对氮的吸收规律
氮影响生物体细胞的分裂和生长,是生物生长的必需元素之一。微藻和细菌通过主动运输吸收水体中的溶解态氮,在氮吸收上存在“饱和效应”[32]。假微型海链藻(Thalassiosira pseudonana)在尿素处理组的生长较好,但高浓度的铵盐会对其产生抑制[33]。孟鸽等[34]研究发现,铵盐会对藻产生抑制。本研究也有高浓度的铵态氮、尿素氮和亚硝铵态氮对藻菌体系的氮吸收速率产生抑制的结果。以硝酸钠为氮源时,随氮浓度的升高,吸收速率随之增高,但在其他三种氮源中均出现拐点,亚硝酸钠为氮源时拐点在氮浓度3 mmol·L-1,氯化铵和尿素为氮源时,拐点出现在氮浓度5 mmol·L-1。因此亚硝酸盐氮对氮的吸收抑制早于其他2种氮源。
水体微生物对不同形式的溶解态氮有选择性利用的特征,所以不同的氮源会对藻菌体系的氮吸收能力产生影响。在本研究所设氮浓度梯度下,藻菌体系对4 种氮源的氮吸收速率均有显著差异。4种氮源间,对尿素氮的吸收速率普遍较高,其次是铵态氮,亚硝态氮的吸收速率较低。刘燕[35]研究发现,小球藻与地衣芽孢杆菌(Bacillus licheniformis)的藻菌体系对铵态氮的利用效果最好,高于硝态氮。本研究中,铵态氮的吸收速率较高,其原因是细菌通过硝化过程直接利用铵态氮,藻菌体系中藻和菌的协同作用提高了对铵盐的利用效果[36-37]。微藻不仅可利用水体中溶解性无机氮,亦可利用尿素等有机氮[38],异养菌的引入提高了对有机氮的利用效率,可能是本研究中藻菌体系对尿素氮吸收速率较高的原因。
藻和菌之间通过交换代谢产物形成互利共生关系,增强了对养殖水体营养物质的吸收效率[39]。随着集约化、高密度养殖的推广,养殖水体中的氮磷等元素更易堆积,将藻菌体系运用于水产养殖水调控,符合生态学原理,生态环保,有能耗小、成本低、效率高等优点[40]。但现实环境的养殖水环境中变量因素较多,不同微藻和细菌的组合及藻菌比例的差异都表现出特异性,对藻菌体系还应深入研究。
4 结论
1)从室内培养的波吉卵囊藻藻际微生物群落中分离出1株促生菌,经形态观察、生理生化鉴定和16S rDNA序列比对,鉴定为居海噬冷菌(A.marincola)。
2)菌株OA-1 与波吉卵囊藻共培养可促进藻的生长,藻的叶绿素a含量比对照组增加45.74%。
3)波吉卵囊藻与居海噬冷菌的藻菌体系对氮的吸收速率显著高于纯藻体系和纯菌体系,在以亚硝酸钠和氯化铵为氮源时,藻菌间存在明显的协同作用。
4)藻菌体系对氮的吸收速率存在“饱和效应”,以尿素或氯化铵为氮源时,在氮浓度5 mmol·L-1出现吸收拐点,以亚硝酸钠为氮源时,在3 mmol·L-1出现吸收拐点,过高的氮浓度会抑制藻菌体系对氮的吸收。

