东海北部秋季雌性剑尖枪乌贼的性腺发育与成熟特性
郭荣佩,李 楠,方 舟,2,3,4,5,陈新军,2,3,4,5
(1.上海海洋大学海洋科学学院/2.大洋渔业资源可持续开发教育部重点实验室/3.国家远洋渔业工程技术研究中心/4.农业农村部大洋渔业开发重点实验室/5.农业农村部大洋渔业资源环境科学观测实验站,上海 201306)
剑尖枪乌贼(Uroteuthis edulis)属于头足纲(Cephalopoda)枪形目(Teuthoidea)枪乌贼科(Loliginidae)尾枪乌贼属(Uroteuthis),是浅海暖水性物种[1],其具有分布广、世代更新快、生长迅速、生命周期短等特性[2],且适温适盐范围比较广[3],同时也具有长距离洄游的特征[4]和趋光习性[5]。该种类主要分布于日本青森县海域以南,日本海西部以南,韩国海域,中国黄海、东海、南海以及菲律宾群岛海域[6],其中以东海资源密度最为丰富,已逐渐取代曼氏无针乌贼(Sepiella maindroni)而成为东海新的优势头足类种群,并在渔业生产中处于较高地位[7]。剑尖枪乌贼重要的经济价值已引起国内外众多学者的广泛关注,目前已对其种群结构[8-9]、生长规律[2,7,9-12]、洄游路径[13]、渔获量[14-16]、栖息地分布变化规律[17]、资源评估与管理[6,18-20]进行了报道,但针对该种类资源量的变化规律了解甚少。通过繁殖生物学研究可以更好帮助掌握东海剑尖枪乌贼资源量的变化情况。因此,本研究根据2019-2021年秋季在东海北部海域采集的剑尖枪乌贼雌性样本,分析不同年份雌性个体的胴长体质量组成、关系和性腺发育的情况,为今后剑尖枪乌贼资源利用与开发提供理论依据。
1 材料与方法
1.1 样本采集海域和时间
剑尖枪乌贼雌性样本委托“浙岭渔23860”拖网渔船进行采集,单船底层有翼单囊拖网,两船网具均一致,网具主尺度58 m×28 m,上纲长40 m,下纲长45 m,网目尺寸25 mm。采集时间分为2019-2021 年中每年的9-11 月,3 a 秋季雌性样本均是在相同时间段,采用相同网具及采样方式获取;采集地点为东海北部海域(123°E-127°E、28°N-31.5°N)。每月采样不少于20尾,所采集样本经过冷冻保存运回实验室,雌性样本总数为197尾。
1.2 生物学测定
在实验室将样品解冻以后即可进行基础生物学测定,测定项目包括性腺成熟度、胴长(Lm)、体质量(mb)、卵巢质量(mo)、缠卵腺长(Lng)、缠卵腺质量(mng)和输卵管系统质量(mos)。这些测定项目中,胴长采样皮尺测量,精确至1 mm;缠卵腺长采样用游标卡尺测量,精确至0.01 mm。体质量采样用电子秤测量,精确至1 g;卵巢质量、缠卵腺质量和输卵管系统质量等均采用电子天平,精确至0.01 mg。

表1 剑尖枪乌贼捕捞信息Table 1 Capture information of Uroteuthis edulis
通过性腺外形来判断性别,性腺成熟度以性腺发育状况来划分,分为Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ5 个时期[21]。其中性腺成熟度在Ⅲ期和Ⅳ期时为性成熟期[22]。
1.3 数据分析
对剑尖枪乌贼样本的胴长体质量组成、胴长体质量关系、性别组成、各月份性腺发育情况、性腺指数(gonadosomatic index,GSI)[23]、缠卵腺指数(nidamental gland index,NGI)[16]、性腺指数与胴长间的关系利用Excel 2021 软件进行比较分析,相关指数的计算公式如下:

以上公式中,mb为样本总体质量(g);Lm为样本胴长(mm);a为生长条件因子,b为异速生长系数;Igs为雌性的性腺指数;Ing为雌性的缠卵腺指数;mo、mng、mos分别为卵巢质量(g)、缠卵腺质量(g)、输卵管系统质量(g);Lng和Lmf分为缠卵腺长度(mm)和雌性胴长(mm)。
2 结果
2.1 胴长体质量组成
雌性剑尖枪乌贼样本的胴长和体质量分别为51~242 mm 和17~456 g,优势胴长组和体质量组分别为100~140 mm和80~120 g。其中,2019年雌性样本胴长为96~242 mm,平均胴长为136.88 mm,优势胴长组为100~180 mm,约占2019 年雌性个体总数的84.62%;2020 年胴长为69~210 mm,平均胴长为141.47 mm,优势胴长组为80~200 mm,约占2020年雌性个体总数的91.78%;2021年胴长为51~239 mm,平均胴长为110.13 mm,优势胴长组为60~160 mm,约占2021 年雌性个体总数的90.28%(图1(a))。整体来看,3 a 秋季雌性样本的胴长以100~140 mm 居多。经过单因素ANOVA 检验发现,2019年和2020年雌性个体胴长无显著差异(P>0.05),2019 年和2021 年、2020 年和2021 年胴长均差异极显著(P<0.01)。
2019年雌性样本的体质量为44~456 g,平均体质量为125.59 g,优势体质量组为40~200 g,约占2019 年雌性个体总数的88.46%;2020 年体质量为24~279 g,平均体质量为122.01 g,优势体质量组为40~200 g,约占2020 年雌性样本总数的79.45%;2021 年体质量为17~345 g,平均体质量为87.36 g,优势体质量组为17~120 g,约占2021 年雌性样本总数的80.56%(图1(b))。整体来看,3 a秋季雌性样本的体质量以80~120 g 居多。经过单因素ANO‐VA 检验发现,2019 年和2020 年雌性个体体质量无显著差异(P>0.05),2019 年和2021 年、2020 年和2021年体质量均差异极显著(P<0.01)。
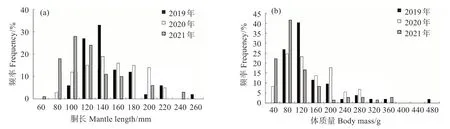
图1 雌性剑尖枪乌贼个体的胴长和体质量组成Fig.1 The mantle length and body mass composition of female Uroteuthis edulis
2.2 胴长体质量关系
经协方差检验发现,2019 年和2020 年、2019 年和2021 年、2020 年和2021 年秋季雌性个体体质量与胴长的关系均差异显著(P<0.05)。
根据2019-2021 年秋季雌性剑尖枪乌贼生物学测定数据,分别拟合3 a剑尖枪乌贼雌性个体的胴长(Lm)与体质量(mb)关系见图2。

图2 雌性剑尖枪乌贼个体的胴长与体质量关系Fig.2 Relationship between mantle length and body mass of female Uroteuthis edulis
2.3 雌性个体数量变化
2019-2021 年秋季采集的雌性剑尖枪乌贼样本有197 尾。分析雌性个体不同月份数量变化可知,2019 年和2021 年雌性样本数量均在10 月份最多,在11 月份最少,而2020 年则是在10 月份最少,在9 月份最多(图3)。整体对比分析可看出,2019年和2021 年秋季雌性样本在不同月份的变化规律一致,均是先增大后减小,而2020 年变化规律则不同于其他两年,其变化规律则是先减小后增大。

图3 不同月份雌性样本数量变化Fig.3 Changes in the number of samples of female Uroteuthis edulis in different months
2.4 各月份性腺发育情况
分析发现,采集的3 a 秋季雌性样本中未发现性腺成熟度为Ⅴ期的个体。其中,未成熟个体占3 a 雌性样本总数的58.38%;成熟个体占样本总数的41.62%。对比来看,3 a中9月份的成熟剑尖枪乌贼雌性个体较多,未成熟个体较少;10 月份的未成熟个体较多,成熟个体较少(图4)。2019 年11 月和2020 年11 月均为未成熟个体均较多,成熟个体较少;而2021年11月则成熟个体较多。

图4 不同时间点雌性剑尖枪乌贼性腺发育状况组成Fig.4 The composition of the developmental status of the gonads of female Uroteuthis edulis at different time points
2.5 个体生长与性腺发育
通过数据分析发现,采集的3 a 秋季雌性样本的胴长最大值均出现在Ⅳ期,而2019年最小值出现在Ⅱ期,2020 年出现在Ⅰ期,2021 年出现在Ⅳ期。2019 年和2021 年的体质量最大值出现在Ⅳ期,而2020 年最大值则出现在Ⅰ期;2020 年和2021 年体质量最小值出现在Ⅰ期,2019 年则出现在Ⅱ期。整体来看,2019 年雌性个体的胴长和体质量在个体生长发育过程中先减小后增大,在性腺成熟度Ⅱ期时较小(图5(a,d))。2020年雌性个体的胴长在个体生长发育过程中逐渐增大;体质量先增大后减小,在性腺成熟度Ⅲ期时体质量较大(图5(b,e))。2021年雌性个体的胴长和体质量在性腺成熟度Ⅰ、Ⅱ、Ⅲ期时整体变化幅度较小,在Ⅳ期时胴长和体质量则偏大(图5(c,f))。

图5 雌性剑尖枪乌贼在不同性腺成熟度下的胴长和体质量分布Fig.5 The distribution of mantle length and body mass of female Uroteuthis edulis at different maturity of gonads
2.6 性腺指数
图6 可见,采集的3 a秋季雌性样本的性腺指数范围为0.001 1~0.656 7,平均值为0.068 9。2019年性腺发育未成熟时(Ⅰ、Ⅱ期)的性腺指数为0.001 1~0.020 2,平均值为0.007 5;性腺发育成熟时(Ⅲ、Ⅳ期)的性腺指数为0.002 5~0.203 8,平均值为0.086 3。2020 年性腺发育未成熟时(Ⅰ、Ⅱ期)的性腺指数为0.001 6~0.175 4,平均值为0.020 4;性腺发育成熟时(Ⅲ、Ⅳ期)的性腺指数为0.002 1~0.291 7,平均值为0.080 2。2021年性腺发育未成熟时(Ⅰ、Ⅱ期)的性腺指数为0.003 5~0.185 1,平均值为0.022 0;性腺发育成熟时(Ⅲ、Ⅳ期)的性腺指数为0.012 1~0.656 7,平均值为0.160 3。
图6 可见,3 a 雌性剑尖枪乌贼样本的性腺指数均在性腺成熟度为Ⅳ期时取得最大值,2019 年和2020 年的雌性样本的性腺指数在性腺成熟度为Ⅰ期时值最小(图6(a,b)),而2021 年的雌性样本的性腺指数在性腺成熟度为Ⅱ期时值最小(图6(c))。整体来看,2019 年雌性个体的性腺指数随着个体生长发育而逐渐增大,2020年和2021年雌性个体的性腺指数随着个体生长发育先略减小后增大,成熟(Ⅳ期)个体的性腺指数明显大于未成熟(Ⅰ、Ⅱ期)个体。

图6 雌性剑尖枪乌贼在不同性腺成熟度下的性腺指数分布Fig.6 Gonadosomatic index of female Uroteuthis edulis at different maturity of gonads
2.7 缠卵腺指数
图7可见,雌性个体的缠卵腺指数范围为0.050 0~0.692 3,平均值为0.264 2。2019 年雌性个体的缠卵腺指数范围为0.05~0.427 5,平均值为0.232 7;Ⅰ、Ⅱ期的缠卵腺指数范围为0.099 3~0.384 1,平均值为0.191 9;Ⅲ、Ⅳ期的缠卵腺指数范围为0.05~0.427 5,平均值为0.304 7。2020 年雌性个体的缠卵腺指数范围为0.117 2~0.596 2,平均值为0.281 6;Ⅰ、Ⅱ期的缠卵腺指数范围为0.117 2~0.436 0,平均值为0.206 6;Ⅲ、Ⅳ期的缠卵腺指数范围为0.206 9~0.596 2,平均值为0.402 1。2021 年雌性个体的缠卵腺指数范围为0.078 9~0.692 3,平均值为0.268 5;Ⅰ、Ⅱ期的缠卵腺指数范围为0.087 7~0.283 8,平均值为0.148 5;Ⅲ、Ⅳ期的缠卵腺指数范围为0.078 9~0.692 3,平均值为0.352 5。

图7 雌性剑尖枪乌贼在不同性腺成熟度下的缠卵腺指数分布Fig.7 The distribution of nidamental gland index of female Uroteuthis edulis at different maturity of gonads
图7 中可见,2019 年和2020 年雌性剑尖枪乌贼样本的缠卵腺指数在Ⅲ期时值最小(图7(a,b)),而2021 年缠卵腺指数在Ⅳ期值最小(图7(c));2019 年雌性样本的缠卵腺指数在Ⅲ期的值最大,2020 年雌性样本在Ⅳ期的值最大,2021 年雌性样本在Ⅱ期的值最大。整体来看,3 a雌性样本缠卵腺指数的变化规律有所不同,2019 年雌性样本的缠卵腺指数随着个体生长发育先减小,后又增大;2020 年雌性样本的缠卵腺指数则是先增大后逐渐减小;2021 年雌性样本的缠卵腺指数则是先增大后减小最后又增大。
3 讨论
本研究表明,东海北部秋季雌性剑尖枪乌贼的优势胴长组和体质量组分别为100~140 mm和80~120 g,大于东海南部海域剑尖枪乌贼[2]的研究和南海北部近海剑尖枪乌贼[6]的规格。其原因可能是伏季休渔制度在东海开始实施后[24],秋季是剑尖枪乌贼渔汛集中的时间[25],本研究是在秋季采样,在东海实行休渔制度以后剑尖枪乌贼个体体型较大,且东海北部海域最常用的采样方法是拖网采样,而东海南部海域多采用灯光围网采样[22];另外有研究表明采用灯光诱捕捕捞的个体相对较小[26],使东海南北部剑尖枪乌贼物种大小出现差异。此外还可能是采样网具规格不同导致差异[3]。本研究还发现2019年和2020 年雌性个体胴长和体质量均无显著差异(P>0.05),2019 年和2021 年、2020 年和2021 年胴长和体质量均差异极显著(P<0.01),2021 年雌性样本的个体相较于2019年和2020年较大。
生长参数b为异速生长因子,反映生长发育的不均匀性,其年间变化可以作为海洋生物对海域环境变化能力的指标[27]。本研究发现,2019 年雌性剑尖枪乌贼个体的b为2.214 3,2020 年b为2.186 5,2021 年b为2.086 7,3 a 雌性剑尖枪乌贼个体的b均小于3,且数值相差不大,即均处于负异速生长状态,体长增长快于体质量的增加。王凯毅等[28]和孙典荣等[3]对东海南部和北部湾海域的剑尖枪乌贼采样的研究发现,雌性样本的生长参数b分别为2.101 9和2.324 7,其b值均小于3,表明不同海域雌性剑尖枪乌贼个体均处于负异速生长状态。
本研究样本采集时间均为秋季,2020 年秋季捕捞的雌性个体数量变化规律不同于其他两年,可能是由于捕捞量较小,样本采集的随机性不够强,使捕捞的雌性个体数量变化存在差异。此外,不同年份成熟个体比例存在差异,可能与群体组成差异和栖息海域海水温度的年间差异有关。剑尖枪乌贼根据产卵时间可划分为春生群体、夏生群体、秋生群体和冬生群体[8,29-30],可能在采集的三年秋季样本中群体组成不同使成熟个体比例出现差异。已有学者研究表明,温度会对茎柔鱼的性成熟产生影响,高环境温度会使同科的茎柔鱼(Dosidicus gigas)出现性早熟现象,而低环境温度会延缓茎柔鱼性成熟[31]。海水温度的不同同样也可能会影响枪乌贼个体的性成熟,使不同年份成熟个体的比例出现年间差异。
反映头足类生长状况的指标有胴长、体质量和性腺成熟度[32]。雌性个体的胴长和体质量在个体生长发育过程中变化规律不同,可能与优势群体的生物特征以及海洋环境因子的变化有关[9]。由于剑尖枪乌贼是一年生软体动物,一年内性成熟产卵[33],短暂的生活史特征使其更容易受到海表面温度等环境因素的影响,这在其他种类[31,34]中也有所体现。采集的剑尖枪乌贼雌性样本中,胴长、体质量的最大值大多出现在Ⅳ期,可能是由于在个体生长发育的过程中雌性个体需要通过摄食获得能量使性腺迅速增重,用于生殖投入[35],Ⅳ期处于繁殖期,此时雌性个体较大。此外,雌性个体在性成熟以后胴长和体质量的变化幅度较小,可能是由于雌性个体在性成熟以后停止摄食,机体能量用于卵子发育,其胴长和体质量增加缓慢[36]。
性腺指数和缠卵腺指数可判定雌性剑尖枪乌贼的成熟状况。本研究发现,3 a雌性剑尖枪乌贼样本在性腺发育成熟前的性腺指数变化不大,且成熟(Ⅳ期)个体的性腺指数明显大于未成熟(Ⅰ、Ⅱ期)个体,与林东明等[37]对巴塔哥尼亚枪乌贼的研究和刘必林等[36]对茎柔鱼的研究结果一致,这可能是由于头足类属种属于短生命周期属种,其性腺发育滞后于个体生长[38],雌性个体繁殖后代需要更多的能量储备,其在性腺发育前期为保证充足营养和能量摄入而维持较低的性腺指数,为性腺发育成熟和排卵期提供基础保障[39]。2019 年雌性个体的性腺指数和缠卵腺指数均随着个体的生长发育逐渐增大,说明2019年雌性个体性腺发育状况良好,其与林东明等[37]对巴塔哥尼亚枪乌贼的研究、林东明等[23]对阿根廷滑柔鱼的研究以及李思亮等[40]对柔鱼的研究结果一致。而2020 年和2021 年在性腺成熟度Ⅱ期时性腺指数略减小,2020 年在性腺成熟度Ⅳ期、2021年在Ⅲ期的缠卵腺指数减小,这可能是因为2020年和2021年出现了拉尼娜现象,使海面温度持续异常偏冷,对雌性个体的性腺发育产生一定影响。
本研究对秋季剑尖枪乌贼雌性样本的个体生长与性腺发育状况进行了分析,为今后深入研究雌性剑尖枪乌贼的繁殖生物学提供理论基础。目前对于雌性剑尖枪乌贼繁殖生物学的研究较少,今后研究应侧重于考虑剑尖枪乌贼雌性个体的繁殖力和繁殖策略的研究,以便于对剑尖枪乌贼的繁殖状况有更加深入了解。此外,本研究中所用的实验样本均来自于拖网渔船,其样本采集的随机性可能不够,且性腺成熟度的判定均是人工目测进行,判定过程中会存在一定误差,需要在今后研究中加以完善。

