非酒精性脂肪性肝病患者血浆外泌体差异蛋白分析*
张文彦,刘 芳,刘梦露,陈德喜,张 晶,时红波,于海滨
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)包括肝脂肪变、炎症、肝细胞损伤和纤维化,其进展可发生非酒精性脂肪性肝炎 (non-alcoholic steatohepatitis,NASH)、肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)[1]。NAFLD还是导致代谢综合征(MetS)、2型糖尿病(T2DM)、动脉硬化性心血管相关疾病,还是结直肠肿瘤等高发的原因[2]。外泌体(exosomes)是直径为30~150 nm的天然脂质膜封闭的囊泡,携带多种分子,包括脂质、蛋白质和核酸等[3,4],主要参与细胞间信息传递和物质运输[5]。有研究表明外泌体参与肝脏细胞炎症反应、脂质变性和肝纤维化的发生[6,7],因此外泌体及其携带的蛋白有望成为NAFLD监测的重要工具。本研究采用串联质谱标签(tandem mass tag,TMT)标记的高效液相色谱-质谱联用(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术检测了NAFLD患者血浆外泌体蛋白,筛选出差异蛋白,通过生物信息学技术分析它们的功能,为寻找无创检测NAFLD手段提供参考依据。
1 资料与方法
1.1 一般资料 2020年7月~10月首都医科大学附属北京佑安医院就诊的NAFLD患者3例和健康体检者3例,年龄为16~65岁。诊断依据2018年发布的非酒精性脂肪性肝病防治指南,无饮酒史或者过去12个月每周男性饮用酒精(折合乙醇量) <210 g,女性 <140 g,肝活检组织学改变符合非酒精性脂肪性肝病的病理学诊断标准。排除标准:(1)酒精性肝病(alcoholic liver disease,ALD)、基因3型丙型肝炎病毒(hepatitis C virus,HCV)感染、自身免疫性肝炎、肝豆状核变性等可导致脂肪肝的特定肝病;(2)药物(他莫昔芬、乙胺碘呋酮、丙戊酸钠、 甲氨蝶呤、糖皮质激素等)、全胃肠外营养、炎症性肠病、乳糜泻、甲状腺功能减退症、库欣综合征、β脂蛋白缺乏血症、脂质萎缩性糖尿病、Mauriac 综合征等导致脂肪肝的特殊情况。本研究得到首都医科大学附属北京佑安医院医学伦理委员会批准。
1.2 主要试剂和仪器 碳酸氢铵(Sigma-Aldrich)、尿素(Amresco)、蛋白定量染液(Huaxingbio)、二硫苏糖醇(DTT,Amresco)、碘代乙酰胺(IAM,Amresco)、胰蛋白酶(Promega)、乙腈(J.T.Baker)、甲酸(Sigma-Aldrich)、XBridge Peptide BEH 5 μm C18色谱柱(Waters)、TMT6plexIsobaric Label Reagent Set(Thermofisher,货号:90111);超速离心机 (Beckman,OptimaTMXPN-100)、高效液相色谱系统(8600RIGOL L-3000)、超声破碎仪(上海沪析实业有限公司)、离心机(Eppendorf)、酶标仪(DR200B),电泳系统(Bio-rad)。
1.3 血浆外泌体蛋白的提取 取血浆,4℃ 2000 rcf离心10 min,去除死细胞,继续10000 rcf离心30 min,去除细胞碎片和大分子杂质,将上清移至超速离心管,4℃ 110000 rcf 超速离心70 min,提纯外泌体,加入适量的尿素(浓度8 mol/L)和蛋白酶抑制剂混匀,超声裂解,4℃ 140 00 rcf离心20 min,取上清,测定蛋白质浓度,并行SDS-PAGE电泳质控。
1.4 蛋白标本的制备 取上述提取的蛋白100 μg,加入二硫苏糖醇(浓度10 mmol/L),30℃ 1 h,加入碘代乙酰胺(浓度40 mmol/L),室温45 min,随后用碳酸氢铵(浓度25 mmol/L)将样本稀释4倍,按胰酶:蛋白1∶50的比例加入胰酶,37℃过夜,加入0.1%甲酸50μl终止酶解,将酶解后的肽段用C18柱除盐后进行真空冷冻干燥,取干净EP管,每管加入TMT试剂0.8 mg和无水乙醇41 μl,震荡5 min,加入酶切后的蛋白100μg,室温孵育1 h,将标记好的蛋白真空冷冻干燥,进行后续实验。
1.5 数据采集 本报告采用Orbitrap Fusion型质谱采集LC-MS/MS数据,配制流动相 A 液(100%水、0.1%甲酸)和 B 液(100%乙腈、0.1%甲酸),用A液10 μl溶解冻干粉末,4℃下14000 rcf 离心 20 min,取上清样品 1 μg,行液质检测。使用 Orbitrap Fusion质谱仪和Nanospray FlexTM(NSI)离子源,设定离子喷雾电压为 2.2 kv,离子传输管温度为350℃,采用数据依赖型采集模式质谱,全扫描范围为 350~1550 m/z,一级质谱分辨率设为120000(200 m/z),C-trap最大容量为 4×105,C-trap 最大注入时间为 50 ms。选择全扫描中离子强度 TOP20的母离子和高能碰撞裂解(HCD)法碎裂,进行二级质谱检测。二级质谱分辨率设为 60000(200 m/z),C-trap 最大容量为 1×105,C-trap 最大注入时间为118 ms,肽段碎裂碰撞能量设为28%,阈强度设为 5×104,动态排阻范围设为15 s,生成质谱,检测原始数据。
1.6 蛋白鉴定和定量分析 由Orbitrap Fusion型质谱完成TMT质谱分析,应用Power Designer 2.4处理产生的质谱原始文件,检索homo_sapiens_uniprot_2020_08_ 13.fasta数据库,对蛋白质进行鉴定和定量分析,最后以倍数上调>1.2倍或下调>1.2倍且P<0.05 为标准,筛选差异蛋白质。
1.7 生物学信息分析 通过Uniprot的注释信息对差异蛋白进行基因功能(GO)注释,采用Fisher精确检验,对差异蛋白进行功能(GO)富集分析,应用R-3.5.1软件对差异蛋白进行层次聚类分析。
1.8 统计学处理 应用Persuse软件平台[8](http://www.perseus-framework.org蛋白组学分析软件平台)进行蛋白组学前期数据统计分析。
2 结果
2.1 蛋白鉴定和定量分析情况 共鉴定到3419个肽段和387种蛋白。经蛋白质定量分析,共筛选出34种差异表达蛋白,其中与健康体检者相比上调的蛋白25种,下调的蛋白9种(图1、表1、表2)。
2.2 差异蛋白GO功能富集分析情况 对筛选出的差异蛋白进行功能分类,发现这些差异蛋白的功能主要集中在低密度脂蛋白颗粒重构、脂蛋白分解代谢、活性氧反应调节、纤维素形成调节、脂质储存调节等生物学过程;内质网、高尔基体、核糖体、蛋白酶复合物、脂蛋白颗粒、细胞膜等细胞组分;肝素结合、低密度脂蛋白受体结合、脂质转运蛋白活性调节、信号受体结合、脂肪酶结合、N-乙酰胞壁酰-L-丙氨酸酰胺酶活性调节等分子功能(图2)。
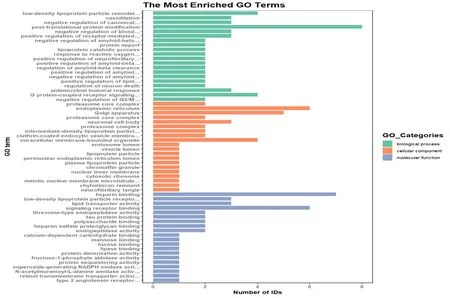
图2 差异蛋白在GO二级分类中统计分布图biological process(BP):生物过程;cellular component(CC):细胞组分;molecular function(MF):分子功能;条形图表示富集程度
2.3 差异蛋白KEGG通路分析情况 将筛选出的差异蛋白进行KEGG通路富集分析,发现差异蛋白主要集中于糖尿病并发症中的AGE-RAGE信号通路、TNF信号通路、胰岛素抵抗、肾素-血管紧张素系统、鞘脂信号通路、补体和凝血级联反应等信号通路(图3)。
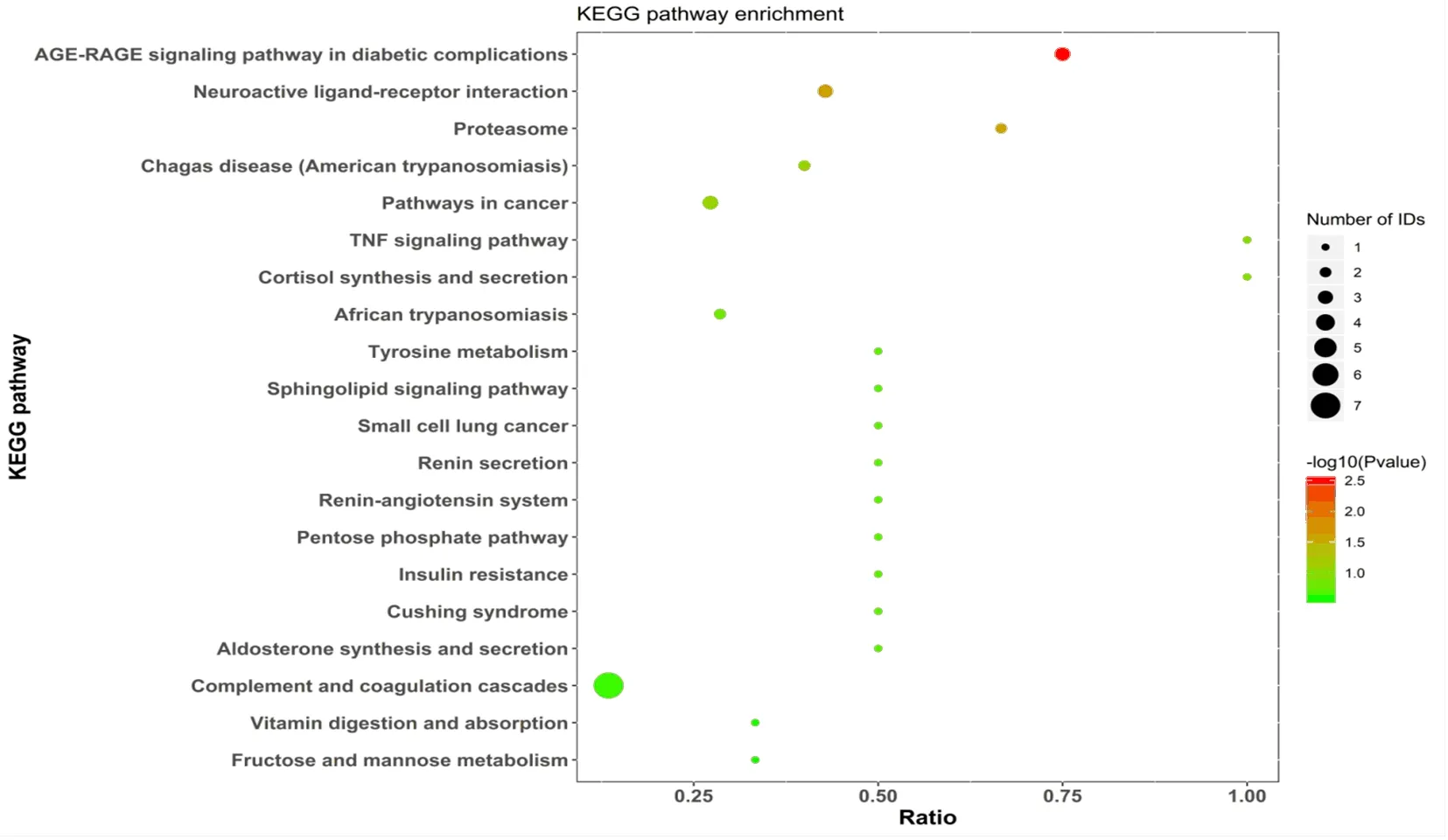
图3 差异蛋白在KEGG通路中富集分布气泡图颜色代表富集度[-log10(P value)],圆圈大小表示基因数目
2.4 差异蛋白相互作用分析情况 将所得的差异蛋白进一步进行相互作用网络分析,结果发现有13种差异蛋白被互作网络覆盖(图4),说明它们之间具有较好的生物学联系,其余蛋白则游离于相互作用网络之外,可能其功能较为独立或者与其他差异蛋白功能较疏远。
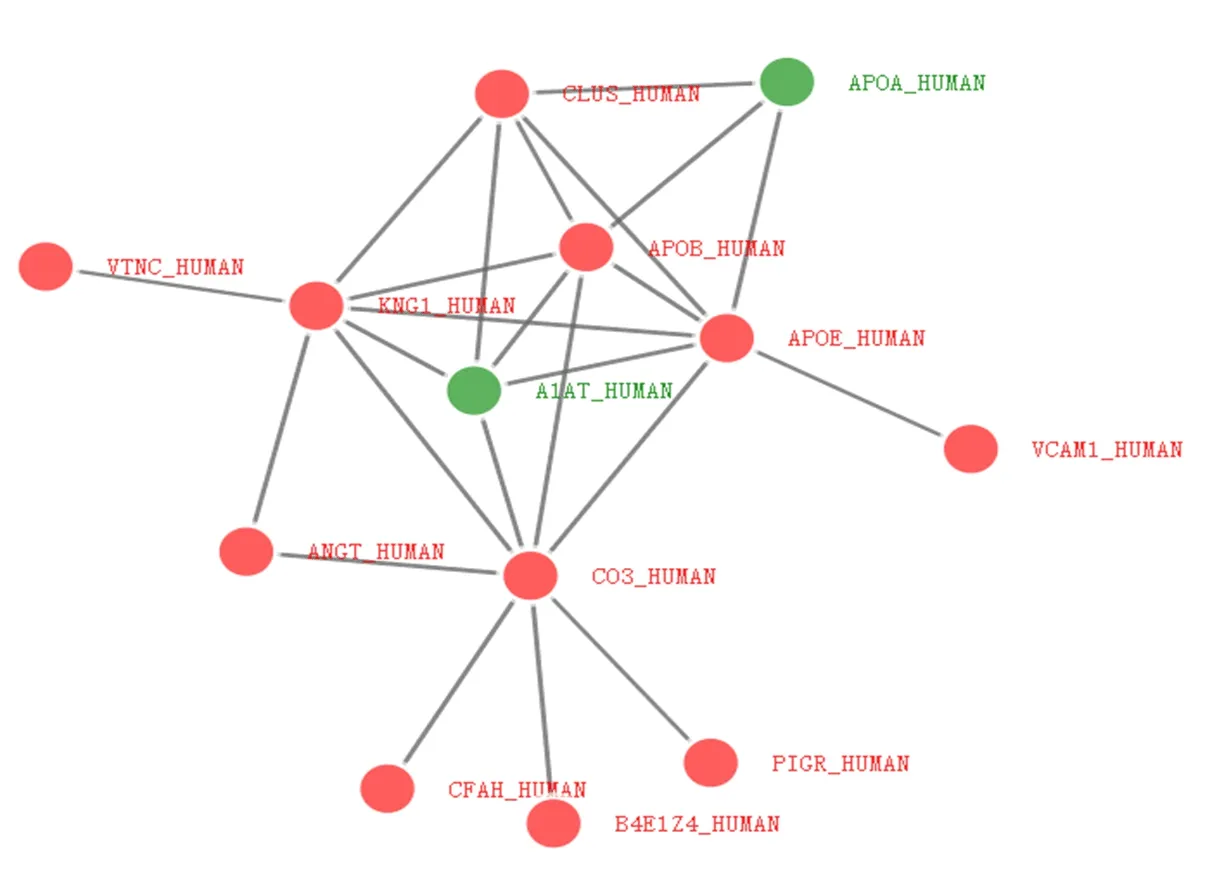
图4 部分差异蛋白相互作用(PPI)红色节点为上调蛋白,绿色节点为下调蛋白
3 讨论
研究发现外泌体存在多种生物分子,包括mRNA、miRNA、DNA、脂质和蛋白质等[9],尤其是蛋白质,已发现的外泌体上的蛋白有9000多种,其中许多在细胞间信息交流过程中具有重要的生物学功能[10,11]。以质谱技术为基础的蛋白组学作为蛋白质鉴定、定量和表征蛋白质翻译后修饰的工具[12],并能进一步提供蛋白质间相互作用的机制、相关功能的注释及与疾病之间关联的重要信息,而外泌体蛋白的分析发展尤为迅速[13,14],特别是临床样本来源的外泌体蛋白质组学分析已经被应用于寻找疾病诊断的早期标志物和疾病治疗的新靶点[15,16]。
本研究共筛选出差异蛋白34个,其中上调的蛋白25种,下调的蛋白9种,其功能归纳如下:(1)在NAFLD患者血浆外泌体差异蛋白上调组中,我们发现了视黄醇结合蛋白4(retinol binding protein4,RBP4),是一种脂质运载蛋白家族的蛋白质,肝细胞被认为是正常条件下RBP4分泌的主要来源[17]。在人体实验研究中发现,较高水平的RBP4被证明与肝脏脂肪蓄积增加有关[18],而阻断动物肝脏RBP4表达足以减少C57BL/6小鼠脂质并改善高脂饮食诱导的肝脂肪变性,证实RBP4在调节肝脏脂质代谢中的潜在作用[19];(2)玻连蛋白(vitronectin,VTN)是一种细胞外基质(ECM)蛋白,主要起源于肝脏,并作为血浆成分在血液中循环[20]。研究表明,αvβ3整联蛋白是VTN受体之一,是肝星状细胞(HSC)增殖、迁移、存活和促纤维化基因表达的关键调节剂。NAFLD包括非酒精性肝脂肪变(non-alcoholic hepatic steatosis,NAFL)和NASH。NASH具有肝细胞脂肪变性、气球样变、炎症和纤维化,而肝纤维化是由ECM产生和降解之间的不平衡引起的。VTN诱导的HSC活化可能作为肝纤维化发展过程中ECM蛋白产生的来源。因此,RBP4和VTN均可能是诊断NAFLD的早期血清学标志物。
在NAFLD的疾病发展过程中肝细胞的脂肪变作为疾病发展的首要因素,我们在此次蛋白组学分析中发现了与脂代谢密切相关的载脂蛋白,将其总结如下:(1)血浆外泌体差异蛋白上调组中的载脂蛋白B(apolipoprotein B,ApoB)和载脂蛋白E(apolipoprotein E,ApoE):肝脏是循环ApoE的主要来源。ApoB是促炎状态的预测指标;(2) 血浆外泌体差异蛋白下调组中的载脂蛋白A(apolipoprotein A,ApoA)和载脂蛋白D(apolipoprotein D ,ApoD): ApoA-1主要作为高密度脂蛋白(HDL)的一种成分存在于血浆,在生物发生过程中起着重要作用。
NASH的病理过程包括肝细胞的炎症反应。在血浆外泌体上发现多种上调和下调的炎症因子,其中蛋白多糖4(proteoglycan 4,PRG4)、跨膜通道样蛋白家族成员跨膜通道样蛋白8(transmembrane channel-like protein 8,TMC8)和α-1抗胰蛋白酶(α-1-antitrypsin,AT)等都有重要的作用。本研究结果表明,PRG4、TMC8和AT等炎症因子可能参与了NAFLD发病过程中的炎症反应,因处于不同的病理学过程时期而表现为上调和下调,有可能作为早期诊断NAFLD的血清学标志物。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张文彦和刘芳负责实施研究过程和采集整理数据;刘梦露负责调研整理文献;陈德喜负责修订论文;张晶负责患者入组及标本的收集;于海滨和时红波负责提出研究选题、设计研究方案和修订论文。

