沙格列汀干预非酒精性脂肪性肝病合并2型糖尿病大鼠肝组织AMPK/mTOR-TFEB自噬信号通路蛋白表达变化*
汪晓燕,钟雪玉,吴春燕
沙格列汀是临床常用的治疗2型糖尿病(T2DM)的药物,可通过选择性地抑制二肽基肽酶-4(dipeptidyl peptidase-4,DDP4),调节胰岛素分泌,发挥控制血糖的作用[1-4],也被最新的研究证实有较好的控制血脂和肝功能保护作用[5],但目前尚不清楚其具体的作用机制。腺苷酸5-单磷酸活化蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK]/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)-转录因子EB(transcription factor EB,TFEB)信号通路是与细胞自噬有关的通路,可调节机体糖、脂代谢过程,参与介导多种肝脏疾病的发生和发展[6]。本研究应用沙格列汀干预非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)合并T2DM大鼠,观察了其对AMPK/mTOR-TFEB自噬信号通路的影响,以探讨其治疗作用的机制。
1 材料与方法
1.1 实验动物 42只清洁级雄性SD大鼠,8周龄,体质量为160±20 g。饲养于武汉大学动物实验中心,保持26℃恒温、60%空气湿度、12 h亮光/12 h暗光循环光照条件,给予充足的饮水和食物,保持饲养笼干净、卫生。
1.2 NAFLD合并2型糖尿病动物模型的构建 采用随机数字表法将42只大鼠随机分为对照组、模型组和沙格列汀干预组,每组14只。给予模型组和沙格列汀干预组大鼠高脂饲料(普通饲料/15%猪油/10%蔗糖/2%胆固醇/0.25胆酸)喂养,而对照组动物继续接受普通饲料喂养。持续喂养10 w。禁食12 h,随机处死2只大鼠,称体质量,取血清和肝组织检查,确定NAFLD大鼠模型构建成功[7]。接着,各组大鼠禁食12 h,给予模型组和沙格列汀干预组链脲佐菌素(上海吉至生化科技有限公司)30 mg.kg-1腹腔注射,以制备2型糖尿病模型,给予对照组腹腔注射等量的柠檬酸-柠檬酸钠缓冲液。72 h后,经尾静脉取血0.5 mL,检测血糖和血脂水平。当血糖水平大于11.2 mmol/L时,视为2型糖尿病模型构建成功[8]。在造模成功后,在沙格列汀处理组12只大鼠,给予沙格列汀(阿斯利康制药有限公司)10 mg.kg-1·d-1持续灌胃8 w,在对照组12只和模型组12只大鼠,给予等量的生理盐水灌胃处理,持续8 w。在实验结束时,称质量,采取颈椎脱臼法处死大鼠,经腹主动脉取血,取肝脏,称质量,按照肝湿质量/大鼠体质量)×100%计算肝脏指数。取肝组织,用4%多聚甲醛固定,脱水透明封蜡后制片HE(上海歌凡生物科技有限公司)染色[9],在奥林巴斯显微镜(济南欧莱博电子商务有限公司)下观察。
1.3 血清检测 采用放射免疫法检测空腹胰岛素(insulin,INS,上海信帆生物科技有限公司);使用济南来宝医疗器械有限公司提供的BK-280型全自动生化分析仪检测空腹血糖[(fasting plasma glucose,FPG),按照FPG×INS)/22.5计算胰岛素抵抗指数(HOMA-IR)]和血生化指标。
1.4 肝组织AMPK/mTOR-TFEB自噬信号通路蛋白检测 采用Western bloting法检测肝组织AMPK、p-AMPK、mTOR、TFEB和自噬标记物LC3B-II蛋白表达。

2 结果
2.1 各组大鼠肝组织病理学表现 对照组大鼠肝组织结构清晰,肝细胞排列整齐,大小一致,无明显脂肪变性或细胞坏死;模型组大鼠肝组织结构模糊,细胞排列杂乱,可见小叶结构破坏,纤维组织增生,细胞内有大量的脂肪空泡存在;沙格列汀处理组肝组织较为完整,未观察到明显的小叶内纤维组织增生,脂肪变性程度也较模型组显著改善(图1)。
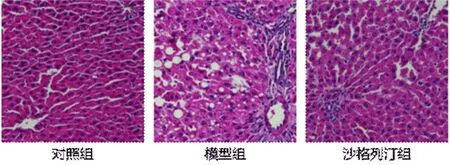
图1 各组大鼠肝组织病理学表现(HE,200×)
2.2 各组体质量、肝质量和肝脏指数比较 沙格列汀处理组大鼠体质量、肝质量和肝脏指数均显著低于模型组,差异有统计学意义(P<0.05,表1)。
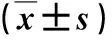
表1 各组体质量、肝质量和肝脏指数比较
2.3 各组大鼠血糖指标比较 沙格列汀处理组大鼠FPG、INS和HOMA-IR均显著低于模型组,差异有统计学意义(P<0.05,表2)。
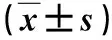
表2 各组大鼠血糖指标比较
2.4 各组大鼠血脂和肝功能指标比较 沙格列汀组大鼠TC、TG、ALT和AST水平均显著低于模型组,差异有统计学意义(P<0.05,表3)。
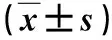
表3 各组血脂和肝功能指标比较
2.5 各组大鼠肝组织AMPK/mTOR-TFEB自噬信号通路蛋白表达比较 沙格列汀处理组大鼠肝组织p-AMPK、TFEB和LC3B-II表达显著强于模型组,而mTOR表达显著弱于模型组,差异有统计学意义(P<0.05,表4、图2)。
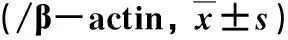
表4 各组肝组织内AMPK/mTOR-TFEB自噬信号通路表达比较
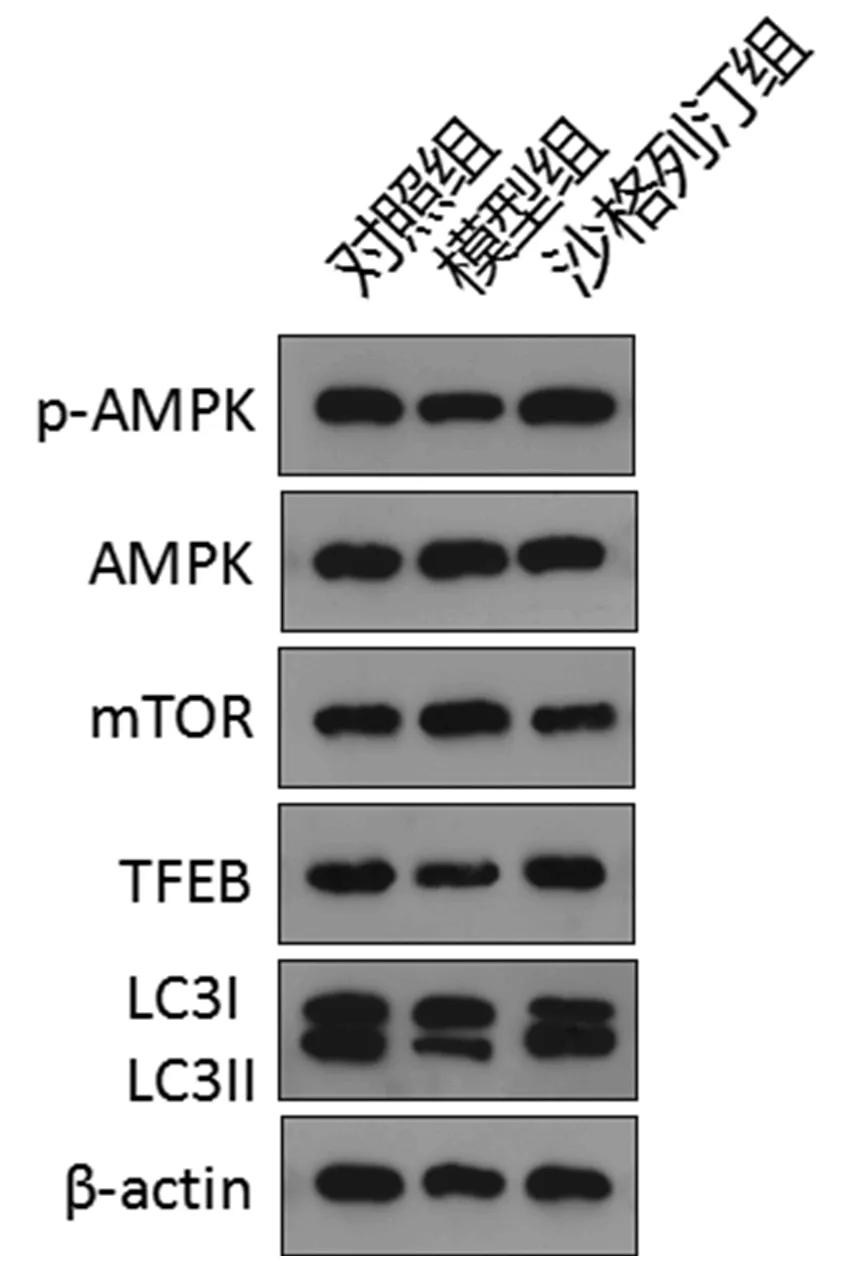
图2 各组大鼠肝组织AMPK/mTOR-TFEB自噬信号通路蛋白表达变化
3 讨论
随着对NAFLD和T2DM研究的不断探索,发现多种因素参与机体糖代谢、炎症反应和胰岛素抵抗等生理病理过程[10-12]。沙格列汀被证实可显著改善机体胰岛素抵抗和炎症反应,减缓NAFLD合并T2DM患者疾病进展[13]。本研究以沙格列汀处理NAFLD合并T2DM大鼠,发现沙格列汀可显著降低模型大鼠血糖和血脂水平,保护肝脏功能。
营养性脂肪肝模型是现阶段国内外最常用的NAFLD大鼠模型的建模方案,具有成功率高、与临床发病机制相似以及适合观察药物干预效果等优点[14]。本研究采用高脂饮食和链脲佐菌素腹腔注射构建NAFLD合并T2DM大鼠模型,再以沙格列汀进行为期8周的灌胃干预,结果显示,沙格列汀可显著降低模型大鼠体质量、肝质量和肝脏指数,抑制大鼠血糖指标如FPG、INS和HOMA-IR,降低血脂水平。沙格列汀能提高内源性胰高血糖素样肽-1和葡萄糖依赖性促胰岛素分泌多肽水平[15],作用于胰岛α和β细胞,抑制胰高血糖素的分泌,促进胰岛素的合成与释放,在有效降糖的同时缓解因高糖导致的胰岛素敏感性下降,加速新陈代谢,促进外周脂肪分解,降低了游离脂肪酸含量,阻止脂质沉积于肝组织[16],发挥保护肝功能的作用。
AMPK/mTOR-TFEB自噬信号通路是与细胞自噬有关的经典通路。细胞自噬作为不同于凋亡的细胞死亡过程,通过清除破损的蛋白或细胞器维持细胞的完整性[17]。细胞自噬不仅参与调节多种恶性肿瘤的发生和发展,还与肝脏、骨骼肌和皮下脂肪等靶组织对于胰岛素反应的调节机制有关,能介导胰岛素抵抗引起的高糖损伤[18]。本研究结果发现,沙格列汀通过激活肝组织AMPK磷酸化水平,抑制下游分子mTOR表达,上调TFEB和自噬标记蛋白LC3B-II表达,抑制了NAFLD合并T2DM的疾病进展。NAFLD合并T2DM大鼠肝组织含有大量的非脂质碳源和脂质沉积,沙格列汀通过激活AMPK磷酸化水平,影响三磷酸腺苷酶合成和代谢,维持细胞能量的稳态平衡[19],靶向并抑制其下游基因mTOR分子的活化,并作用于溶酶体内重要脂质调控因子TEFB,影响溶酶体对于亚细胞碎片的清除能力和自噬转录调控效应,使自噬标记蛋白由LC3I向LC3II转化,激活细胞自噬反应[20],维持了脂质稳态平衡。

