LncRNA HOXD-AS1在斑马鱼异种移植模型对肝细胞癌细胞增殖和迁移能力的影响*
张 缨,江龙委,秦 峰,贾绍昌
近年来,越来越多的研究者使用患者来源的斑马鱼异种移植(zebrafish patient derived xenograft,zPDX)研究肿瘤的发生[1-3]。一些zPDX 模型也成功建立[4,5]。与小鼠异种移植模型比,透明斑马鱼幼虫异种移植模型可以在活体内直接观察移植的癌细胞,能同时研究肿瘤的生长和迁移[1,6]。肝细胞癌(hepatocellular carcinoma,HCC)严重威胁着人类健康,每年新发HCC病例约为80万例[7]。尽管已有各种新的治疗方法被用于治疗HCC患者,但总体生存率仍然很低[8],主要是由于手术切除后肿瘤容易复发和迁移,导致HCC患者病死率居高不下[9]。长链非编码核糖核酸(long non-coding RNA,lncRNA)是一类非编码转录物(>200 个核苷酸)[9]。越来越多的研究证明,lncRNA在多种生理和病理学过程中发挥着重要作用[10],包括HCC细胞的生长、迁移和耐药过程[11]。近期研究表明,一些lncRNA在HCC细胞迁移过程中存在竞争性内源性RNA(competing endogenous RNA,ceRNA)机制[12-14]。同源异形基因D簇反义核糖核酸1 (HOXD cluster antisense RNA 1,HOXD-AS1,也被称为 HAGLR)是一种lncRNA,可以作为神经母细胞瘤进展的标志物[15]。它是人类染色体2q31.2上的HOXD簇以反义方式转录的,包含八个外显子[15]。已有研究证明,HOXD-AS1可以作为与miRNA结合的ceRNA在HCC、肺癌、卵巢癌、胶质瘤、乳腺癌、结直肠癌、胆管癌和宫颈癌等多种癌症中发挥作用[15,16]。但是,这些研究都缺乏直观的体内证据,而zPDX可为lncRNA研究提供快速直观的癌症迁移模型[17]。我们尝试使用zPDX模型建立了lncRNA体内研究方法。
1 资料与方法
1.1 斑马鱼的养殖 将成年斑马鱼(南京歆佳医药科技有限公司)维持在 28℃鱼类自动培养系统(中国海神公司)。本研究使用了AB 野生型和Tg(fli1a:EGFP) 转基因斑马鱼。
1.2 细胞培养 采用HCC细胞系HepG2、Hep3B、Huh7和正常肝细胞系LO2细胞,所有细胞均于 2019年购自中国上海寸迈生物科技有限公司,均通过微卫星DNA(microsatellite DNA,STR)测试验证,经PCR法检测支原体阴性。
1.3 细胞RNA提取和qRT-PCR检测 常规提取细胞RNA,基因特异性引物的序列为,HOXD-AS1-F: 5′-ATTCGTCTGACTTGGCTCTT-3′;HOXD-AS1-R: 5′-CCTGTTTTGACCTTTTCCTG-3′;GAPDH-F:5′-GGGAGCCAAAAGGGTCAT-3′; GAPDH-R:5′-GAGTCCTTCCACGATACCAA-3′。
1.4 siRNA和miRNA抑制剂转染细胞 使用 Lipofectamine 3000试剂(Thermo Fisher Scientific,美国)转染细胞特定的siRNA或miRNA抑制剂。我们从General Biosystems(中国)购买了两种HOXD-AS1 siRNA、miR-130a-3p抑制剂和阴性对照(negative control,NC)siRNA。HOXD-AS1 siRNA 序列如下[16]:si1-HOXD-AS1:5′-GAAAGAAGGACCAAAGTAA-3′;si2-HOXD-AS1:5′-GCACAAAGGAACAAGGAAA-3′;NC siRNA序列是 5′-TTCTCCGAACGTGTCACGT-3′。
1.5 细胞增殖实验 使用细胞计数试剂盒-8(CCK-8,DOJINDO,日本)进行细胞增殖测定。
1.6 细胞侵袭试验 用HOXD-AS1和NC siRNA转染Hep3B和Huh7细胞。用Transwell法检测侵袭情况。
1.7 zPDX模型的建立 注射前,将肝癌细胞Hep3B和Huh7(中国上海寸迈公司)用荧光染料CM-DiI(Invitrogen,美国)标记。方案如下:收集细胞,用HBSS洗涤3次。将细胞用CM-DiI在37℃下标记5 min,再在4℃下标记15 min。用HBSS漂洗3次,去除未结合的染料,即制备好了标记的细胞。将标记的癌细胞注射到受精后48 h的斑马鱼幼虫的卵周间隙(perivitelline space,PVS)。将每条斑马鱼幼虫固定在1.2%低熔点凝胶中,通过微量注射器将约300~400个细胞植入PVS。注射后,将斑马鱼幼虫异种移植物在34℃培养至实验结束。在注射后1d,选择成功注射的具有相似肿瘤大小的异种移植物用于以下实验。
1.8 斑马鱼体内成像和定量分析 在注射后第4 d,将斑马鱼幼虫安装在1.2%低熔点凝胶中,通过立体显微镜(MVX10,Olympus,日本)或使用20×水浸物镜(Fluoview 3000,Olympus,日本)的共聚焦显微镜拍摄图像。图像的空间分辨率为1600×1200(MVX10)或1024×1024像素(Fluoview 3000)。应用ImageJ软件对图像进行定量分析。

2 结果
2.1 HCC细胞HOXD-AS1呈高水平 经qRT-PCR检测显示,HepG2、Hep3B 和 Huh7细胞HOXD-AS1水平分别显著高于LO2 细胞(65.6±5.7)、(4.6±0.5)和(23.4±1.0)倍(P<0.001);在转染siRNA 24 h后,与NC细胞比,第一条siRNA(si1-HOXD-AS1)在HepG2、Hep3B和Huh7细胞对HOXD-AS1的敲减率分别为40.9%、96.6%和75.7%,第二条siRNA(si2-HOXD-AS1)的敲减率分别为3.9%、41.0% 和 45.2%。基于敲低效率数据,我们选择Hep3B和Huh7 细胞进行下一步研究。
2.2 敲低HOXD-AS1在体外和体内抑制Hep3B细胞增殖和迁移 在转染si1-HOXD-AS1后,Hep3B细胞增殖活性显著降低,而在转染si2-HOXD-AS1后细胞增殖水平并无显著变化(图1A)。经Transwell实验结果显示,敲低HOXD-AS1后Hep3B细胞每视野细胞数为49.6±3.9,显著低于对照组的221.8±63.3(P<0.01),提示敲低HOXD-AS1后Hep3B细胞侵袭能力受到抑制(图1B)。在zPDX实验结果显示,代表细胞增殖的蛋黄CM-DiI阳性信号量化区域信号为对照组的56.0±12.0%(P<0.01),提示敲低体内HOXD-AS1降低了Hep3B细胞的增殖能力(图1C~E)。代表迁移的躯干CM-DiI阳性信号为对照的49.0±8.9%(P<0.05),提示在体内敲低HOXD-AS1也降低了Hep3B细胞的迁移(图1F~H)。
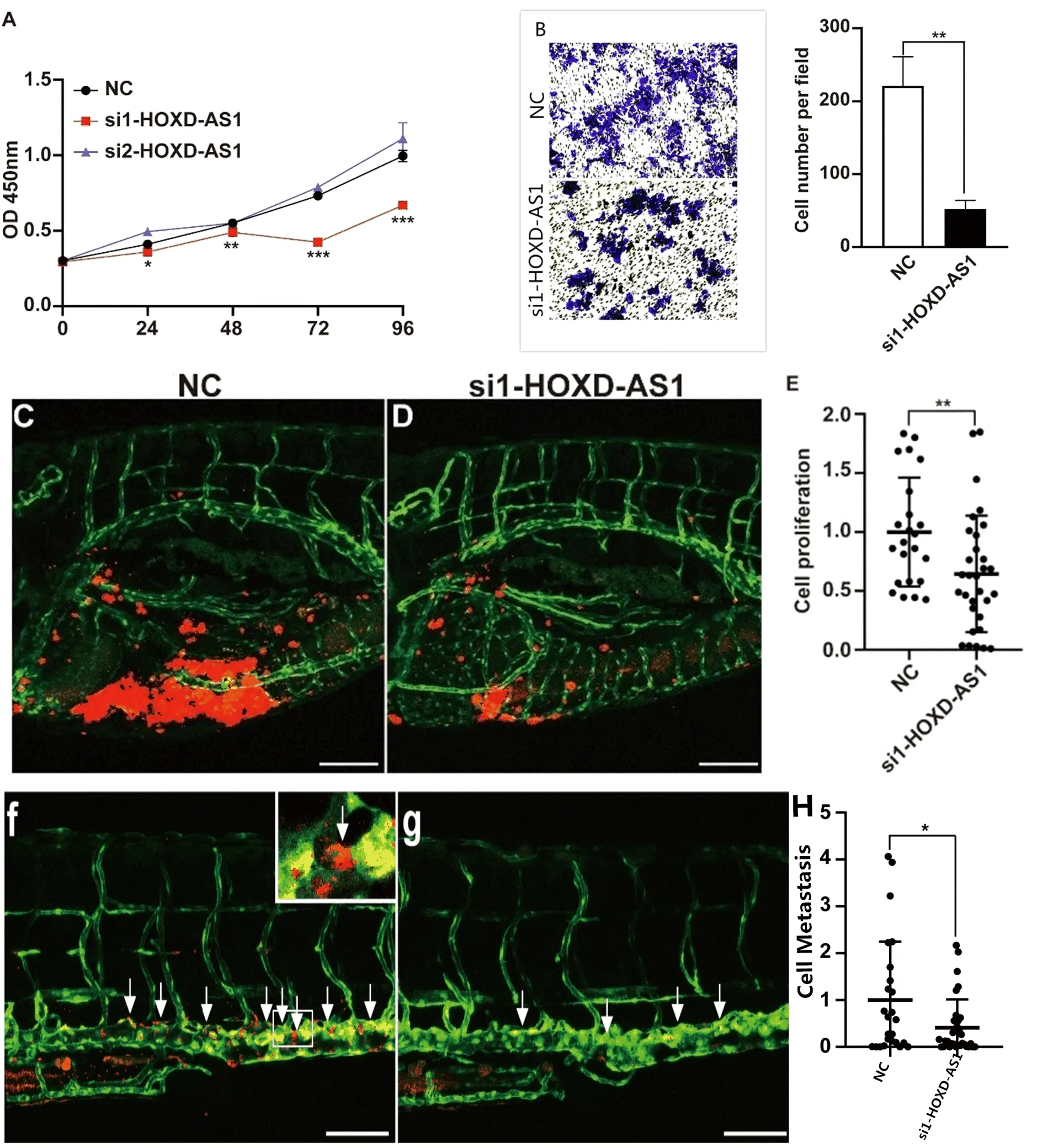
图1 敲低HOXD-AS1抑制Hep3B细胞增殖和迁移A:转染HOXD-AS1或NC siRNA后Hep3B细胞增殖;B:转染HOXD-AS1或NC siRNA后Hep3B细胞侵袭;C:经HOXD-AS1或NC siRNA转染的Hep3B细胞注射到2-dpf Tg(fli1a:EGFP)斑马鱼幼虫的PVS;D:使用共聚焦显微镜以每英寸点数(dots per inch,dpi)拍摄蛋黄图像,显示量化蛋黄CM-DiI阳性区域增殖情况;E:C图和D图信号统计分析;F/G:使用共聚焦显微镜以4dpi拍摄躯干图像,量化躯干CM-DiI阳性区域的迁移情况(箭头代表一些迁移细胞。该区域的放大视图显示了典型的迁移细胞;H:F图和G图信号统计分析大小:100 μm。*:P<0.05,**:P<0.01
2.3 敲低HOXD-AS1在体外和体内抑制Huh7细胞增殖和迁移 与Hep3B细胞实验相同,在Huh7细胞转染si1-HOXD-AS1后,仅在72 h细胞增殖活性降低,为对照组的68.2±15.4%(P<0.001),其余时间点均无显著差异,但Transwell实验结果显示,敲低HOXD-AS1后Huh7细胞每视野细胞数为54.2±15.2,显著低于对照组的226.8±26.3(P<0.01),提示敲低HOXD-AS1抑制了Huh7细胞的侵袭。在zPDX实验结果显示,代表细胞增殖的蛋黄CM-DiI阳性信号为对照组的46.5±16.8%(P<0.01),提示在体内敲低HOXD-AS1降低了Huh7细胞增殖。代表迁移的躯干中CM-DiI阳性信号为对照组的41.9±10.2%(P<0.01),提示在体内敲低HOXD-AS1也降低了Huh7细胞的迁移能力。
2.4 敲低miR-130a-3p可促进体外和体内HCC细胞迁移 为了进一步研究HOXD-AS1在HCC迁移过程中的作用,我们选择与其竞争性结合的miRNA之一miR-130a-3p进行验证。在miR-130a-3p被其抑制剂敲低后,Huh7细胞每视野细胞数为39.0±9.2,显著高于对照组的24.4±7.2(P<0.001),提示Huh7细胞的侵袭能力显著增强(图2A)。将miR-130a-3p抑制剂转染的细胞移植到斑马鱼幼虫后,躯干CM-DiI阳性细胞也显著增多,为对照组的187.8±42.7%(P<0.05,图2B)。
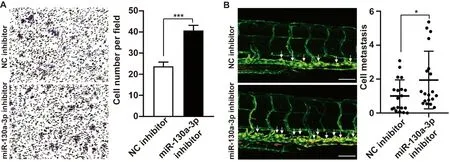
图2 抑制miR-130a-3p提升Huh7细胞的迁移能力A:转染miR-130a-3p抑制剂或NC抑制剂后Huh7细胞侵袭能力变化;B:将经miR-130a-3p抑制剂或NC抑制剂转染的Huh7细胞注射到2-dpf Tg(fli1a:EGFP)斑马鱼幼虫的PVS,量化躯干CM-DiI阳性区域的迁移情况大小:100 μm。*:P<0.05,***:P<0.01
2.5 敲低miR-130a-3p在Huh7细胞挽救因HOXD-AS1下调导致的细胞迁移能力下降 本研究将si1-HOXD-AS1和miR-130a-3p抑制剂共转染Huh7细胞,检测体内外细胞迁移能力。结果显示,共转染组、si1-HOXD-AS1组和NC组每视野细胞数分别为78.2±15.3、39.3±9.5、79.4±18.3,差异显著(P<0.01),提示在体外敲低miR-130a-3p能挽救因HOXD-AS1下调导致的细胞迁移能力下降(图3A)。在zPDX中,si1-HOXD-AS1组和共转染组CM-DiI阳性细胞分别为NC组的48.9±13.5%(P<0.05)和109.4±24.9%(P>0.05,图3B)。
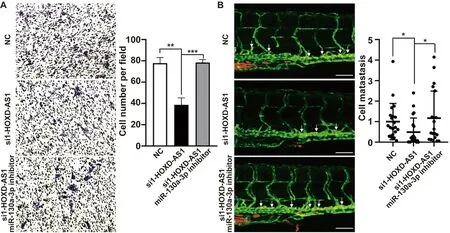
图3 抑制miR-130a-3p能挽救因HOXD-AS1下调导致的细胞迁移能力下降A:共转染si1-HOXD-AS1和miR-130a-3p抑制剂后Huh7细胞侵袭能力变化;B:在zPDX检测共转染si1-HOXD-AS1和miR-130a-3p抑制剂后Huh7细胞在体内的迁移能力大小:100 μm。*:P<0.05,**:P<0.01
3 讨论
在本研究,我们首先利用zPDX验证了HOXD-AS1在不同HCC细胞呈高水平。接着,在体外培养细胞和zPDX沉默HOXD-AS1基因,评估肝癌细胞增殖和侵袭能力,检测与HOXD-AS1竞争结合的miR-130a-3p在肿瘤迁移中的作用,我们发现抑制miR-130a-3p可以挽救肝癌细胞迁移,体外和体内敲低HOXD-AS1基因可降低肝癌细胞迁移,表明zPDX可能是一种可靠的人类癌症迁移实验模型[17]。
与小鼠模型比,zPDX在肿瘤生物学方面显示出更多的优势[18,19]。在移植后4天内,通过zPDX可以检测HOXD-AS1对细胞迁移的作用,而小鼠模型至少需要4周。本文主要研究肝癌细胞的迁移,也可分析细胞增殖。结合不同的转基因斑马鱼系,还可以研究肝癌细胞微环境,例如Tg(fli1a:EGFP)转基因系可以用于研究肿瘤血管生成。在本研究,我们发现了Hep3B和Huh7细胞之间的生长差异,因为Huh7细胞生长方式比Hep3B细胞更集中。
最近的研究表明,一些lncRNA,如ceRNA,可以通过与miRNA竞争性结合调节miRNA靶标水平,从而影响肿瘤的进展[20]。本文同样证实了敲低HOXD-AS1的ceRNA之一miR-130a-3p可以促进HCC细胞迁移,而敲低HOXD-AS1能抑制HCC细胞迁移。同时,敲低miR-130a-3p可以在体内外挽救因HOXD-AS1下调导致的细胞迁移能力下降。

