MRI与4DCT联合指导勾画原发性肝癌患者放疗靶区初步研究*
王远平,郑露露,张光亮
原发性肝癌(primary liver cancer,PLC)是一种发病机制尚未明确,但较为常见的恶性肿瘤。近年来,随着人们生活方式和环境的改变,PLC患病群体有增无减[1]。通常,PLC发病早期无明显的症状,易被忽略,到疾病确诊时已病情进展,错失了最佳的手术治疗时机,需寻找其他有效方法进行治疗。放疗是治疗中晚期PLC的有效方法,可局部放射杀灭病灶肿瘤组织,但肝脏对于放疗的耐受性较差,易出现不可逆转的放射性肝损伤(radiation-induced liver disease,RILD),故放疗前需开展相应的影像学检查以判定靶区[2-4]。电子计算机断层扫描(computed tomography,CT)是放疗前勾画PLC病灶靶区的重要依据,但四维计算机断层扫描(4 dimensional computed tomography,4DCT)在扫描时耗时较长,且难以掌握具体的扫描强化时机,部分4DCT图像易出现强化信息丢失,给勾画放疗靶区和制定放疗计划带来不良影响。磁共振成像(magnetic resonance imaging,MRI)相对于CT具有更好的组织分辨能力,且MRI检查中的T2加权像(MR-T2)图像清晰,在诊断和鉴别诊断肝肿瘤方面表现出较好的效果。目前,已有学者将MRI应用于PLC患者放疗前靶区的勾画[5,6]。本研究联合应用MRI与4DCT检查图像勾画PLC患者病灶放疗靶区,尝试运用MR-T2与4DCT联合勾画,观察了放疗疗效情况,现报道如下。
1 资料与方法
1.1 一般资料 2019年5月~2021年5月我院收治的PLC患者56例,男35例,女21例;年龄为45~66岁,平均年龄为(55.8±7.2)岁。依据《原发性肝癌诊疗规范》[7]的标准诊断。排除标准:(1)既往有肝脏手术治疗史或放疗前已接受过放疗、化疗、靶向治疗;(2)存在4DCT或MRI检查禁忌证;(3)合并严重的心肺肾功能障碍;(4)存在凝血功能异常;(5)Child-Pugh C级;(6)Karnofsky评分<60分;(7)同时合并其他恶性肿瘤;(8)存在精神异常无法配合本研究。本研究获得我院医学伦理委员会批准(2019-17号),患者及其家属签署知情同意书。
1.2 4DCT检查 使用飞利浦Brilliance大孔径螺旋CT机。检查开始前,于患者腹部放置一块荧光标记模板,在扫描床尾放置红外摄像机,用于采集模块运动轨迹,经计算机软件处理后形成患者呼吸曲线。检查时,患者取仰卧位,双手上举。扫描范围为隔上3~4 cm至右肾下极。具体参数设置如下:管电流120 KV、管电压300 mAs、层厚3 mm,Varian呼吸门控制RPM系统。在检查结束后,借助4D软件对不同周期信号图像进行排序,并命名为CT00、CT10、CT20、CT30、CT40、CT50……CT90,其中CT00为吸气末时相,CT50为呼气末时相,剩余为呼吸中间时相。
1.3 MRI检查 使用飞利浦Ahieva 3.0T磁共振和腹部相控阵列线圈。检查时,患者取仰卧位,双手置于身体两侧。扫描肺下叶至双肾下极。于深呼吸状态下行T2加权像扫描。扫描参数设置如下:T2WI:TR为3000~4000 ms、TE为96~104 ms、层厚5 mm、回拨链长度16、FOV为38 cm、矩阵320×256;呼吸触发(b值为0或800 s/mm):TR为4000 ms、TE为73 ms、FOV为38 cm、矩阵160×120、带宽2442Hz/Px、像素大小为3.7×3.0 mm。
1.4 图像变形配准与精度观察 在4DCT和MRI检查结束后,将获得图像上传至MIM(Vesion6.5.6)工作站,于变形配准工具辅助下以VoxAlign算法对图像进行配准。在完成刚性配准后,行自动变形配准。配准时,目标图像为MR-T2图像,参考不同时相4DCT图像。在自动配准结束后,应用Reg Reveal和Reg Refine软件行图像质量和配准评估,锁定局部感兴趣区,最后手动微调获得融合图像的最佳配准效果。对4DCT不同时相和MR-T2图像,逐层勾画肝脏,计算肝脏体积,同时以MR-T2图像和4DCT图像中肝脏体积占比评估图像变形配准精度。勾画门静脉和腹腔干动脉,依据三维方向门静脉和腹腔干中心移位情况评估图像变形配准精度,左右方向以X标记,头足方向以Y标记,前后方向以Z标记。分别于4DCT不同时相和MR-T2平扫图像中勾画肿瘤靶区,通过变形配准后将4DCT不同时相肿瘤靶区进行融合,形成配准前后的大体内靶区。

2 结果
2.1 腹部CT和MRI表现及其变形配准 见图1。
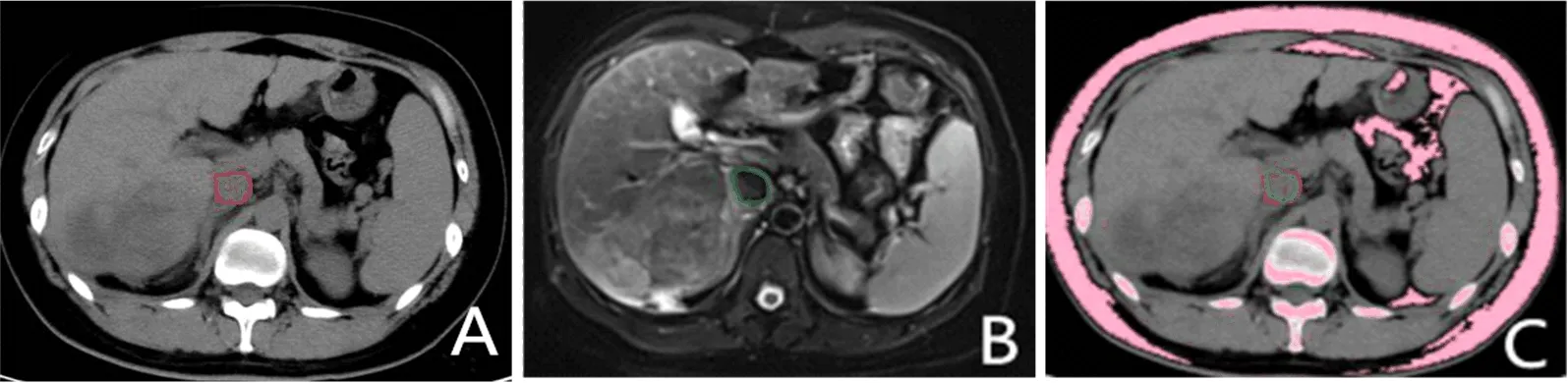
图1 PLC患者腹部CT和MRI表现A:CT扫描; B:MR-T2扫描;C:融合图像
2.2 配准前后肿瘤靶区体积比较 在配准后,肿瘤靶区体积显著大于配准前(P<0.05,表1、图2)。

表1 配准前后肿瘤靶区体积比较
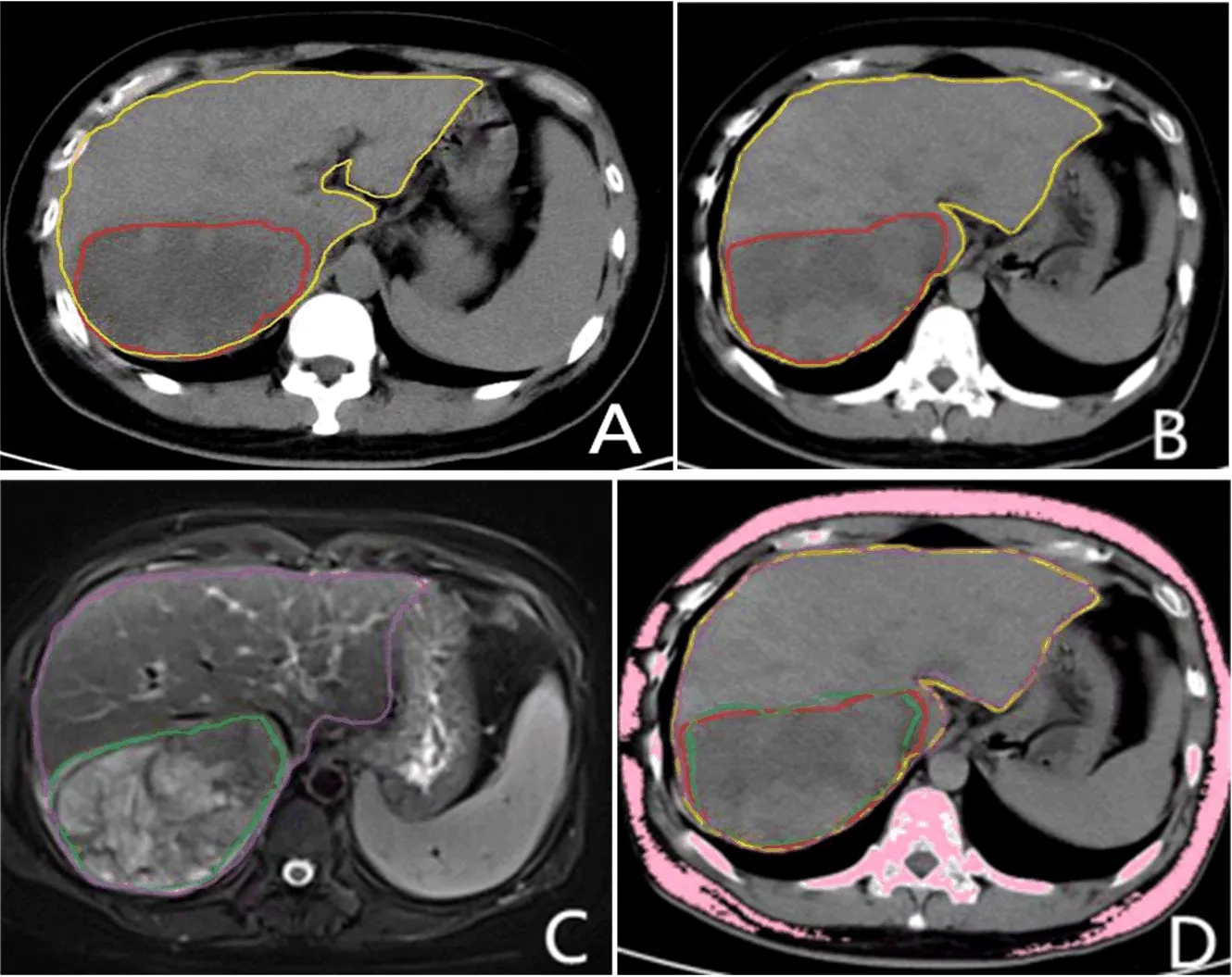
图2 PLC患者4DCT平扫和MR-T2平扫肿瘤靶区勾画A:4DCT扫描T00时相;B:4DCT扫描T50时相;C:MRI扫描图像;D:配准后图像
2.3 配准前后大体内靶区比较 56例PLC患者配准前大体内靶区体积为(410.5±192.5)cm3,配准后为(468.7±226.2)cm3,配准后大体内靶区体积显著大于配准前(P<0.05)。
2.4 不同配准精度比较 相对于自动配准,对门静脉或腹腔干行Reg Refine配准后,移位显著缩小(P<0.05,表2),即可获得较高的配准精准度。MR-T2图像显示肝脏体积为(2002.4±843.7)cm3,4DCT图像显示为(2048.7±937.2)cm3,肝脏体积交叠度为(110.2±22.7)%。
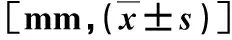
表2 不同配准精度比较
3 讨论
近年来,随着科技水平的快速发展,医疗放射设备和影像学检查技术也得到明显的提高,为肝癌局部靶区放射剂量的确定提供了有价值的帮助。同时,调强放射治疗、体部立体定向放射治疗、粒子治疗等技术的实施也为不能进行手术治疗的PLC患者提供了治疗的选择,有利于改善患者预后[8-10]。不同放疗技术的提出与应用均以增加肝癌患者肿瘤照射剂量、降低正常肝组织照射剂量为目的,但精准放疗前仍需行肿瘤靶区勾画,且放疗技术越精确对于肿瘤靶区勾画的要求也越高,故放疗前选择何种影像学检查图像为肿瘤靶区勾画的依据已成为临床医师关注的热门课题[11,12]。目前,CT和MRI已应用于恶性肿瘤靶区的勾画,而本研究为寻找PLC患者放疗前靶区勾画的有效方法将MR-T2联合4DCT指导勾画放疗靶区,观察其在PLC患者首次放疗时的应用价值。
4DCT可通过红外线监测患者呼吸曲线,再依据呼吸信号行容积扫描,获取靶区和有关器官的动态CT图像,但4DCT应用时也存在一定的不足,如4DCT需行10个呼吸时相扫描,在增加扫描时间的同时相对于常规CT也增加了患者吸收的辐射剂量。另外,长时间的扫描患者呼吸运动也会导致运动伪影的出现。因此,为确保图像质量,患者需接受相应的呼吸训练。然而,并不是所有患者都适合行呼吸训练,也限制了4DCT技术的应用[13,14]。现阶段,MRI已应用于多种恶性肿瘤靶区的勾画,如食管癌、盆腔肿瘤等。相对于CT检查,MEI可更加清晰地分辨肿瘤、周围组织及肿瘤累及的范围,在疾病诊断和鉴别方面可更有效,及早发现病变,在勾画肿瘤靶区时有利于确定肿瘤边界、精确勾画肿瘤靶区[15]。本研究结果显示,配准后4DCT不同时相图像显示的肿瘤靶区体积显著大于配准前,提示给PLC患者放疗前采用MR-T2联合4DCT检查可提高勾画肿瘤靶区的精度。MR-T2能清晰显示软组织信息,补充了4DCT检查时因患者呼吸运动造成图像运动伪影的不足,为精确勾画肿瘤靶区提供了帮助,从而提高了勾画精度[16]。
不同影像学检查方法获取的图像存在一定的差异。在4DCT检查时,患者是在自由呼吸状态下接受检查,而MR-T2检查时患者要在深吸气状态下接受检查,导致两种检查肝脏形态存在微细的差别,两种检查方法在检查时间上也存在差别,可导致检查显示的内脏器官位置、充盈度存在差别。因此,有必要对MR-T2和4DCT图像采取一定的措施进行处理。MIM工作站可通过VoxAlign算法实现图像变形配准,促使两种检查方法图像对应点到达空间、解剖位置的一致。另外,在行配准结束后还能在Reg Reveal和Reg Refine辅助下对图像质量进行观察和评估[17,18]。应用Reg Refine进行图像变形配准可将方向误差缩小至1 mm以内,充分显示了Reg Refine的应用价值[19,20]。

