血浆纤维蛋白原、中性粒细胞/淋巴细胞比值评估Guillain-Barrés综合征严重程度的预测价值
孙广鑫,时鹏,杜苑苑,屈洪党
Guillain-Barré综合征(GBS)是一种自身免疫介导以炎性细胞浸润为主导致周围神经脱髓鞘以及轴索变性的疾病[1]。GBS患者病情较重者,往往需要卧床或机械通气,甚至出现死亡,病死率可达5%[2]。在疾病初期通过容易获取的血液学指标,筛选出预测GBS严重程度的标志物显得尤为重要。国内研究[3]表明,CSF蛋白含量与GBS疾病严重程度相关,但CSF的获取在临床中较为困难,而外周血样本的实验室检查相对容易的多。研究显示,中性粒细胞/淋巴细胞比值(NLR)是多发性硬化和视神经脊髓炎谱系病复发以及严重程度的独立预测因素[4-5];并且视神经脊髓炎谱系病急性期血浆纤维蛋白原(FIB)含量增高与疾病严重程度呈正相关[6]。目前国内外学者对血浆FIB、NLR等相关指标与GBS疾病严重程度的研究较少,本研究通过回顾性分析109例GBS患者的一般临床资料,探讨其与GBS患者疾病严重程度的关系。
1 对象与方法
1.1 对象 收集2016年1月至2020年12月蚌埠医学院第一附属医院住院确诊的首次发病且入院后行免疫治疗的GBS患者共109例。GBS的诊断需符合《中国吉兰-巴雷综合征诊治指南2019》的标准[7],并根据神经电生理结果将GBS分为脱髓鞘型和轴索型。排除标准:Miller-Fisher综合征、急性泛自主神经病、有毒性物质所致的周围神经病、糖尿病性周围神经病、慢性炎性脱髓鞘性多发性神经根神经病、CNS脱髓鞘疾病者;既往长期卧床、慢性阻塞性支气管炎急性发作的患者;患有严重心力衰竭、恶性肿瘤的患者。病情等级评定根据患者行免疫治疗前的病情,采用休斯功能分级量表(HFGS)进行GBS病情等级评估:0分则为正常健康者;1分有轻微临床症状,但是可以跑;2分为可在无辅助下行走10 m;3分为可在辅助下行走10 m;4分为需要卧床或依赖轮椅;5分为需要机械通气;6分为死亡。将所有患者按住院治疗前HFGS评分分为两组,评分0~3分为轻度组患者(n=66),4~6分为中重度组患者(n=43)。
1.2 方法
1.2.1 资料收集 收集与免疫治疗前疾病严重程度相关的临床资料。一般临床资料包括:患者年龄、性别、前驱感染史、发病至免疫治疗时间、免疫治疗前HFGS评分、神经电生理分型、首发受累症状;实验室资料包括:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白、总胆固醇(TC)、三酰甘油、C反应蛋白(CRP)、FIB、D-二聚体、中性粒细胞计数、NLR、血小板/淋巴细胞比值(PLR)等血液学指标。

2 结 果
2.1 两组间一般临床资料的比较 见表1。轻度组与中重度组年龄、免疫治疗前HFGS评分差异有统计学差异(均P<0.05),轻度组与中重度组性别、前驱感染史类型、发病至免疫治疗时间、神经电生理分型、首发受累症状差异均无统计学意义(均P>0.05)。

表1 两组患者一般临床资料比较[x±s,例(%)]轻度组(n=66)中重度组(n=43)χ2/t值P值年龄(岁)49.40±17.6260.81±14.233.5540.001性别0.0410.084 男34(51.5)23(53.4) 女32(48.5)20(46.6)前驱事件 上呼吸道感染史23(34.8)16(37.2)0.0630.802 腹泻史5(7.5)6(13.9)1.1670.280 疫苗接种史1(1.5)1(2.3)1.000a发病至免疫治疗时间(d)12.24±9.0711.04±6.710.7140.460免疫治疗前HFGS评分(分)1.56±0.944.47±0.6319.2250.001神经电生理分型 脱髓鞘型40(60.6)31(72.1)1.5121.219 轴索型26(39.4)12(27.9)1.5121.219首发受累症状 运动障碍35(53.0)27(62.8)1.0110.315 感觉异常24(36.3)9(20.9)2.9380.087 颅神经异常7(10.5)7(16.3)0.7490.387 注:a为Fisher的精准检验
2.2 两组实验室检查结果的比较 见表2。轻度组与中重度组之间的白蛋白、三酰甘油、CRP、FIB、D-二聚体、中性粒细胞计数、淋巴细胞计数、NLR及PLR差异均有统计学意义(均P<0.05),ALT、AST、TC及血小板计数差异均无统计学意义(均P>0.05)。

表2 两组实验室指标的比较[M(Q25,Q75), x±s]观察指标轻度组(n=66)中重度组(n=43)z/t值P值ALT(U/L)24.00(16.00,33.25)28.00(15.00,51.00)0.9990.318AST(U/L)23.00(20.00,31.25)26.00(21.00,34.00)1.5270.127白蛋白(g/L)41.95(39.07,45.22)37.40(33.20,41.20)4.6290.001TC(mmol/L)4.37±0.934.11±0.951.3910.167三酰甘油(mmol/L)1.55±0.871.11±0.523.0510.003CRP(mg/L)1.85(0.70,5.10)7.90(5.00,23.00)4.7720.001FIB(g/L)3.09±0.805.10±1.379.6620.005D-二聚体(mg/L)0.29(0.19,0.62)0.91(0.35,0.91)4.2630.001中性粒细胞计数(×109/L)4.98±2.358.84±4.056.2970.012淋巴细胞计数(×109/L)1.83±0.701.51±0.872.0620.042血小板计数(×109/L)261.56±79.25238.39±105.221.3080.194NLR2.22(1.46,3.34)5.79(3.41,10.93)6.2650.002PLR130.75(106.37,156.87)175.65(108.00,296.88)2.9260.003
2.3 Logstic回归分析 见表3。以上具有统计学差异的相关因素设为变量(中性粒细胞计数、淋巴细胞计数会影响NLR及PLR值,中性粒细胞计数及淋巴细胞不予以纳入自变量),GBS患者是否为中重度组作为因变量,纳入多因素Logstic回归分析。结果显示,血浆FIB和NLR水平是影响GBS疾病严重程度的独立危险因素(均P<0.05)。

表3 多因素Logstic回归分析变量BSEWaldOR95%CIP值年龄0.0480.0253.5271.0490.998~1.1020.060TC-0.0180.1300.0190.9820.761~1.2680.891 三酰甘油-2.1201.2193.0230.1200.011~1.3100.082CRP-0.0360.0242.2580.9650.920~1.0110.133FIB2.3790.8717.45310.7891.956~59.5110.006D-二聚体0.5530.2793.9191.7381.006~3.0040.051NLR0.8040.3246.1412.2341.183~4.2180.013PLR0.0010.0070.0031.0000.985~1.0140.958
2.4 预测GBS严重程度的ROC曲线分析 见图1、表4。血浆FIB预测GBS疾病严重程度的ROC曲线下面积(AUC)是0.912,最佳截断点则是3.61,灵敏度及特异性分别是90.7%、77.3%;NLR预测GBS疾病严重程度的AUC是0.856,其最佳截断点是4.11,灵敏度及特异性分别是72.1%、90.9%。
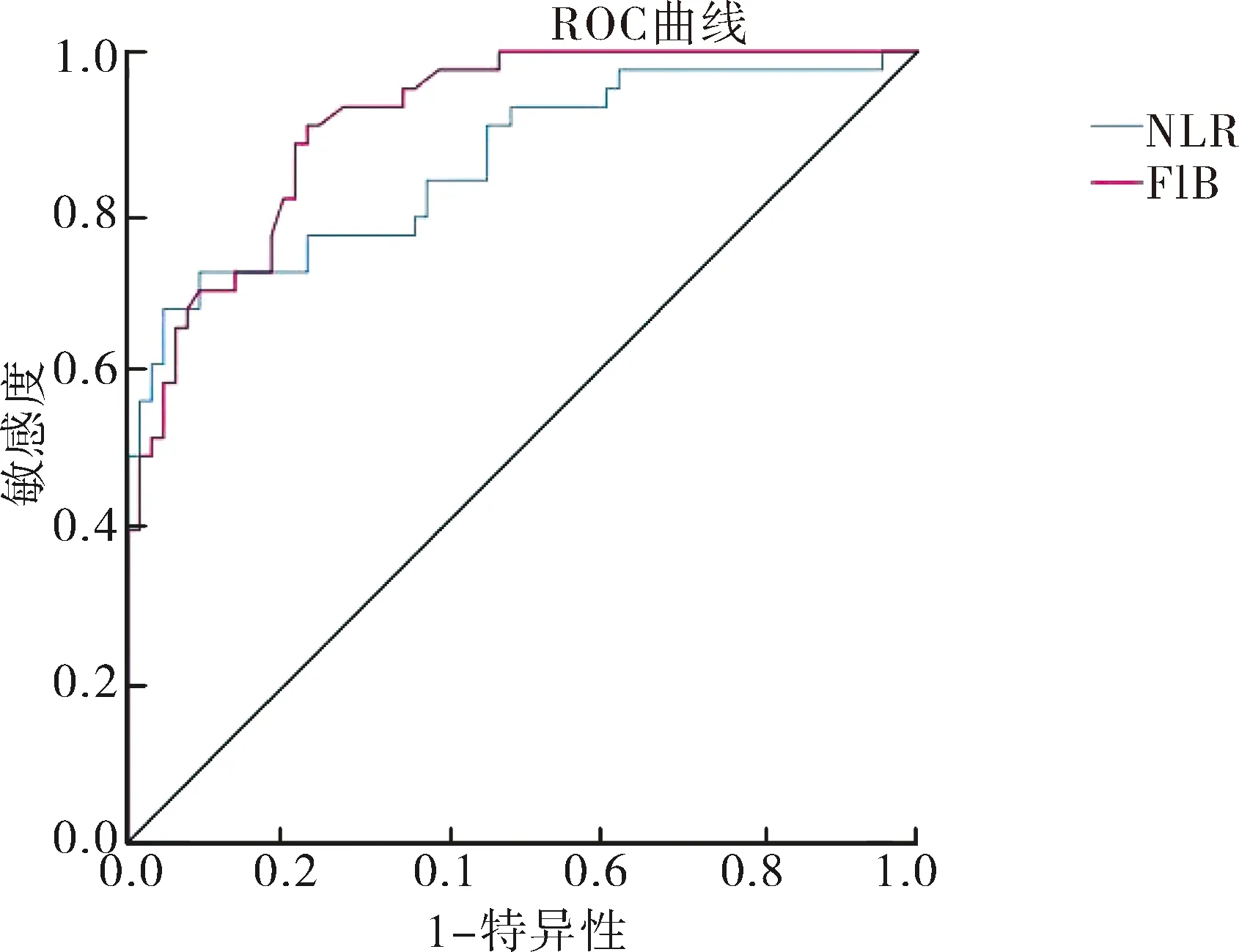
图1 血浆FIB、NLR预测GBS严重程度的ROC曲线

表4 FIB及NLR对GBS严重程度的预测模型分析检验变量AUC约登指数最大值最佳截断点灵敏度%特异性%渐进95%CI下限上限FIB0.9120.6803.610.9070.7730.8620.963NLR0.8560.6304.110.7210.9090.7800.932
2.5 血浆FIB、NLR水平与GBS患者免疫治疗前HFGS评分的相关性分析 血浆FIB水平与治疗前HFGS评分呈正相关(r=0.610,P<0.05),NLR水平与治疗前HFGS评分也呈正相关(r=0.549,P<0.05)。
3 讨 论
本研究发现,血浆FIB、NLR在GBS患者疾病严重程度的上具有良好的预测价值,其机制可能与急性期血-神经屏障破坏,血浆FIB透过血-神经屏障参与GBS急性期炎性反应,其通过介导中性粒细胞、淋巴细胞及巨噬细胞的活化,导致疾病严重程度加重。血浆FIB、NLR与GBS患者治疗前HFGS评分呈正相关,血浆FIB、NLR水平越高,疾病程度越严重,局部炎性反应可能越剧烈。FIB是急性炎性产物之一,FIB通过与免疫细胞表面CD11b/CD18整合素受体结合,介导炎性细胞信号的产生,促使中性粒细胞及巨噬细胞的黏附、迁移和吞噬,使周围神经局部区域炎症反应加重[8]。
NLR在GBS患者疾病程度中具有良好的预测价值,其AUC是0.856,最佳截断点则为4.11,OR值为2.23,表示高NLR的GBS患者病情较重的风险是低NLR患者的2.23倍,与相关研究[9]结果一致。而性别、前驱感染史类型、电生理分型与疾病严重程度差异无统计学意义。白细胞数量是衡量全身炎症的重要指标之一,其中中性粒细胞及淋巴细胞是固有免疫反应的关键因素。Berciano等[10]在GBS患者脊髓根部切片中发现,脱髓鞘神经根处可见巨噬细胞介导的中性粒细胞及T淋巴细胞浸润。其可能的发生机制是巨噬细胞分泌的巨噬细胞炎症蛋白1β、炎症蛋白2及趋化因子等作用于中性粒细胞及淋巴细胞,促进中性粒细胞变形迁移至细胞外基质,浸润于神经外膜和神经内小血管,同时促使T淋巴细胞分泌特异性神经节苷脂抗体,识别周围神经靶点,导致整个神经的节段性脱髓鞘或轴索变性改变。同时NLR还被用于预测GBS患者预后等方面的研究[11]。Ozdemir[12]的研究表明,NLR值的降低可能提示经典型GBS的存在;并且Tunç[13]的研究结果提示高NLR与GBS患者的预后不良有关,以上观点可在后续的研究中进一步展开探讨。
血浆FIB预测GBS疾病严重程度的AUC是0.912,具有很高的预测价值,其最佳截断点则是3.61,OR值为10.78,表示高FIB血症的患者发展为中重度的风险是FIB水平较低者的10.78倍。FIB的升高和沉积常见于多种神经系统疾病,比如急性脑梗死、多发性硬化、视神经脊髓炎谱系疾病以及自身免疫性脑炎等[14]。血浆FIB是GBS炎性产物之一,其FIB是机体凝血通路中的关键因子,决定血液的流速及黏稠度。血浆FIB的增高可导致血小板聚集及血栓形成,使神经血管缺血缺氧,加重周围神经的损伤;同时还可损伤微血管内皮细胞致血-神经屏障的破坏,致FIB渗出并沉积在微血管外[15]。FIB的沉积不仅是血-神经屏障破坏的标志物,而且还是介导炎性脱髓鞘的主要调节因子。在GBS炎症反应过程中,血管内皮细胞收缩使FIB透过血-神经屏障,并进入细胞外基质引起FIB的沉积,FIB与免疫细胞表面整合素受体CD11b/CD18结合,引起广泛的细胞信号反应,如丝裂原活化蛋白激酶/磷脂酰肌醇3-激酶的激活,介导巨噬细胞及中性粒细胞的黏附与迁移,使其在神经血管周围聚集,导致周围神经髓鞘的吞噬及轴索损伤[16]。研究[17]发现多发性硬化轴突损伤区域与FIB的沉积相关。此外FIB还是影响周围神经再生的因素,周围神经再生是施旺细胞、周围细胞外基质、血管和轴突四者相互作用的结果。FIB的沉积改变了周围神经细胞外基质的成分,使再生环境发生变化。有研究[18]发现,再生周围神经细胞外基质成分中富含纤维连接蛋白,纤维连接蛋白可介导施旺细胞向受损部位的定向移动;而不能再生的神经细胞外基质中主要含有大量FIB。FIB影响周围神经再生的可能机制为:其一,FIB诱导施旺细胞调节蛋白激酶磷酸化抑制周围神经再髓鞘化;其二,FIB可通过直接抑制纤维连接蛋白的表达,并且还可与纤维连接蛋白竞争结合施旺细胞表面精氨酸-甘氨酸-天冬氨酸序列依赖性的整合素受体,二者共同影响施旺细胞向受损轴突的定向迁移[19]。在我国视神经脊髓炎的相关研究[20]中发现,血浆FIB水平与视神经脊髓炎急性期严重程度呈正相关,应用安克洛酶降低FIB可以减轻炎症反应并促进髓鞘的再生。新的FIB上游基因抑制剂也可以改善周围神经损伤部位的再生环境,为神经系统疾病的治疗开辟了新的方向[21]。
本研究发现,血浆FIB及NLR与GBS疾病严重程度呈正相关,所以在临床研究中降纤等方法可能为治疗GBS提供新的方向。本研究为回顾性研究,其不足之处在于未对GBS患者进行随访,无法获得患者预后及血浆FIB等多项资料,需在以后更多的前瞻性研究中进一步展开。

