肌成纤维细胞来源外泌体介导主动脉缩窄后心脏重构的作用
陆佳 蔡利栋 吴晓宇 丁羽 巩超
成纤维细胞与心肌细胞是心脏内2 种含量最丰富的细胞类型[1-2]。正常情况下,成纤维细胞在心肌细胞增殖分化、电信号扩布以及机械应力的传导中发挥重要作用[3-5]。然而,在某些疾病状态下,如急性心肌梗死、炎性反应、高血压等,心脏组织内儿茶酚胺类物质及某些促炎性因子如转化生长因子-β1(TGF-β1)、白细胞介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)的表达水平异常可以导致心脏内静止状态的心脏成纤维细胞激活,使成纤维细胞的生物学性状发生显著改变[6-8]。在这种情况下,心脏内成纤维细胞与心肌细胞之间的生理平衡势必发生改变。外泌体是一种直径为30~150 nm 的微小囊泡状结构,在细胞间的信号传递中发挥着重要的作用[9-10]。本研究拟通过小鼠动物模型,研究成纤维细胞来源外泌体对主动脉缩窄(TAC)后心脏重构的影响。
1 材料与方法
1.1 主要仪器与试剂
小动物呼吸机(DW-2000 型)购自中国上海伟业医疗公司;雷卡倒置荧光显微镜、小动物气体麻醉机购自美国 Leica 公司;小鼠源抗肌动蛋白抗体购自美国Abcam 公司;鬼笔环肽、外泌体细胞标记荧光染料PKH67 购自美国Invitrogen 公司;4',6-二脒基-2-苯基吲哚(DAPI)购自中国碧云天公司;AlexaFluor 594 标记的驴抗小鼠二抗购自美国Life Technologies 公司。
1.2 原代细胞获取
将出生1~3 d C57 乳鼠的心脏组织剪成1 mm3的组织块,在37 ℃杂交炉中利用混合酶液(2.5%不含EDTA 的胰酶、0.1%Ⅳ型胶原酶、0.05%DNA 酶混合)消化组织块,利用血清中和酶液,直至组织块消失,收集消化液,离心、重悬、铺板,利用成纤维细胞与心肌细胞不同的贴壁时间,将两者分开。
将体外心肌细胞按处理方式不同分为3 组,即正常组、PBS 组及外泌体组。外泌体组以促炎性因子TGF-β(10 ng/mL)刺激原代心脏成纤维细胞48 h,将提取出来的外泌体(1 μg/mL)与心肌细胞体外孵育48 h。PBS 组加入等体积PBS 溶液。正常组不做特殊处理,正常培养。
1.3 外泌体提取、预处理与鉴定
外泌体提取:心肌成纤维细胞体外培养至P2 代,TGF-β(10 ng/mL)刺激原代心脏成纤维细胞48 h,收集培养基,3 000 g 离心20 min,收集上清,100 000 g 离心70 min,收集下层沉淀,加入15 mL PBS 重悬,100 000 g 离心1 h,弃上清,收集所得的沉淀即为外泌体。用400 μL PBS 重悬后,-80 ℃保存。
外泌体荧光标记处理:将新鲜提取的外泌体与PKH67 预混,体积比为1 000 ∶1,孵育1 h 后,加入15 mL PBS 重悬,100 000 g 离心20 min,弃上清,再次加入15 mL PBS,重复100 000 g 离心20 min,以去除多余染料。
外泌体鉴定:(1)电镜检查。将超高速离心获得的外泌体6 μL 滴至300 nm 的铜网上,而后加入8 μL 2%醋酸双氧铀,静置3 min,通过投射电镜观察外泌体形态及粒径大小。(2)外泌体表面蛋白标志物检测。Western blot 检测外泌体所特有的分子标记物TSG101、CD63。
1.4 免疫荧光染色
将心肌细胞接种在共聚焦培养皿中,体外培养24 h 后,按1.2 处理各组细胞,细胞干预处理后以4 %多聚甲醛固定,0.3%Triton X-100 通透10~15 min,封闭后加入小鼠源抗肌动蛋白抗体4 ℃孵育过夜,AlexaFluor594 标记的驴抗小鼠二抗室温孵育2 h,DIPA 标记细胞核,荧光显微镜下观察,拍照留存,并利用ImageJ 软件计算心肌细胞表面积。
鬼笔环肽(phalloidin)染色:将心肌细胞接种在共聚焦培养皿中,体外培养或者外泌体干预至相应时间点后,4 %多聚甲醛固定,PBS 清洗,加入鬼笔环肽(1 ∶10 000 稀释),室温孵育30 min,去除上清,加入DIPA 标记细胞核,荧光显微镜下观察。
1.5 实时定量聚合酶链反应(PCR)
利用Trizol 试剂提取心肌细胞RNA,通过逆转录试剂盒进行逆转录。引物见表1,实时定量PCR反应条件如下:95 ℃,1 min;55 ℃,1 min;72 ℃,1 min;72 ℃,6 min;连续进行40 个循环。利用2-ΔΔCT法计算心房利钠肽(ANP)、脑钠肽(BNP)和β 肌球蛋白重链(β-MHC)mRNA 的相对表达水平。

表1 PCR引物序列
1.6 实验动物与分组
健康成年雄性C57 小鼠32 只,1 周龄,体质量22~25 g,由上海市第一人民医院实验动物中心提供。将实验小鼠随机分为4组:对照组、假手术组、TAC-对照组及TAC-外泌体组,每组8 只。
TAC 组小鼠进行TAC 模型构建。取C57 小鼠,术前常规脱毛、禁食、禁水,异氟烷气体麻醉,气管插管。设置呼吸机参数,潮气量为200 μL/次,呼吸频率为110 次/min。在腋前线距离胸骨左缘2 mm 处切口,钝性分离皮下筋膜,拨开胸腺及肺组织,用手术镊取6.0 手术线从无名和左颈总动脉之间穿过胸主动脉,连同8 G 针头一起固定于主动脉弓,再此基础上撤走针头,以保证主动脉的缩窄程度同针头大小一致,关胸缝合。假手术组小鼠在异氟烷气体麻醉、气管插管、开胸后,不进行主动脉弓缩窄手术,而是直接关胸。TAC-外泌体组小鼠自手术第二天开始,每日通过尾静脉注射20 μg 外泌体,连续注射4 周;TAC-对照组则注射等体积PBS 溶液。
1.7 小鼠心脏超声
术后8 周,禁饮、禁食12 h 后,利用小动物心脏超声仪评估各组小鼠心功能状态。异氟烷麻醉状态下,取胸骨旁左室长轴及心尖四腔切面,连续记录4 个心动周期中小鼠左室收缩末期内径(LVESD)及左室舒张末期内径(LVEDD)的平均值,并计算短轴缩短率(FS)及左室射血分数(LVEF)。
1.8 组织切片麦胚凝集素染色
术后8 周,处死小鼠,取出心脏组织,4%多聚甲醛固定,石蜡包埋、切片,予以麦胚凝集素(WGA)染色,利用荧光显微镜观察各组实验动物心室肥厚程度。
1.9 统计学分析
采用SPSS 19.0 软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 外泌体鉴定
对小鼠成纤维细胞激活后释放的外泌体进行鉴定。投射电镜下成纤维细胞来源的微小囊泡呈杯口状结构,直径在110 nm 左右,符合典型的外泌体结构特征[11]。Western blot 结果显示该微小囊泡状结构表面携带有外泌体形成的特异性分子标记物CD63 及TSG101[12-13],提示本研究中提取的心肌成纤维细胞上清液中的微小囊泡为外泌体。见图1。
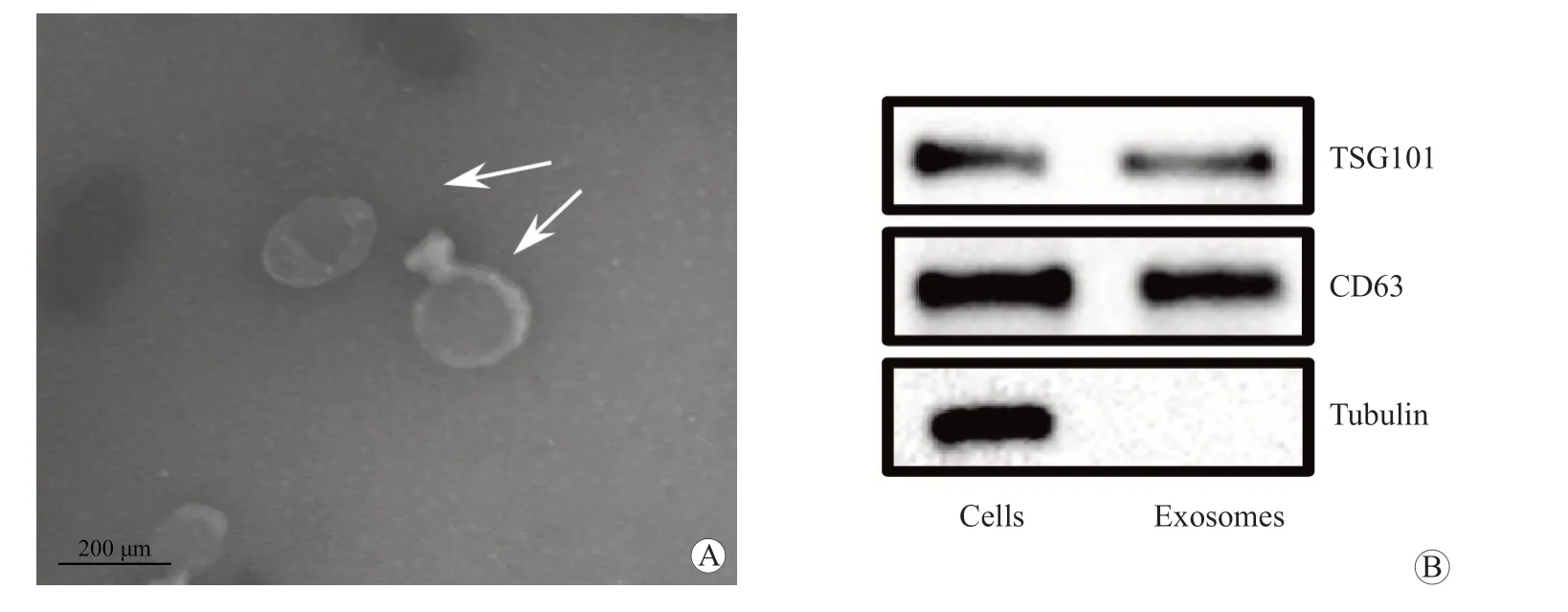
图1 成纤维细胞来源外泌体的鉴定
2.2 肌成纤维细胞来源外泌体促进心肌细胞病理性肥厚
用PKH67 绿色荧光对外泌体膜进行标记,Phalloidin 红色荧光对原代心肌细胞膜进行标记,图2A 示外泌体可以被心肌细胞吞噬。与正常组及PBS 组相比,外泌体组心肌细胞肥厚相关基因ANP、BNP、β-MHC的mRNA 表达水平及心肌细胞表面积均显著增加(P均<0.05)。见图2B、表2。

表2 各组心肌细胞心肌肥厚相关指标的mRNA表达水平及心肌细胞表面积比较

图2 肌成纤维细胞来源的外泌体促进心肌细胞病理性肥厚
2.3 肌成纤维细胞来源外泌体促进TAC术后小鼠心脏病理性重构进展
实验动物心脏超声及WGA 染色检测结果显示,TAC 手术8 周后,小鼠LVEF、FS 均显著下降,LVESD、LVEDD 以及左心室心肌细胞表面积均显著增加(P均<0.05)。相对于TAC-对照组,TAC-外泌体组小鼠心功能进一步恶化,表现为小鼠LVEF、FS 进一步下降,以及LVESD、LVEDD、左心室心肌细胞表面积进一步增加,见表3、图3、图4。
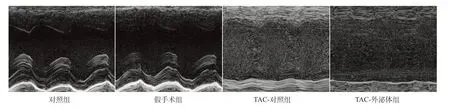
图3 各组小鼠代表性超声心动图

图4 各组小鼠左心室麦胚凝集素染色情况(×200)

表3 各组小鼠心功能参数及左心室心肌细胞表面积比较
3 讨论
研究表明,人体内器官之间、细胞之间通过某些生物活性分子如激素、脂质小分子、非编码RNA 等,保持功能上的紧密联系[14-18]。人体内生物信号链的有效传递对于正常生理代谢功能的维持具有重要作用,多种疾病的发生,如甲状腺功能亢进性心肌病、肝肾综合征、心脑综合征等,也与内信号传递的异常存在密切关系[19-21]。成纤维细胞是心脏内含量最丰富的细胞类型,正常情况下,成纤维细胞对于心肌细胞电信号与机械应力的传递具有重要作用,可以通过旁分泌机制促进心肌细胞形态及功能的维持[22-23]。然而,在某些疾病状态下,尤其是在急性心肌梗死、风湿性心脏病、高血压等病理状态下,心肌组织内异常升高的促纤维化因子,如TGF-β、溶血磷脂酸(LPS)、TNF-α 等,可以导致静止状态下的心脏成纤维细胞转为功能状态活跃的肌成纤维细胞[24-26]。
外泌体是细胞信号传递的重要媒介,人体内几乎所有细胞均可以通过释放外泌体完成其在组织器官及细胞间的信号传递。鉴于细胞释放的外泌体与细胞本身的功能状态存在密切关系,本研究探讨疾病模型中异常激活的成纤维细胞来源的外泌体对心肌细胞生物学功能的影响。利用TGF-β 诱导成纤维细胞激活,并将激活状态下成纤维细胞来源外泌体与心肌细胞共同孵育,结果显示,外泌体干预后的心肌细胞表面积以及肥厚相关基因ANP、BNP和β-MHC的表达显著升高,提示激活状态下成纤维细胞来源外泌体可以显著促进心肌细胞的病理性肥大。为进一步明确肌成纤维细胞来源外泌体对心肌细胞病理性肥厚的影响,本研究利用尾静脉注射技术,对小鼠予以在体肌成纤维细胞来源外泌体干预,并通过心脏超声、WGA 染色等技术,检测肌成纤维细胞来源外泌体对心肌肥厚的影响,结果显示,激活状态下成纤维细胞来源的外泌体可使小鼠LVEF、FS 显著降低,LVESD、LVEDD、心肌细胞表面积显著增加,提示成纤维细胞来源的外泌体可以显著促进TAC 模型小鼠心肌组织的病理性肥厚,加速其心功能恶化,这与之前的研究报道一致[22]。
外泌体是细胞膜凹陷形成的囊泡状结构,内含多种生物活性物质,如短肽、信使RNA、细胞膜受体蛋白等,尤以微小RNA(miRNA)含量最为丰富[27]。MiRNA 是一种小分子非编码RNA,通过与mRNA 的3'UTR 结合,影响mRNA 稳定性,进而参与外泌体对细胞功能活性的调控[28-29]。由于miRNA 在外泌体内的丰度远大于其他小分子物质,我们推测miRNA 很可能是外泌体中介导心肌细胞病理性肥大的效应分子。
综上所述,本研究发现激活状态下的成纤维细胞来源外泌体可以显著促进心肌细胞的病理性肥大,加速心脏重构,提示生物信号链对机体稳态的重要性。本研究为延缓心脏病理性重构提供了新的思路及潜在的干预靶点。

