特发性心房颤动致病基因PRRX1新突变的发现及功能分析
李宁 仇兴标 徐迎佳 杨奕清 刘宗军
心房颤动(房颤)是最常见的心律失常,在一般人群中的发病率约为1%,但随年龄增长而急剧增加,80 岁以上老年人群的发病率在10%以上[1-2]。特发性房颤主要是由遗传缺陷所致,已经报道了至少140 个房颤相关遗传位点,还发现了50 多个突变基因可导致房颤,包括KCNQ1、KCNE1、KCNE2和SCN5A等基因[3-6]。然而,由于房颤具有显著的遗传异质性,大多数特发性房颤患者的遗传病因不明。
1 对象与方法
1.1 研究对象
2018 年1 月至2019 年12 月,病例组入选192 例汉族特发性房颤患者,其中男性103 例,女性89 例,年龄为32~60 岁,平均年龄为(47±9)岁。对照组为212 名性别、年龄和种族均完全匹配的健康志愿者,其中男性115 例,女性97 例,年龄为32~60 岁,平均年龄为(47±8)岁。所有研究参与对象均经过详细临床评估,包括病史、体检、心电图和心超检查。根据2014 年颁布的房颤处理指南诊断特发性房颤[7]。病例组中39 例患者有房颤家族史,约占全部患者的20%;对照组均无房颤家族史。2 组研究对象均没有发现可诱发房颤的环境危险因素。本研究符合世界卫生组织发布的医学伦理学原则,并获得上海交通大学附属胸科医院伦理委员会的批准(伦理批准号:KS1101)。经过研究对象的知情同意后,采集其临床数据及外周静脉全血标本,用血液基因组DNA 纯化试剂盒(美国Thermo Fisher Scientific 公司)提取基因组DNA。
1.2 方法
1.2.1PRRX1基因扩增 从Nucleotide 数 据库(https://www.ncbi.nlm.nih.gov/Nucleotide)下载PRRX1的基因组DNA序列(登陆号:NC_000001.11),借助在线软件Primer3(https://bioinfo.ut.ee/primer3-0.4.0/),设计通过聚合酶链反应(PCR)特异性扩增PRRX1基因编码外显子、剪接供体/受体及5'和3'端部分非翻译区的引物序列,见表1。以基因组DNA 为模板,应用所设计、合成的PRRX1基因特异性扩增引物及Hotstart Taq DNA 聚合酶试剂盒(德国Qiagen 公司),在型PCR 仪(美国Thermo Fisher Scientific 公司)上进行PRRX1基因片段的扩增。配制PCR 反应混合物,的总体积为25 μL,包括10×PCR 缓冲液2.5 μL、双蒸水12.25 μL、上、下游引物(20 μmol/L)各0.5 μL、5×Q 溶 液5 μL、dNTP(2.5 mmol/L)2 μL、Taq DNA 聚合酶(5 U/μL)0.25 μL 和 基因组DNA(50 ng/μL)2 μL。PCR 的条件参考文献[7-8],即95℃预变性15 min,随后进入36 个热循环,每个热循环由94 ℃变性30 s、62 ℃ 退火30 s 和72 ℃ 延伸1 min 构成,最后72℃ 延伸8 min。PCR 产物经过1.3%的琼脂糖凝胶电泳分离后回收目的DNA、用凝胶DNA 纯化试剂盒(美国Bio-Tek 公司)纯化。

表1 扩增PRRX1基因编码区、剪接位点及5' 和3' 端部分非翻译区的引物序列
1.2.2 Sanger 测序分析PRRX1基因 以纯化好的PCR 产物为模板,使用1 条PRRX1基因特异性扩增引物及DNA 测序试剂盒在PCR 仪上进行测序反应。配制测序反应混合物,总体积为10 μL,其中DNA 片段(40 ng/μL)1 μL、上游PCR 引物(2 μmol/L) 1μL、预混合液4 μL、双蒸水4 μL。测序PCR 的条件参考文献[7-8],设定30 个热循环,每个热循环由95 ℃变性20 s、50 ℃退火15 s和60 ℃延伸l min 构成。测序反应产物纯化后在DNA 测序仪(美国Thermo Fisher Scientific 公司)上进行凝胶电泳测序。对比分析所测的PRRX1基因序列与Nucleotide 数据库(https://www.ncbi.nlm.nih.gov/Nucleotide)中的PRRX1基因序列(登陆号:NM_022716.4)以发现PRRX1基因突变。一旦发现PRRX1基因突变,测序分析212 名对照者的PRRX1基因,同时检索SNP(https://www.ncbi.nlm.nih.gov/SNP)和 PubMed(https://www.ncbi.nlm.nih.gov/PubMed)数据库以核实该PRRX1基因突变是否为新突变。
1.2.3 PRRX1 蛋白之突变位点氨基酸的保守性分析 使用MUSCLE软件(https://drive5.com/muscle/),对比分析PRRX1 蛋白之突变位点氨基酸在跨物种进化上的保守性。
1.2.4PRRX1基因新突变的致病性模拟分析 应用在线计算机程序PolyPhen-2(http://genetics.bwh.harvard.edu/)、MutationTaster(http://www.mutationtaster.org/) 和PROVEAN(http://provean.jcvi.org/)模拟分析PRRX1基因新突变的致病性。
1.2.5PRRX1基因突变体的功能分析 野生型PRRX1的真核表达载体PRRX1-pcDNA3.1 及其靶基因SHOX2启动子驱动萤火虫荧光素酶表达的报告基因表达载体SHOX2-luc 的构建如前所述[9]。以野生型PRRX1-pcDNA3.1 表达质粒为模板,应用定点诱变试剂盒(美国Stratagene 公司)和1 对长31 个碱基的互补引物(以突变点为中心),通过PCR 获得突变型PRRX1-pcDNA3.1 表达质粒,然后应用Dpn I 酶(美国NEB 公司)切除野生型PRRX1-pcDNA3.1 模板,并通过DNA 测序证实。Hela 细胞培养及多种表达载体瞬时共转染方法见参考文献[9]。同时共转染海肾荧光素酶报告基因表达载体 pGL4.75(美国Promega 公司)作为内对照,目的是消除转染效率对结果的可能影响。转染表达质粒后48 h 收集并裂解Hela 细胞,选用双荧光素酶(报告基因)分析试剂盒(美国Promega 公司),参考试剂使用说明在荧光定量分析仪上分析细胞裂解液的荧光素酶活性。以萤火虫荧光素酶的活性与海肾荧光素酶的活性之比表示靶基因SHOX2启动子的转录活性[7]。
1.3 统计学分析
两组连续变量如入选研究者的年龄、靶基因SHOX2启动子的转录活性等的比较应用非配对Student’st检验;两组分类变量如入选对象的性别、种族、阳性家族史的发生率等的比较使用Pearson’sχ2检验或Fisher’s 精确概率检验。双侧检验概率值以P<0.05 表示差异有统计学意义。
2 结果
2.1 发现PRRX1基因新突变
病例组与对照组均为汉族,性别构成无显著性差异(经Pearson'sχ2检验P>0.05),年龄也无统计学差异(经Student'st检验P>0.05),但病例组的房颤家族史阳性率显著高于对照组(经Fisher's 精确概率检验P<0.05)。
对192 例特发性房颤患者的PRRX1基因进行测序分析,在其中1 例49 岁的男性家族史阴性的特发性房颤患者检测出1 种PRRX1基因杂合错义突变,即NM_022716.4:c.425T>C;p.(Phe142Ser)突变。对212 名健康对照者PRRX1基因测序分析,没有检测出基因突变。检索SNP 和PubMed 数据库,均未见报道本研究所发现的基因突变。该例特发性房颤患者的PRRX1基因c.141T>C 杂合突变和其纯合野生型对照序列,见图1。
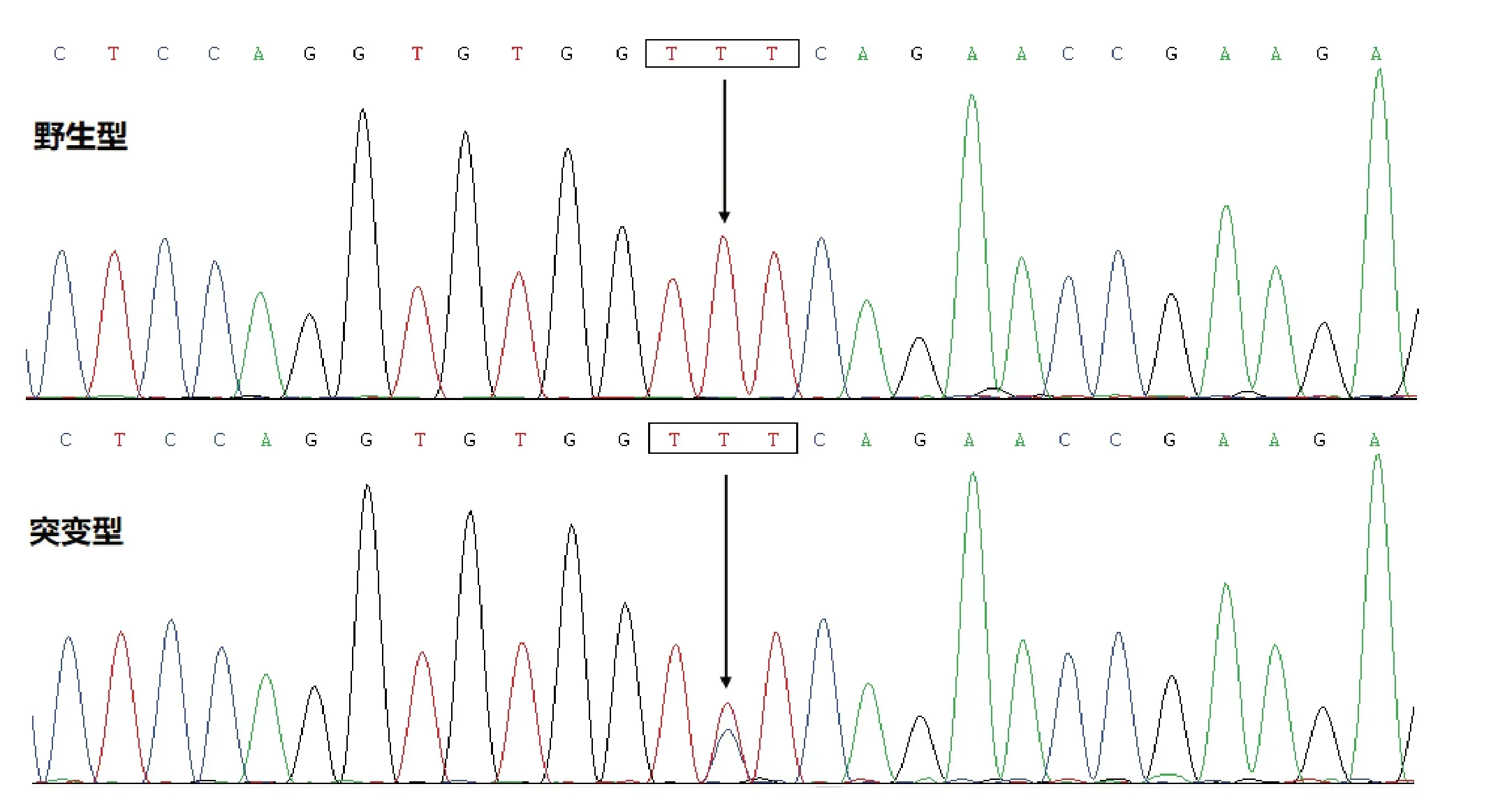
图1 PRRX1 基因c.425T>C突变(杂合子)和其野生型(纯合子)对照DNA序列
2.2 PRRX1的Phe142Ser变异所改变的氨基酸在物种进化上高度保守
人PRRX1 蛋白(NP_073207.1)第142 位的苯丙氨酸在猩猩(XP_001141191.1)、猴(XP_001097390.1)、犬(XP_850725.1)、牛(NP_001075208.1)、小鼠(NP_035257.1)、大鼠(NP_722543.1)、禽(NP_001007822.1)、斑马鱼(NP_956344.1 和NP_999899.1)和蟾蜍(NP_004913839.1)的PRRX1蛋白进化上完全保守。
2.3 新发现的PRRX1基因变异是致病性突变
该PRRX1基因新变异c.425T>C 即p.(Phe142Ser) 变异经在线软件PolyPhen-2、Mutation Taster 及PROVEAN 均预测为致病性突变,其中被PolyPhen-2 预测为“很可能致病”,预测分数为0.997(敏感性0.41,特异性0.98);被MutationTaster 预测为“致病”,正确预测的概率约等于1(>0.999);被PROVEAN 预测为“恶性”,预测分数为-7.60(临界值为-2.5,大于该值为良性多态)。
2.4 该突变型PRRX1对靶基因的转录激活功能显著降低
在转染了多种基因表达载体的Hela 细胞中,200 ng 的野生型PRRX1-pcDNA3.1(PRRX1)和等量(200 ng)的Phe142Ser-突变型PRRX1(Phe142Ser)对靶基因SHOX2启动子的转录激活作用分别约为39倍和1倍(t=19.78,P=0.000 04);而在同时转染了100 ng 的野生型PRRX1-pcDNA3.1(PRRX1)和等量(100 ng)的Phe142Ser-突变型PRRX1(Phe142Ser)时,所诱导的转录激活作用约为22 倍,显著低于200 ng 的野生型PRRX1-pcDNA3.1(PRRX1)所诱导的转录激活作用[约39 倍(t=7.017,P=0.002 17)]。
3 讨论
本研究在1 例特发性房颤患者中检测出1 种新的PRRX1基因杂合错义突变NM_022716.4:c.425T>C;p.(Phe142Ser),经多个在线计算机软件模拟功能分析均显示该突变具有致病性,多基因表达细胞功能研究表明Phe142Ser-突变型PRRX1 对靶基因SHOX2启动子的转录激活作用显著降低。因此,PRRX1基因突变c.425T>C 或 p.(Phe142Ser)是该例特发性房颤患者的分子病因,但也不能完全排除其他突变基因可能也有一定的作用,全基因组测序分析及深入的功能研究有助于明确这一问题。
定位于人类1 号染色体1q24.2 的PRRX1基因编码一种重要的同源盒转录因子,大量表达于胚胎发育期的心血管系统,如心脏、胸腔内大血管和肺静脉[10-12],而肺静脉是房颤触发灶的最常见来源部位,临床上肺静脉隔离可以终止大部分房颤[13]。既往的研究证实PRRX1可以调节上皮-基质转换,这是人类心血管发育的标志性事件[14]。在PRRX1基因敲除小鼠,心血管发育畸形,包括主动脉弓曲率及方位异常、食管后右锁骨下动脉畸形以及动脉导管错位延长,突显了PRRX1对血管及血管周边基质发育的关键调控效应[15]。近期有研究发现,PRRX1可以与靶基因SHOX2和ISL1启动子结合进而转录激活SHOX2和ISL1的表达[9],而SHOX2 和ISL1 对心脏尤其是其起搏传导系统的发育具有重要的调节作用[16-17],无论是SHOX2还是ISL1基因功能缺失性突变均可导致房颤[18-19]。这些研究结果表明,PRRX1基因功能缺失性突变可能通过下调SHOX2和ISL1等靶基因的表达而诱发房颤,PRRX1基因单倍型不足是人类房颤的发病机制之一。
值得一提的是,全基因组关联研究发现位于PRRX1基因上游约63 kb 的1 个单核苷酸多态(rs3903239)显著增加房颤的发病风险[20]。功能分析显示基因组区域的这一变异显著降低PRRX1基因启动子的转录活性,进而显著减少PRRX1 蛋白在左心房组织中的表达量[20]。进一步的功能分析发现,PRRX1 蛋白缺失可显著缩短人类心房肌细胞动作电位时程和有效不应期,从而易于形成折返环,诱发房颤[20]。此外,Guo 等[9]首先发现了PRRX1基因的2 个功能缺失性突变可通过下调靶基因SHOX2和ISL1的表达而导致家族房颤。本研究发现1 种的PRRX1基因杂合错义突变可导致特发性房颤,扩大了房颤相关PRRX1基因突变谱。
总之,本研究揭示了1 种新的PRRX1基因突变可导致特发性房颤,这对房颤的早期精准预防及预后风险评估具有一定的意义。

