心尖肥厚型心肌病影像学诊断
张凌飞 冯雪虹 杨承健 叶新和
肥厚型心肌病(HCM)是一种常见的常染色体显性遗传心肌病[1]。心尖肥厚型心肌病(ApHCM)是HCM 的特殊亚型,主要临床表现为胸闷、胸痛、呼吸困难和心悸,也可出现心律失常、心力衰竭、心肌梗死和左室心尖部室壁瘤(LVAA)等心血管事件[2]。ApHCM 的心肌纤维化负担较小,舒张功能障碍较轻,大多数ApHCM 患者表现出良性病程[3],也可能发生心房颤动、心肌梗死、卒中、心力衰竭及室性心律失常等心血管并发症[4],心脏死亡率差异较大[5-7]。ApHCM 诊断标准为左室乳头肌以下心尖肥厚,舒张末期心尖部厚度≥15 mm,且心尖段最大室壁厚度/左室后壁厚度≥1.5,排除导致室壁增厚的其他疾病[8]。某些研究认为,上述ApHCM 诊断标准可放宽至13~15 mm,比值>1[9-11]。ApHCM 的影像学诊断方法包括核素显像、心室造影、超声心动图和心脏磁共振(CMR)等,后两者近年来发展迅速,能够从多角度反映ApHCM 的特点,提示疾病预后。
1 超声心动图及声学造影
超声心动图具有实时显像、相对经济的优势,是常用的诊断和评估ApHCM 的影像学手段。根据室壁肥厚范围,ApHCM 通常分为单纯型和混合型。单纯型是指单纯心尖肥厚;混合型是指以心尖肥厚为主,同时伴有室间隔肥厚(见图1)。此外,相对型ApHCM 是早期亚型,随着病情进展,轻微的心尖肥厚将发展为明显的左室肥厚[12]。Chen 等[7]根据超声心动图检查结果将47 例ApHCM 患者分为单纯型组和混合型组,发现与单纯型相比,混合型患者合并高血压、左心房扩大等比例更高。该研究共观察到心房颤动、充血性心力衰竭、不明原因晕厥等33 个心血管并发症,其发病率与混合型关系密切,提示混合型ApHCM 可能具有更高的心血管发病风险。因此,利用超声心动图鉴别单纯型或混合型ApHCM 十分必要。
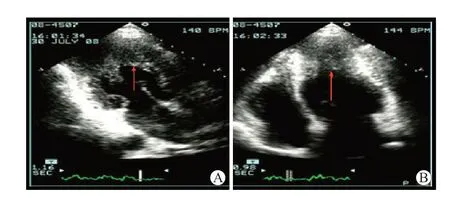
图1 单纯型ApHCM超声心动图(引自文献13)
约15%的ApHCM 可并发LVAA,后者常继发于心尖壁增厚引起的心尖梗死和心室中部梗阻(MVO)。LVAA 是左室最远端离散的薄壁运动障碍或失动力的节段。虽然ApHCM 的预后相对较好,但合并LVAA 可能会提高院外心脏骤停、血栓栓塞事件以及需要植入心脏转复除颤器等心血管事件的风险[14]。Maron 等[15]研究了1 299 例HCM患者,其中28 例存在LVAA,只有57%(16/28)的患者经超声心动图检查发现,说明传统的二维经胸超声心动图检出率相对较低。左心腔声学造影技术(LVO)使用微泡造影剂提高了左室心内膜边界的清晰度,有助于实现心尖部的可视化,较常规二维超声心动图更准确地评估ApHCM 患者左室壁厚度(LVWT)及左室容积,提高LVAA 检出率[16](见图2)。
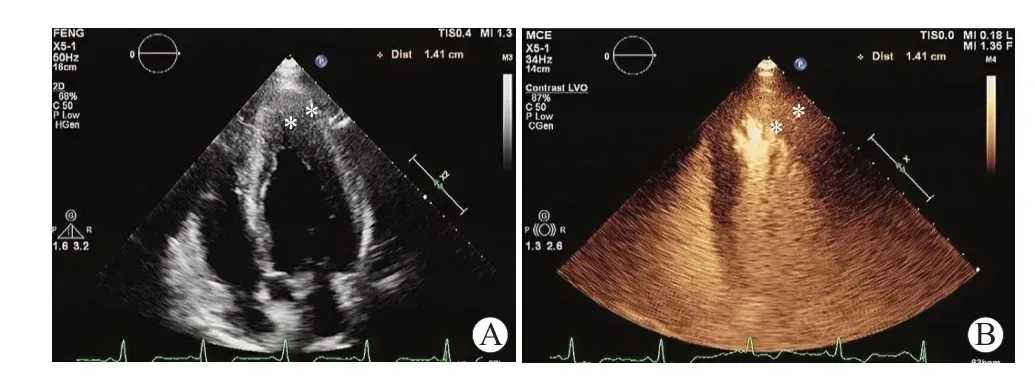
图2 LVO诊断ApHCM
除了二维和三维超声心动图,多普勒也被用于评估亚临床左室收缩功能。ApHCM 通常表现为舒张末期和收缩末期容积正常或减少,而射血分数不变,尽管其收缩功能整体正常甚至偏高,但心尖节段可能存在局部功能障碍[17]。出现左室收缩功能降低的患者预后较差,并可能继发LVAA。多普勒组织成像可测量心肌收缩和舒张时的运动速度,收缩速度和早期舒张速度的降低可发生在显性肥厚出现之前。超声多普勒测得的肺静脉血流的心房逆传波及其持续时间可以较好地评估左室充盈压力[18]。
二维超声心动图显示,HCM 的梗阻可发生在左室流出道或者心室中部水平,约有1/3 的HCM患者存在静息时左室流出道梗阻[19],而ApHCM 的梗阻通常为MVO[17]。心室中部肥厚或者异常乳头肌插入会造成MVO,严重者可导致空腔闭塞,表现为收缩期左室腔闭塞,可见于混合型ApHCM。M 型超声心动图显示,左室腔闭塞可持续至舒张期,可能与LVAA 反常的舒张射流有关,常提示预后较差[20]。
二维超声心动图斑点追踪显像是基于高帧频的二维灰阶超声图像,通过实时追踪心肌内的回声斑点,定量测量心肌的扭转和旋转角度的新技术。宋光等[21]通过对比早期ApHCM 患者、高血压左室肥厚患者以及健康志愿者发现,二维斑点追踪显像技术可以准确测量早期ApHCM 患者的心肌扭转和旋转,反映心肌运动形变能力的变化。研究发现,利用二维超声心动图斑点追踪显像分析的心肌应变与HCM 的心肌厚度和纤维化密切相关,心肌应变的降低程度与HCM 预后不良相关[3]。
近年来三维超声心动图通过实时获取容积成像,提高了评价心室大小和功能的准确性,其敏感度和特异度接近CMR[17,22]。2014 年ESC 指南[23]推荐,若二维超声心动图显影不理想,利用静脉注射造影剂的LVO 可以替代CMR。三维超声心动图提高了对左室腔闭塞部位和程度的识别,可以鉴别HCM 的不同亚型。此外,实时三维超声心动图在评估HCM 的MVO 和LVAA 中也有着不容小觑的前景[24]。
2 心脏磁共振
CMR 具有良好的软组织分辨率,且能够多平面成像,可以更灵敏的识别HCM 患者的LVAA,在临床应用中逐渐普及[25]。与超声心动图相比,CMR 可以完全覆盖左室形态,包括心尖部。CMR具有以下优势,可以对HCM 提供更多更重要的诊断信息:(1)能够对比区分血池与心肌;(2)大视野、全方位、任意层面成像,不受声窗和体位限制;(3)时间和空间分辨率更高;(4)组织特异性和信号分辨率更高,根据对比剂延迟强化(LGE)可以很好地检测和鉴别心肌纤维化和心肌瘢痕等;(5)独特的成像序列和参数,强大的心功能量化后处理能力,可对包括心肌纤维化在内的许多参数进行定量化分析,操作具有可重复性等[26]。CMR 图像应包含左室两腔长轴视图、四腔长轴视图(见图3)、含左室流出道的视图及左室短轴视图,静脉注射钆后获得LGE 图像视图。CMR 可明确心尖肥厚或LVAA 的存在、部位和程度。
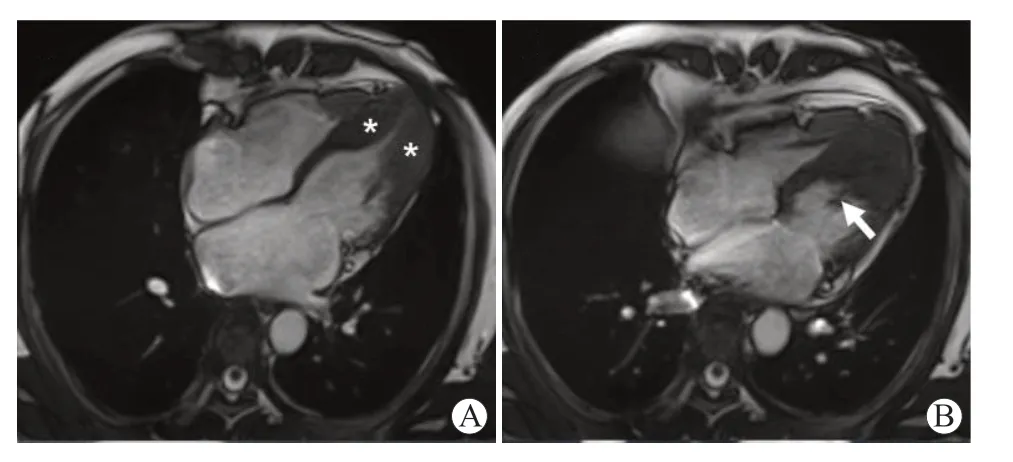
图3 典型ApHCM的CMR(引自文献27)
王辉等[28]采用CMR 应变分析发现,在心电图显示宽大倒置T 波而心尖部心肌尚未达到15 mm的临床前期,ApHCM 患者左室射血分数(LVEF)与心电图、超声心动图、CMR 均正常的对照组比较,差异无统计学意义[(68.75±6.78)%对(63.64±6.40)%,P=0.06],左室心尖部厚度高于对照组[(11.71±1.39)mm 对(5.63±0.95)mm,P<0.05],心尖部周向应变低于对照组(-20.34±8.81 对-24.68±3.97,P=0.027),心 内膜下整体长轴最大纵向应变与心外膜下整体长轴最大纵向应变的差值高于对照组(-2.96±1.74对-1.33±1.34,P<0.01)。临床前期ApHCM 患者LVEF 保持在相对较高的水平,但心尖部心肌的最大周向应变下降,表明其周向收缩能力下降。CMR 心肌应变分析可为此类患者提供新的诊断依据及诊断方法[28]。
心肌纤维化可能是导致心律失常的基础,也可能促进心力衰竭的发展。LGE 是心肌纤维化的标志,是不良结局的独立危险因素。ApHCM 患者的LGE 类型包括心内膜下LGE、模糊融合型LGE、右室附着部多灶性LGE 和心肌中部离散(灶性)型LGE。Kim 等[29]研究发现大多数患者心肌LGE定位于心尖外侧段和心尖帽段(分别为52.5%和70.0%)。LGE 与心源性死亡、心力衰竭以及心脏性猝死(SCD)的发病趋势相关[30]。ApHCM 的心肌纤维化是一个缓慢发展的过程,LGE 的进展与许多临床结果显著相关,SCD 风险与LGE 进展之间存在线性关系,LGE 进展增加5%,SCD 风险相对增加1.17 倍,未来发生非持续性室性心动过速以及晕厥的概率也会增加,基础病情较严重或并发LVAA 的患者,应尽早重复CMR,以获得更好的临床评估和管理[31]。
3 小结
ApHCM 是一种发病率较低、具体病因不明的遗传性疾病,患者症状不典型,容易被漏诊、误诊。对于有HCM 一级家族史的患者,不论是否有胸闷胸痛、呼吸困难或心悸等症状,都建议行心电图、超声心动图、CMR 等明确,做到早发现、早诊断、早治疗。随着影像学设备及技术的日益更新,超声心动图及CMR 已成为诊断ApHCM 的首选检查方式,尤其是目前研究较多的二维超声心动图斑点追踪显像技术、LVO、CMR 下的心肌应变分析及LGE 成像技术,可进一步评估ApHCM 患者心肌厚度、纤维化程度及预后。目前有关ApHCM 的研究较少,仍需更大的研究样本来寻求ApHCM 的最佳诊断方式。

