外周血单个核细胞Toll样受体4基因检测联合降钙素原对脓毒症的诊断价值研究
胡元慧,汤冬玲,张平安
脓毒症是一种广义上由感染引起的全身炎症反应综合征,常伴发器官衰竭,是全世界危重症患者主要死因之一[1-2]。脓毒症发病机制复杂,涉及炎性因子、氧化损伤、线粒体功能障碍、凋亡等其他因素[3]。目前对于脓毒症的诊断有血培养、C反应蛋白、降钙素原(procalcitonin,PCT)等指标,但无法在单一指标下及时准确诊断[4]。Toll样受体(Toll-like receptors,TLRs)是一种免疫识别受体,是一种很有前途的新型生物标志物[5]。脓毒症的常见感染菌是革兰阴性菌,其细胞壁成分脂多糖(lipopolysaccharide,LPS)与TLR4结合,激发机体免疫炎性反应,导致多种促炎递质和细胞因子的分泌,如白介素(IL)-1β和IL-6,造成细胞因子风暴,导致机体损伤[6]。TLR4 mRNA水平在脓毒症初期即上升,其水平被认为与炎症程度相关[7-8]。PCT是一种由116个氨基酸组成的多肽,是降钙素前体,可作为脓毒症级联反应的一部分,水平迅速升高,并在脓毒症发病12~48 h后达到峰值,具有较高的灵敏度和特异度[9-11]。目前关于TLR4 mRNA联合血清PCT对脓毒症诊断价值的相关研究较少,本研究旨在探讨外周血单个核细胞TLR4 mRNA联合血清PCT对脓毒症的诊断价值,并分析TLR4 mRNA在不同脓毒症严重程度分级和感染不同病原时的水平变化,为临床诊断提供理论依据,以达到对潜在脓毒症患者进行及早发现和干预的目的。
1 对象与方法
1.1 研究对象 选取2020年10月至2021年11月武汉大学人民医院收治的110例脓毒症患者为脓毒症组,同期113例感染性疾病患者为非脓毒症组,95例体检健康者为对照组。纳入标准:(1)脓毒症组纳入符合2016年《第三版脓毒症与感染性休克定义国际共识》[1]中脓毒症诊断标准的患者,即入院时临床诊断存在感染且序贯器官衰竭评分(SOFA)≥2分或快速SOFA(qSOFA)≥2分。(2)非脓毒症组选取入院主要诊断为感染性疾病的患者;(3)健康组选取同期健康体检者。排除标准:(1)年龄<18岁;(2)合并免疫系统疾病、恶性肿瘤;(3)近半年使用免疫抑制剂;(4)临床资料不完整;(5)妊娠妇女。脓毒症组、非脓毒症组和对照组性别、年龄比较,差异无统计学意义(P>0.05),见表1。

表1 三组研究对象一般资料比较Table 1 Comparison of general information of three groups of participants
将复苏后仍需升压药维持平均动脉压≥65 mm Hg(1 mm Hg=0.133 kPa)且血乳酸>2 mmol/L定义为休克,将脓毒症患者进一步分为非休克亚组和合并休克亚组。
本研究经武汉大学人民医院医学伦理学委员会批准(批号:WDRY2020-K223),并豁免患者知情同意。
1.2 研究方法
1.2.1 实验室检查指标 脓毒症组和非脓毒症组患者入院确诊并空腹6~8 h后,于次日清晨(对照组于体检当天)分别采集静脉血2 ml置于一次性真空采血管(已加乙二胺四乙酸二钾抗凝剂的紫色管)中颠倒混匀;另采集静脉血4~6 ml室温静置30 min后,以转速3 500 r/min(离心半径16 cm)离心5 min,分离血清。在2 h内完成以下指标的检测:红细胞计数(RBC)、白细胞计数(WBC)、中性粒细胞计数(NEU)、血红蛋白(Hb)、血细胞比容(HCT)、血小板计数(PLT)采用日本Sysmex公司生产的XN-9000全自动血细胞分析仪及其配套试剂进行检测;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、直接胆红素(DBiL)和总胆红素(TBiL)水平采用西门子公司生产的AD2400-1生化分析仪进行测定;PCT采用罗氏诊断公司生产的cobas8000e801全自动化学发光免疫分析仪进行检测。所有指标检测均在试剂盒说明书规定的时间内完成,且严格遵守实验相关操作规程。
1.2.2 qSOFA、感染病原、感染部位 收集研究对象首次实验室检查结果和临床资料,分别计算qSOFA。qSOFA内容:呼吸频率≥22次/min、收缩压≤100 mm Hg、意识改变计为1分,总分3分。根据血培养(Bac T/Alert 3D全自动血培养仪,Bruker基质辅助激光解析飞行时间质谱仪),或细菌基因组DNA提取试剂盒(博奥生物集团有限公司)和呼吸道病毒检测试剂盒(美国Diagnostic Hybrids Inc)的检测结果,将感染病原种类分为革兰阳性菌、革兰阴性菌、真菌、病毒、支原体、多重感染和未知病原;按照初发感染部位分为肺、血液、腹腔、肝胆系统、泌尿系统、皮肤和软组织、中枢神经系统和其他。
1.2.3 人外周血单个核细胞的分离 采用Ficoll密度梯度离心法。向清洁无菌离心管中加入2 ml人淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),再将人外周静脉血(紫色管)1 ml与经高压灭菌的0.9%氯化钠溶液1 ml均匀混合后缓慢加入含有2 ml人淋巴细胞分离液的上层,3 500 r/min离心25 min(离心半径为16 cm),离心后可观察到离心管液体由下至上分为3层,取出一二层交界处以单核细胞为主的白色云雾状液体,加入4 ml无菌0.9%氯化钠溶液中,充分混匀,1 500 r/min离心10 min(离心半径为16 cm),重复洗2次,即可得目的细胞。
1.2.4 人外周血单个核细胞总RNA提取 采用Trizol试剂盒(美国Invitrogen公司,15596026)提取细胞总RNA,提取完毕后利用Nanodrop 2000C紫外-可见分光光度计(美国Thermo公司)测定RNA浓度及纯度,于-80 ℃保存备用。
1.2.5 TLR4 mRNA表达水平检测 使用Premier 6.0设计TLR4和GAPDH引物,采用PubMed对设计的引物特异性进行验证,确定最终引物序列,熔解曲线峰单一,可见引物特异性良好(图1),引物序列见表2。采用Takara逆转录试剂盒(日本Takara公司,RR036A)将细胞总RNA逆转录为cDNA,并采用实时荧光定量PCR(RT-PCR)试剂盒(日本Takara公司,RR901A)对TLR4 mRNA表达水平进行检测,RT反应条件:37 ℃反应15 min,85 ℃反应5 s。在ABI ViiA7实时荧光PCR仪上设置PCR反应程序:(1)95 ℃40 s;(2)95 ℃30 s,64 ℃ 90 s;(4)95 ℃ 15 s,60 ℃ 60 s,95 ℃15 s,循环数为50,于每次循环末收集荧光信号。

表2 实时荧光定量PCR引物序列Table 2 Sequences of primers for real-time fluorescence quantitative PCR amplification of TLR4 mRNA and GAPDH

图1 荧光定量PCR熔解曲线图Figure 1 Fluorescence melting curve analysis of PCR for TLR4 mRNA and GAPDH quantitation
1.3 统计学方法 采用SPSS 25.0软件对实验数据进行统计分析。计量资料采用单样本Kolmogorov-Smirnov法检验各组数据是否符合正态性,呈正态分布的计量资料以(±s)表示,多组间比较采用方差分析,组间进一步两两比较采用LSD-t检验;非正态分布采用M(QR)表示,多组间比较采用Kruskal-Wallis H检验,两两比较采用Mann-Whitney U检验,采用二元Logistic回归分析得到TLR4 mRNA与PCT联合的回归模型,并绘制TLR4 mRNA与PCT单独或联合检测诊断脓毒症的受试者工作特征(ROC)曲线,并计算曲线下面积(AUC)、灵敏度、特异度和约登指数。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 实验室检查指标比较 三组RBC、WBC、NEU、Hb、HCT、PLT、ALT、AST、DBiL比较,差异有统计学意义(P<0.05),三组TBiL比较,差异无统计学意义(P>0.05)。其中脓毒症组WBC、NEU、ALT、AST、DBiL较非脓毒症组、对照组均升高,差异有统计学意义(P<0.05);脓毒症组 RBC、Hb、HCT、PLT较非脓毒症组、对照组均降低,差异有统计学意义(P<0.05),见表3。

表3 三组实验室检查指标比较〔M(QR)〕Table 3 Comparison of laboratory indicators of three groups of patients
2.2 非脓毒症组和脓毒症组qSOFA、感染病原和感染部位情况 非脓毒症组和脓毒症组qSOFA比较,差异有统计学意义(P=0.002)。脓毒症组与非脓毒症组感染病原比较,差异有统计学意义(P=0.033);脓毒症组患者中感染最多的病原微生物是革兰阴性菌,其次是真菌与革兰阳性菌;非脓毒症组中感染最多的病原微生物种类也是革兰阴性菌,其次是革兰阳性菌与真菌。脓毒症组与非脓毒症组感染部位比较,差异有统计学意义(P=0.003)。脓毒症组患者感染最多的部位是肺,其次是泌尿系统与肝胆系统;非脓毒症组患者感染最多的部位是肺,其次是泌尿系统与皮肤和软组织,见表4。
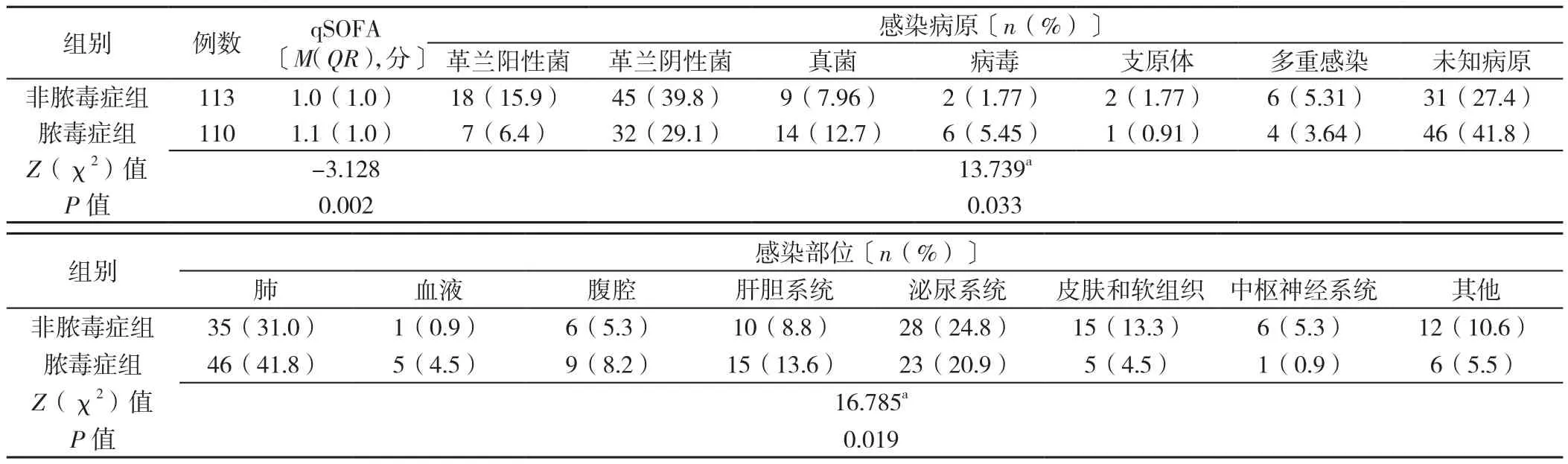
表4 非脓毒症组和脓毒症组qSOFA、感染病原和感染部位比较Table 4 qSOFA scores,pathogens and infected sites in non-sepsis and sepsis groups
2.3 外周血单个核细胞TLR4 mRNA检测结果 三组外周血单个核细胞TLR mRNA和PCT水平比较,差异有统计学意义(P<0.05),其中脓毒症组外周血单个核细胞TLR mRNA和PCT水平高于非脓毒症组和对照组,差异有统计学意义(P<0.01);非脓毒症组外周血单个核细胞TLR4 mRNA和PCT水平均高于对照组,差异有统计学意义(P<0.01),见表5。
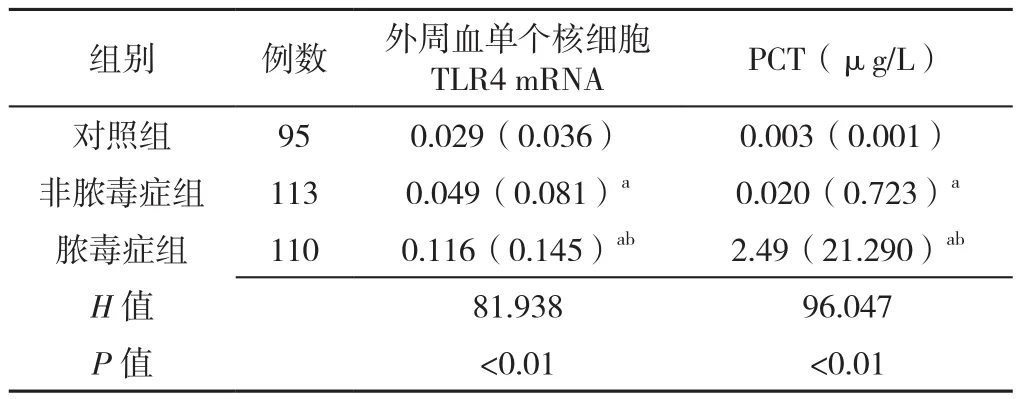
表5 三组外周血单个核细胞TLR4 mRNA和血清PCT水平比较〔M(QR)〕Table 5 TLR4 mRNA in peripheral blood mononuclear cells and serum PCT in three groups of patients
脓毒症组革兰阳性菌、革兰阴性菌、真菌和其他病原菌感染患者TLR4 mRNA分别为0.154(0.302)、0.139(0.493)、0.119(0.206)和0.151(0.336),脓毒症组4种感染病原患者TLR4 mRNA比较,差异无统计学意义(H=0.378,P=0.945)。非休克亚组和合并休克亚组分别为35、75例,非休克亚组和合并休克亚组TLR4 mRNA水平分别为0.118(0.323)和0.210(0.330),两亚组TLR4 mRNA水平比较,差异有统计学意义(Z=1.473,P=0.026)。
2.4 外周血单个核细胞TLR4 mRNA和PCT单独或联合检测对脓毒症的诊断价值 外周血单个核细胞TLR4 mRNA单独诊断脓毒症的AUC为0.813时,对应的截断值为0.056,95%CI为(0.760,0.859),灵敏度为80.00%,特异度为68.97%,约登指数为0.489 7;血清PCT单独诊断脓毒症的AUC为0.818时,对应的截断值为0.070μg/L,95%CI为(0.768,0.861),灵敏度为87.63%,特异度为75.94%,约登指数为0.635 6;联合检测诊断脓毒症的AUC为0.888时,95%CI为(0.841,0.925),灵敏度为68.04%,特异度为93.10%,约登指数为0.611 4,见图2。

图2 外周血单个核细胞TLR4 mRNA和PCT单独或联合检测诊断脓毒症的ROC曲线Figure 2 ROC analysis of TLR4 mRNA in peripheral blood mononuclear cells,PCT alone and combination for the diagnosis of sepsis
3 讨论
脓毒症发展迅速,死亡率高达25%~30%[12],因此及时诊断脓毒症对脓毒症治疗至关重要。本研究结果显示,脓毒症组较非脓毒症组和对照组WBC、NEU、ALT、AST、DBiL升高,RBC、Hb、HCT、PLT降低,与HORNIK等[13]研究结果相同。WBC与NEU是临床判断有无炎症的基本指标[1]。中性粒细胞可通过释放蛋白酶和活性氧自由基促进脓毒症的过度炎性反应,而全身性的促炎细胞因子大量释放将引发细胞因子风暴[14],从而造成器官损伤。脓毒症常并发肝功能障碍,可见ALT、AST与DBiL升高,其机制包括休克和复苏引起的缺氧性肝损伤以及由中性粒细胞促炎反应产物如组织坏死因子α、IL-1、IL-6、IL-12,由革兰阴性菌的内毒素激活的Kupffer细胞释放的活性氧以及来自革兰阳性菌的脂蛋白和磷壁酸等引起的继发性肝损伤[15]。贫血是脓毒症患者常见的问题,表现为RBC、Hb、HCT与PLT降低,本研究结果与MUADY等[16]研究一致,导致脓毒症Hb水平急剧下降的机制有全身炎性反应诱导红细胞生成减少,以及由于溶血和出血导致红细胞破坏增加。血小板的消耗可能与脓毒症相关弥散性血管内凝血有关[17]。
LPS是革兰阴性菌的膜组分,是诱导脓毒症的重要物质[18]。大量LPS释放入血与TLR4结合引发核转录因子(NF)-κB信号通路产生大量细胞因子,抗炎-促炎平衡被打破,造成器官损伤,影响预后甚至危及生命[19]。本研究发现,脓毒症患者TLR4 mRNA较对照组增高,与KUZMICH等[20]研究发现的机体感染时TLR4 mRNA上调相符。脓毒症组与非脓毒症组TLR4 mRNA表达具有明显差异,可作为鉴别普通感染与脓毒症患者的指标。本研究发现TLR4 mRNA诊断脓毒症的AUC为0.813时,灵敏度为80.00%,特异度为68.97%。ROHSISWATMO等[5]研究发现TLR4表达诊断脓毒症的灵敏度为92.1%、特异度为11.4%,AUC为0.528,可能与该研究对象为新生儿,而本研究对象多为中老年人有关,推测TLR4表达在不同年龄段可能存在差异。
在感染条件下血清PCT的升高受到炎性递质的刺激,如肿瘤坏死因子(TNF)-α、IL-6、IL-1和其他细胞因子[21]。在血液培养确认之前,PCT已被广泛使用于临床诊断。本研究发现PCT诊断脓毒症的AUC为0.818时,对应截断值为0.07 μg/L,灵敏度为87.63%,特异度为75.94%,而BOLANAKI等[22]研究发现PCT诊断急诊脓毒症的AUC为0.86,对应截断值为0.5μg/L,灵敏度为63.4%,特异度为89.2%,其原因可能是本研究选取全院各科室患者,而BOLANAKI等[22]研究仅选择急诊科室脓毒症患者。急诊科患者病情常更严重,手术、肠壁缺血、一些副癌综合征和癌症等也会使PCT升高。PCT在烧伤等无感染的情况下也可能升高,且PCT预测革兰阴性菌血症的诊断准确性尚有争议[10,23-24]。TLR4 mRNA联合PCT诊断脓毒症的AUC为0.888时,灵敏度为68.04%,特异度为93.10%,优于单项检测结果。
综上所述,外周血单个核细胞TLR4 mRNA与血清PCT均可作为脓毒症诊断的有效指标,且二者联合检测可进一步提高脓毒症的诊断效能,对临床诊断有重要的参考价值。
作者贡献:胡元慧负责文章的构思与设计、结果的分析与解释、撰写并修订论文,对文章整体负责;汤冬玲进行数据收集、整理及统计学处理、图表绘制;张平安负责文章的质量控制、监督管理及审校。
本文无利益冲突。

