强精煎介导PI3K/Akt/mTOR通路调控少精子症大鼠精子发生的实验研究
陆海旺,宾彬,林思伟,王德胜,王杰,蓝艳梅
(广西中医药大学第一附属医院,广西 南宁 530023)
近年来,男性不育症的发生率逐渐升高,严重影响患者家庭和谐,少精子症是男性不育症常见的临床表现,是指男性精子浓度<15×106/mL 或一次射精的精子总数<39×106(需严格禁欲2~7 d,且优先考虑精子总数)。少精子症的发生,常由于睾丸发育障碍、生精细胞功能缺陷,或由于输精管不完全梗阻、炎症、感染等多方面因素引发,也有较大比例原因不明的少精子症,即特发性少精子症,可能涉及内分泌、基因、染色体和免疫等多方面与生精功能密切相关的环节,需进一步深入探讨和阐明其机理。现代医学尚缺乏针对特发性少精子症疗效确切的药物,更多停留在经验性治疗阶段,常用手段有抗氧化、抗雌激素、补充微量元素等,大多疗效不确切或存在争议。辅助生殖技术虽然解决了众多患者的生育问题,但并没有从病因上去干预,本质上是绕开病因的一种手段。辅助生殖技术还存在伦理争议、成本高昂、成功率令人不甚满意、对女方潜在的各种损害等缺陷。通过治疗改善精子质量而实现自然生育,仍然是临床医师和患者共同追求的愿望,也更符合优生优育的要求。中医药治疗男性不育历史悠久,经验丰富,疗效独特,优势显著,但其作用机理尚未完全阐明。强精煎为笔者多年来用于治疗少、弱精子症的经验方,具有健脾益肾、清热利湿活血的功效,前期实验和临床研究已证实[1],强精煎可通过抗氧化[2]和抗生精细胞凋亡[3]等多方面作用,有效改善精子数量和活力。
近年有研究表明PI3K/Akt/mTOR/p70S6K/4EBP1信号通路可调控生精细胞增殖、分化和精子发生,对少精子症的转归起到关键的调节作用[4]。中医药通过调控以上通路,以干预精子发生,改善少精子症,增加精子数量的相关报道比较少见,研究大多仅涉及通路的一部分。本研究采用环磷酰胺(CTX)诱导大鼠少精子症模型,探讨强精煎对少精子症模型大鼠的治疗作用及其对PI3K/Akt/mTOR 通路及其下游通路(p70S6 K/4EBP1)的调控作用,以进一步揭示强精煎治疗少精子症的分子生物学机制,丰富中医药治疗少精子症的理论依据和内涵。
1 材料与方法
1.1 材料
1.1.1 动物来源与分组
清洁级雄性SD 大鼠75 只,购自长沙天勤生物技术公司,8~10 周龄,体质量(250 ± 10)g,动物许可证号:SCXK(湘)2014-0011。本项目实验已经广西中医药大学伦理委员会审查备案通过。大鼠随机分为空白对照组、模型组、mTOR 通路抑制剂组(雷帕霉素组)和强精煎+雷帕霉素组和强精煎组,每组15只。
1.1.2 主要试剂、仪器及药物
各免疫组化一抗试剂盒(PI3K:sc-376112、Akt:sc-377457、mTOR:ab32028、p70S6K:sc-8418、4EBP1:sc-9977、Ki-67:ab15580,均采购于Santa Cruz 公司);免疫组化二抗试剂盒(货号:SP0041,北京索莱宝公司);PCR 试剂盒(货号:RR047A)、引物均由宝生物公司提供。
ASP300S 全自动组织脱水机、ST5020 多功能染色机、DM3000 生物显微镜、图像采集软件Leica Application Suite V4(德国Leica公司);LightCycler®480实时荧光定量PCR 仪(罗氏公司);Mastercycle Nexus PCR循环仪(eppendoff公司)。
强精煎(当归10 g,枸杞子20 g,黄芪30 g,益母草30 g,鹿角霜15 g,五味子10 g,续断20 g,党参15 g,生牡蛎30 g,神曲10 g,菟丝子20 g和紫河车10 g)由天江药业有限公司提供(机配免煎);环磷酰胺冻干粉(Baxter Oncology GmbH 公司,批号:0C371A);雷帕霉素(上海麦克林生化科技有限公司,批号:C11542563)。
1.2 方法
1.2.1 造模与给药
预实验参考其他文献[5]采用大剂量(50 mg)环磷酰胺短期(5 d)连续腹腔注射诱导少精子症大鼠模型,成模率不理想且病死率过高,实验的可靠性有限,笔者经反复尝试后证实,采用较低剂量20 mg/(kg·d)环磷酰胺经腹腔注射给药,连续14 d可获得稳定可靠的少精子症大鼠模型,造模病死率相对较低,经长期(8周)观察,睾丸仍处于萎缩-低生精状态,弥补了生精功能自然恢复导致的数据不可靠的缺陷。见图1。
根据徐淑云主编的《药理实验方法学》,使用基于人和大鼠之间的体表面积转换的等效剂量比,计算出大鼠的等效剂量。测算后强精煎高剂量(等效剂量4 倍)为12 g/(kg·d),前期研究已证实该给药剂量可显著增加少精子症大鼠的精子数量和活动力[6]。造模成功后,雷帕霉素组给予雷帕霉素2 mg/(kg·d)腹腔注射[7];强精煎+雷帕霉素组在雷帕霉素组基础上给予强精煎配方颗粒12 g/(kg·d)灌胃;强精煎组给予强精煎配方颗粒12 g/(kg·d)灌胃;空白对照组和模型组大鼠每天给予生理盐水灌胃。每周复测大鼠体质量作为动态调整给药剂量的依据。连续给药38 d,足1个大鼠生精周期[8]。
1.2.2 标本采集与制备
于末次给药24 h后,以3%戊巴比妥钠溶液腹腔注射麻醉各组大鼠,剪开腹腔,将双侧睾丸拖出,去除附睾、脂肪等组织,完整分离睾丸,吸干血迹,一侧睾丸迅速置于-80 ℃超低温冰箱中待测,剩余睾丸组织放入10%浓度的甲醛溶液中,4 ℃冷藏24 h固定,待下一步操作。
1.2.3 采用IHC(免疫组化)法检测Ki-67、PI3K、Akt、mTOR、p70S6K、4EBP1蛋白表达
样品处理按IHC 试剂盒要求进行,基本步骤有脱蜡-修复-封闭-加抗体-染细胞核-脱水封片等。对每个样本,在显微镜200 倍条件下随机采集5 个视野,每个视野用IPP 进行阳性总面积、平均光密度和总光密度(IOD)测量,并统计分析各组总光密度(IOD)差异。
1.2.4 RT-PCT 检 测PI3K、Akt、mTOR、p70S6K、4EBP1基因表达
采用Trizol 法提取RNA:将大约50 mg 的睾丸组织加入到Trizol EP管中匀浆,转到无RNase EP管中裂解。加入氯仿,低温高速离心15 min。转移到新的EP管,加异丙醇混匀。低温高速离心获得RNA 沉淀。去掉上清,加去酶75%乙醇,混匀,低温离心。去掉上清,将沉淀空气干燥,其后以DEPC 水溶解,吸取该溶解液1 μL以DEPC水稀释,用紫外分光光度计测定RNA的纯度和浓度。逆转录:①去除DNA 反应条件为42 ℃2 min;②4 ℃逆转录,反应条件为37 ℃15 min,85 ℃5 s,4 ℃10 min。引物序列见表1。实时荧光定量PCR检测(TB GreenTM Premix ExTaqTM Ⅱ:RR820 A)部分样本的cDNA 做10 倍稀释,反应条件:95 ℃30 s,1 cycle;95 ℃5 s,60 ℃30 s,40 cycles。绘制溶解曲线。实验检测过程中,进行3个重复孔实验设计,最后结果2-△△Ct进行统计分析。数据结果要求3个重复孔间CP、Tm数值相差在±0.5之间,以保证实验操作稳定,重复性好。

表1 引物序列
1.3 统计学方法
采用SPSS 26.0 软件进行实验数据处理,正态分布的计量资料采用均数±标准差(±s)表达,组间比较采用单因素方差分析,事后组间多重比较采用LSD-t检验(即主要进行有专业意义的组间比较),检验水准α= 0.05,以P<0.05 代表差异具有统计学意义。
2 结果
2.1 各组大鼠睾丸组织PI3K、Akt、mTOR、p70S6K、4EBP1、Ki-67蛋白表达水平比较
与空白对照组对比,模型组和雷帕霉素组PI3K、Akt、mTOR、p70S6K、4EBP1、Ki-67蛋白表达水平均显著下调,差异有统计学意义(P<0.05)。其中,雷帕霉素组mTOR蛋白表达水平降低更为显著(P<0.01);与模型组比较,强精煎+雷帕霉素组、强精煎组mTOR、PI3K、Akt、p70S6K、Ki-67、4EBP1 蛋白表达水平均显著上调,差异有统计学意义(P<0.05)。同时,从免疫组化切片也可以看出,空白对照组大鼠睾丸生精上皮结构完整,生精细胞连接紧密,精子密集分布填充于管腔,提示生精活跃;而模型组大鼠睾丸组织生精上皮结构明显破坏,生精细胞层次不完整,精子数量锐减现象普遍存在,提示生精功能受到明显抑制;雷帕霉素组生精细胞减少和缺失等病理损伤现象尤为明显,精子数量更少;经干预后,强精煎+雷帕霉素组、强精煎组大鼠睾丸组织生精上皮病理损伤得到明显修复,生精细胞层次较为完整,生精较为活跃,提示在强精煎干预下,大鼠损伤的生精功能已得到明显改善。见图2~图7。

图2 各组大鼠睾丸组织PI3K蛋白表达比较
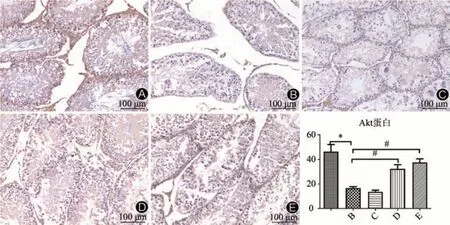
图3 各组大鼠睾丸组织Akt蛋白表达比较

图4 各组大鼠睾丸组织mTOR蛋白表达比较

图5 各组大鼠睾丸组织4EBP1蛋白表达比较

图6 各组大鼠睾丸组织p70S6K蛋白表达比较

图7 各组大鼠睾丸组织Ki-67蛋白表达比较
2.2 各组大鼠睾丸组织PI3K、Akt、mTOR、p70S6K、4EBP1基因表达比较
与空白对照组对比,模型组和雷帕霉素组PI3K、Akt、mTOR、p70S6K、4EBP1 基因表达水平均明显降低,差异有统计学意义(P<0.05)。其中,雷帕霉素组表达水平降低更为显著(P<0.01);与模型组、雷帕霉素组相比,强精煎+雷帕霉素组、强精煎组PI3K、Akt、mTOR、p70S6K、4EBP1 基因表达水平均显著升高,差异有统计学意义(P<0.05)。由此可见,以上基因表达趋势与免疫组化蛋白表达结果是基本相同的。见图8。

图8 各组大鼠睾丸组织PI3K、Akt、mTOR、p70S6K、4EBP1基因表达比较
3 讨论
除梗阻因素等特殊情况外,精子数量主要取决于精子发生的活跃程度。精子发生是指从精原细胞到形成精子的过程。基本过程包括精原细胞分裂增殖成精母细胞、精母细胞经过减数分裂形成单倍体的精子细胞、精子细胞变态形成精子这三个阶段[9],其中任何一个环节出现停滞和障碍,都将影响最后的精子数目,可以说是少精子症发生的根本原因。少精子症与睾丸组织基因表达异常或信号传导异常所致的生精障碍关系密切。其中,精原细胞分裂增殖是精子发生数量的基础,复杂的基因和蛋白网络调控着这一细胞增殖进程,其中信号因子和信号通路有着突出作用[9],这也是近年来有关生精细胞增殖和精子发生的研究热点。PI3K/Akt/mTOR/p70S6K 信号转导通路是调控细胞增殖的重要转导通路之一[10],该信号通路在细胞的生长、增殖、分化和存活中扮演中心调控角色[11]。细胞信号分子与细胞膜受体及受体底物结合后,能够激活RTK/P13K/Akt 及其下游mTOR 信号级联[12-13],抑制PI3K/Akt/mTOR则可诱导细胞周期停滞和细胞凋亡[14]。
雷帕霉素靶蛋白(mTOR)是Akt 的重要底物之一,属于磷酸肌醇相关激酶家族成员,是一种重要的信号传导分子[9],是细胞代谢的中枢调节器之一[15],能够调控细胞增殖、分化、细胞周期、能量代谢等细胞活动。PI3K/Akt 信号通路通过调节mTOR 信号及其下游靶因子p70S6K/4EBP1 的表达,进而影响靶细胞或靶器官的结构和功能[16-19]。精原干细胞和精母细胞均有mTOR、p70S6 K、4EBP1 及相应磷酸化蛋白(p-mTOR、p-p70S6K、p-4EBP1)的 表 达[4],且mTOR 信号对早期生精细胞和精原干细胞表型维持及分化有重要作用[20]。抑制mTORC1 通路可阻断精原细胞的分化,诱导未分化精原细胞在生精小管中的积聚,并阻断睾丸组织中编码酪氨酸激酶受体ckit(kit)基因的翻译[21],精原细胞p70S6K 磷酸化水平也受其调控。雷帕霉素可抑制睾丸中mTOR 蛋白的表达,抑制睾丸精原细胞的增殖和分化。同时,mTOR 蛋白下游的p-p70S6K 和p-4EBP1 表达降低,维甲酸8 激活基因的表达也受到抑制,而维甲酸8是启动减数分裂的关键基因[20],抑制p70S6K/4EBP1信号可能导致哺乳动物睾丸毒性,如生精小管退化和生精细胞数量减少[7]。mTOR、p-p70S6K 和p-4EBP1在大鼠睾丸组织中的表达随着大鼠年龄增长而降低,这表明mTOR 及其下游通路p70S6K/4EBP1 参与调节精原细胞增殖及其向精子的分化[7]。综上所述,以上通路控制了生精细胞的产生和增殖,最终影响精子数量。
雷帕霉素类似物治疗可影响精原细胞分化增殖,同时抑制下丘脑-垂体-性腺轴,干扰生殖内分泌。使用雷帕霉素治疗肿瘤或肾脏移植后免疫抑制反应的过程中,可导致男性患者生精功能障碍,表现为少精子症、无精子症[22]。动物实验也表明,雷帕霉素可导致大鼠睾丸萎缩、生精上皮空泡化、曲细精管管腔萎缩稀疏、生精细胞层数减少甚至缺如、腔内精子减少或无精子、间质细胞增生等[23]。Ki-67 作为细胞增殖相关的核抗原,其表达水平与细胞增殖活跃度呈正相关,常用作评估细胞增殖程度的标记物[24]。
国医大师王琦认为“肾虚夹湿、热、瘀、毒、虫”是少、弱精子症的根本病机[25]。笔者以为,治疗少、弱精子症,应先天、后天并重,生精、强精当脾肾气血并调,在补肾生精的同时,注重兼顾脾胃后天之本,增强脾胃运化水谷精微的能力,使得生精有源,切勿“徒补其肾”。强精煎方中党参健脾益气,菟丝子、枸杞子“以子补子”,共为君药。黄芪-当归药对实为当归补血汤,功能益气补血养血;续断补肝肾、壮腰膝,精不足者补之以味,紫河车、鹿角霜助君药生精,共为臣药。益母草清热活血散瘀,五味子“益男子精”,生牡蛎潜阳固精,共为佐药。六神曲健脾和胃为使药,诸药合用共奏健脾益肾、清热散瘀、生精强精之效。强精煎的前期临床研究提示,该方可明显改善少、弱精子症患者的精子数量和活力,实验研究发现该方有抗氧化、抗生精细胞凋亡等作用,但对其调控精子发生的作用尚未深入探讨。本研究在对重度少精子症大鼠模型进行强精煎干预后发现,与模型组比较,经中药强精煎干预的两组大鼠睾丸萎缩现象得到改善,睾丸生精上皮得到较好的修复,精子数量上升,表明强精煎可拮抗生精上皮病理损伤,促进少精子症大鼠精子发生,改善睾丸低生精状态。
本研究结果显示,模型组大鼠睾丸组织中PI3K、Akt、mTOR、p70S6K、4EBP1、Ki-67 蛋白表达均低于空白对照组,提示模型组大鼠睾丸生精受损与PI3K/Akt/mTOR 通路及其下游靶因子(p70S6K、4EBP1)、细胞增殖标记蛋白Ki-67 表达受到抑制,生精细胞增殖分化减弱有关。给予mTOR 通路抑制剂雷帕霉素后,雷帕霉素组大鼠mTOR 蛋白及基因表达降低尤为明显,下游靶因子p70S6K、4EBP1 表达亦显著下调,睾丸病理损伤最为严重,这提示mTOR 通路被抑制后,大鼠睾丸生精发生明显受阻。给予强精煎干预后的两组大鼠PI3K、Akt、mTOR 通路蛋白,下游靶蛋白p70S6K、4EBP1,Ki-67 蛋白表达均显著上调,同时PI3K、Akt、mTOR、p70S6K、4EBP1 基因表达水平也显著上调,提示强精煎改善少精子症大鼠模型生精作用可能是通过激活PI3K/Akt/mTOR 通路及其下游靶基因/蛋白表达来实现的。
综上所述,强精煎可能通过激活PI3K/Akt/mTOR通路蛋白及其下游靶基因/蛋白(p70S6 K、4EBP1)以及细胞增殖标记蛋白Ki-67 的表达,改善少精子症大鼠的生精功能,修复睾丸病理损伤,促进精子发生,增加精子数量。PI3K/Akt/mTOR/p70S6K/4EBP1 通路调控精子发生作用机制较为复杂,而且强精煎为复方中药制剂,其发挥治疗作用的具体有效成分和更精细的机制尚有待深一步研究探索。

