黄蜀葵花总黄酮通过激活AMPK/mTOR通路调控自噬改善克罗恩病肠道纤维化
张慧翔,张丹,钱海华,王雅丽,曾莉✉
(1.南京中医药大学第一临床医学院,江苏 南京 210023;2.江苏省中医院,江苏 南京 210023)
克罗恩病(Crohn's disease,CD)是一种慢性、反复性的炎症性肠病(inflammatory bowel disease,IBD),其临床症状包括腹痛、腹泻、发热、疲劳和体质量减轻[1]。肠道纤维化是CD 的常见并发症之一。由于CD 的透壁性炎症,纤维化可能涉及肠壁的所有层次,导致肠道的增厚和狭窄[2],甚至造成肠梗阻。欧洲的一项队列研究显示,在被确诊为CD 的5年内,14%的患者出现狭窄或穿透性并发症[3]。研究表明,狭窄性CD 对常用于治疗CD 的TNF 抑制疗法没有明显反应[4]。当前肠道狭窄的主要治疗方式为球囊扩张、狭窄成形术和手术切除,但大多数CD 患者会在术后出现临床复发,需要进一步治疗,其中大约20%的患者需要再次手术[5]。因此,有必要研发治疗CD肠道纤维化的有效药物。
自噬是一种细胞内代谢机制,细胞质中的物质通过自噬体被送到溶酶体中被降解[6]。通过该过程,自噬在人体中发挥着保护细胞、保护组织和抗炎的作用[7],对炎症性疾病和自身免疫性疾病具有重要意义。据报道,CD的病因主要涉及基因易感性、家族史、环境因素、肠道免疫系统失调和微生物群紊乱[1]。而自噬有关基因,包括IRGM、NOD2和ATG16L1等均与CD 密切相连[7-8]。综上,自噬可能与CD 的发病有着内在联系。此外,研究表明自噬是多器官纤维化疾病的一个重要调节器[9],从自噬角度出发可能会为治疗CD 肠道纤维化提供新的治疗机制。
腺苷酸活化蛋白激酶(AMP-activated proteinkinase,AMPK)是一种稳健的能量状态传感器,由AMP与ATP状态调节,启动能量平衡机制[10]。mTOR复合物1(mTOR complex 1,mTORC1)是雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)与伴生蛋白结合产生的差异信号综合体,可根据营养环境调节细胞的生长和代谢[11]。AMPK/mTOR 通路是自噬上游的一条关键通路。在营养丰富时,mTORC1磷酸化ULK1,阻断其被AMPK 激活,达到抑制自噬启动的目的[12]。当处于营养不足时,AMPK 通过磷酸化和激活TSC2以及磷酸化并抑制Raptor(mTOR的调节相关蛋白)降低mTORC1的活性,同时磷酸化并激活ULK1,引发自噬级联的启动[10]。故本研究选用AMPK/mTOR 通路作为深入探讨自噬与CD肠道纤维化内在关联的指标。
黄蜀葵花总黄酮(total flavone ofAbelmoschus manihot,TFA)是锦葵科秋葵属植物黄蜀葵花的主要成分,具有抗炎、抗氧化、抗抑郁、免疫调节等作用[13]。研究报道,TFA 可以通过调节上皮间质转变来缓解TGF-β 诱导的CD 肠道纤维化[14],并减少肠道纤维化小鼠模型中的细胞外基质(extracellular matrix,ECM)沉积[15]。然而,其中的机制仍需进一步研究。
因此,本研究通过分离大鼠原代细胞,从细胞自噬的角度,探讨TFA 对肠道成纤维细胞的作用及分子机制,为防治CD肠道纤维化提供基础理论依据。
1 材料
1.1 实验动物
选择健康SPF 级SD 雄性大鼠20 只,体质量180~200 g,购自杭州医学院,动物许可证号:SCXK(浙)2019-0002。饲养条件:分笼饲养于南京中医药大学实验动物中心SPF 级动物房,温度为23~25 ℃,相对湿度为50%~60%,每日光照12 h,大鼠被允许自由饮水与采食。所有实验研究均依照南京中医药大学附属医院实验动物研究伦理规范和许可进行(伦理号:2020DW-30-01)。
1.2 药物与试剂
TFA 由南京中医药大学附属医院制剂部提供;雷帕霉素(rapamycin,RAPA)(上海MCE 公司,货号:HY-10219);胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)(美国Abcam 公司,货号:ab198570);AMPK 抑制剂化合物C(Compound C,CC)(selleck 公司,货号:S7306)、磷酸盐缓冲液(phosphate buffered saline,PBS)(美 国Gibco 公 司,货 号:10010023);CCK-8试剂盒(上海碧云天生物科技有限公司,货号:C0038);逆转录试剂盒、SYBR 试剂盒(上海翌圣生物科技公司,货号:11201ES03、11123ES60)。
Collagen Ⅰ、β-actin、LC3 Ⅱ、Beclin-1、p62、Vimentin、α-SMA、AMPK、mTOR、p-mTOR 抗体(美国Proteintech 公司,货号:14695-1-AP、66009-1-Ig、14600-1-AP、11306-1-AP、18420-1-AP、10366-1-AP、14395-1-AP、10929-2-AP、66888-1-Ig、67778-1-Ig);ATG16L1、p-AMPK、4EBP1、p-4EBP1、p70S6K、p-p70S6K 抗体(美国Abcam 公司,货号:ab188642、ab133448、ab32024、ab278686、ab32529、ab59208);进口血清Opti-MEM(美国Gibco 公司,货号:31985062);mRFP-GFP-LC3 质粒(上海GeneTalk公司,货号GT-AP-V103);Collagen Ⅰ、β-actin 引物序列均由通用生物公司设计。
1.3 仪器
细胞培养箱(上海SANYO),倒置显微镜、荧光显微镜(日本OLYMPUS 公司),台式低速离心机(北京大龙兴创实验仪器有限公司),凝胶成像分析仪(上海勤翔),共聚焦显微镜(美国NIKON 公司),PCR 仪(德国Eppendorf 公司)。
2 方法
2.1 提取大鼠原代肠道成纤维细胞
根据参考文献[16-17]中的步骤,进行大鼠原代肠道成纤维细胞提取。将细胞培养于37 ℃,5%CO2培养箱中,并根据细胞生长状况更换培养基。
2.2 免疫荧光法鉴定原代肠道成纤维细胞
取IFs 细胞接种于6 孔板中,固定后,用PBS 清洗3次。0.1%Triton X-100透化,PBS清洗。5%BSA 液封闭20 min。加入Vimentin、α-SMA 抗体在4 ℃下孵育过夜。PBS 清洗后,加入二抗孵育1 h,清洗后滴加DAPI,封片观察。
2.3 CCK-8法测定TFA和RAPA的最佳浓度及时间
将含有5 × 103个细胞的100 μL 细胞悬液置于96 孔板中。培养过夜后,用无血清培养基或含RAPA(1、5、10 nmol/mL)、含TFA(5、10、25、50、75、100、150、200 μg/mL)的无血清培养基培养细胞24、48、72 h。培养结束后利用CCK-8 试剂盒检测细胞生长状况,在450 nm波长下进行读数。
2.4 分组与干预
2.4.1 TFA 对IFs 细胞合成Ⅰ型胶原蛋白及自噬的影响
根据CCK-8的结果,选择浓度为5、10、50 μg/mL 的TFA 作为TFA 的工作浓度。将IFs 细胞随机分为对照组、模型组和TFA 低、中、高剂量组。对照组不做任何处理;模型组用100 ng/mL 的IGF-1 干预24 h;TFA 低、中、高剂量组用100 ng/mL 的IGF-1 干预24 h 后,再用5、10、50 μg/mL 的TFA 处理48 h。
2.4.2 TFA 与IFs 细胞中自噬相关通路AMPK/mTOR的关系
根据CCK-8 的结果,选择浓度为5 nmol/mL 的RAPA 作为RAPA 的工作浓度。将IFs 细胞分为对照组、模型组、TFA组、TFA+CC组和TFA+RAPA组。对照组不做任何处理;模型组用100 ng/mL 的IGF-1 干预24 h;TFA 组用100 ng/mL 的IGF-1 干预24 h 后,再用10 μg/mL的TFA处理48 h;TFA+CC组用100 ng/mL的IGF-1 干预24 h 后,再 用10 μg/mL 的TFA 联 合10 μmol/mL的CC处理48 h;TFA+RAPA组用100 ng/mL的IGF-1 干 预24 h 后,再 用10 μg/mL 的TFA 联 合5 nmol/mL的RAPA处理48 h。
2.5 Western blot
使用RIPA 裂解液提取总蛋白,测定、统一蛋白质浓度后煮沸变性。运用SDS-PAGE胶进行蛋白电泳,转膜封闭,加入稀释后的一抗,4 ℃下过夜孵育。PBST洗涤3 次后,加入相应二抗室温下孵育1.5 h。清洗后借助凝胶成像分析仪曝光显影,Image J 软件分析灰度值,β-actin为内参蛋白。
2.6 免疫荧光
除抗体外,其余步骤同“2.2”项下的处理方法。
2.7 qRT-PCR
Trizol 试剂提取细胞总RNA,测定RNA 浓度和纯度后定量,逆转录试剂盒将总RNA 逆转录为cDNA,根据SYBR 试剂盒设定PCR 扩增反应体系,上机检测。采用2-ΔΔCT法计算mRNA 相对表达量。β-actin 为内参。引物序列见表1。

表1 qRT-PCR 引物序列
2.8 mRFP-GFP-LC3实验检测IFs细胞自噬流
转染步骤参考Lipofectamine 2000 说明书进行。将含有mRFP-GFP-LC3 质粒和Lipofectamine 2000的空白DMEM 滴入6孔板,培养IFs细胞8 h。然后,用完全培养基培养24 h 后,用PBS 清洗IFs 细胞,采用共聚焦显微镜检测。
2.9 统计学方法
实验数据用Graph Pad Prism 8.0.2 统计软件进行分析。数据以均数± 标准差表示(n= 3)。多组间的差异采用单因素方差分析,P<0.05 表示差异有统计学意义。
3 结果
3.1 原代肠道成纤维细胞的鉴定
根据免疫荧光结果所示,细胞表达Vimentin(绿色荧光),不表达α-SMA(无明显荧光),细胞核呈蓝色荧光,且95%以上的细胞均呈现该特征,证明提取的细胞为肠道成纤维细胞。见图1。

图1 免疫荧光鉴定细胞特征图
3.2 TFA和RAPA的最佳工作浓度及干预时间
本研究选择浓度为5、10、50 μg/mL 的TFA 和浓度为5 nmol/mL 的RAPA 作为工作浓度进行后续的实验,干预48 h,对肠道成纤维细胞存活率影响见图2和图3。

图2 TFA对IFs细胞存活率的影响

图3 RAPA对IFs细胞存活率的影响
3.3 对IGF-1诱导的IFs细胞Collagen Ⅰ的影响
与对照组相比,模型组Collagen Ⅰ蛋白表达及mRNA 水平显著上升(P<0.01)。与模型组相比,TFA低、中、高剂量组中的Collagen Ⅰ蛋白表达及mRNA 水平明显下调(P<0.01),其中Collagen Ⅰ的表达与TFA浓度呈负相关,表明TFA 具有抑制IFs 细胞合成Ⅰ型胶原蛋白的作用。见图4。

图4 TFA对IFs细胞Ⅰ型胶原蛋白(Collagen Ⅰ)合成的影响
3.4 TFA对IGF-1诱导的IFs细胞自噬的影响
免疫荧光结果显示,与对照组相比,模型组中LC3Ⅱ、Atg16L1、Beclin-1 蛋白的表达减弱,p62 蛋白表达增强;与模型组相比,TFA 低中高剂量组中LC3Ⅱ、Atg16L1、Beclin-1 蛋白表达水平增强,p62蛋白表达下降。见图5。mRFP-GFP-LC3 结果显示,与对照组相比,模型组中细胞红色荧光信号减弱,黄色荧光信号降低,表明自噬流减少;与模型组相比,TFA 低、中、高剂量组中红色和黄色荧光信号均增强,自噬流增多,并且与TFA 浓度呈正相关。见图6。mRFP-GFP-LC3 实验和免疫荧光结果表明,TFA 能够促进IFs 细胞自噬。

图5 免疫荧光检测TFA对IFs细胞中自噬相关蛋白的影响

图6 mRFP-GFP-LC3检测TFA对IFs细胞中自噬流的影响
3.5 AMPK/mTOR 通路对TFA 干预的IFs 细胞模型合成Ⅰ型胶原蛋白的影响
AMPK/mTOR通路是自噬的一个关键通路,本研究采用了AMPK抑制剂化合物C(CC)、mTOR抑制剂雷帕霉素(RAPA)与TFA联合使用干预IGF-1诱导的IFs细胞。结果与TFA 组相比,TFA+CC 组Collagen Ⅰ蛋白表达及mRNA 水平明显上升(P<0.01),TFA + RAPA组中Collagen Ⅰ蛋白表达及mRNA 水平下降(P<0.01),表明AMPK/mTOR通路对TFA抑制IGF-1诱导的IFs细胞合成Ⅰ型胶原蛋白有调控作用。见图7。

图7 AMPK/mTOR通路对TFA调节IFs细胞合成Ⅰ型胶原的影响
3.6 AMPK/mTOR 通路对TFA 干预的IFs 细胞模型自噬的影响
与TFA 组相比,TFA + CC 组的趋势则相反,免疫荧光结果显示,LC3Ⅱ、Atg16L1、Beclin-1 蛋白水平减弱,p62 蛋白水平升高;TFA + RAPA 组中免疫荧光结果显示,LC3Ⅱ、Atg16L1、Beclin-1 蛋白荧光表达上升,p62 蛋白荧光表达下降。 见图8。mRFP-GFP-LC3 结果显示,TFA+CC 组细胞中红色及黄色荧光信号皆相对减少,自噬流下降;TFA+RAPA 组细胞中红色荧光信号与黄色荧光信号均上升,自噬流增加。见图9。表明AMPK/mTOR 通路对TFA 干预的IFs 细胞模型中的自噬具有调控作用。

图8 AMPK/mTOR通路对TFA干预的IFs细胞模型中自噬相关蛋白的影响
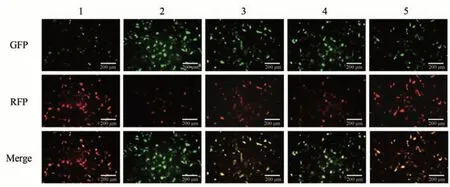
图9 AMPK/mTOR通路对TFA干预的IFs细胞模型中自噬流的影响
3.7 TFA 对IGF-1 诱导的IFs 细胞中AMPK/mTOR通路的影响。
与对照组相比,模型组中p-AMPK/AMPK 比值减少,p-mTOR/ mTOR、p-p70S6K/p70S6K 和p-4EBP1/4EBP1 比值增多(P<0.01)。与模型组相比,TFA 组中p-AMPK/AMPK 比值上升 ,p-mTOR/mTOR、p-p70S6K/ p70S6K 和p-4EBP1/4EBP1 比值减弱(P<0.01)。与TFA 组相比,TFA+CC 组下调了p-AMPK/AMPK 比值,上调了p-mTOR/mTOR、p-p70S6K/p70S6K 和p-4EBP1/4EBP1 的比值;TFA + RAPA 组则相反(P<0.01)。说明TFA 可能对IGF-1 诱导的IFs细胞中AMPK/mTOR通路具有激活作用。见图10。
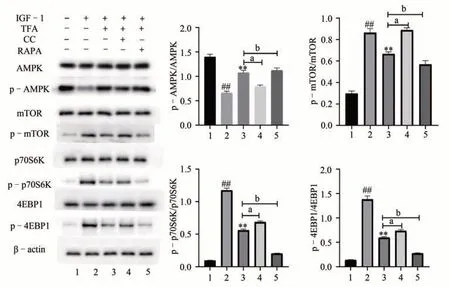
图10 TFA对IGF-1诱导的IFs细胞AMPK/mTOR通路的影响
4 讨论
肠道纤维化作为CD最具危险性的并发症之一,可能致使肠道狭窄和梗阻,给患者带来极大的健康和经济负担[18]。当前研究认为CD的慢性炎症刺激肠道中ECM的过度沉积和肌肉增厚,造成肠道纤维化的发生[2]。ECM中胶原蛋白的沉积和交联致使的肠道僵硬则促进了纤维化的进程[19]。据报道,CD 患者的肠道组织中成纤维细胞增殖更快[20]。Ⅰ型胶原蛋白是肠道成纤维细胞分泌的主要胶原蛋白(约80%),其作为ECM 的组成部分,进一步推动纤维化的发展[21]。因此,抑制肠道成纤维细胞合成Ⅰ型胶原蛋白是改善ECM、控制和预防肠道纤维化的一个重要方向。故本研究采用具有促进胶原蛋白产生和增殖作用的生长因子IGF-1[22]干预IFs细胞建立细胞模型,实验结果显示,经过IGF-1处理后的IFs 细胞Collagen Ⅰ蛋白表达及mRNA 水平均明显上升,表明细胞模型建立成功。当TFA 干预IGF-1诱导的IFs 细胞时,Collagen Ⅰ蛋白及mRNA 表达下降。说明TFA可以抑制IFs细胞中Ⅰ型胶原蛋白的合成。
自噬及其相关通路具有平衡炎症和免疫的作用[23]。CD 作为炎症性肠病的一种,与溃疡性结肠炎相比,更容易受遗传因素的影响[24]。而研究发现,CD 易感患者的自噬相关基因如ATG16L1、IRGM、LRRK2 和NOD2/CARD15 等表达失调,说明自噬在CD 病理过程中可能发挥着关键作用[25]。MaciasCeja 等[26]发现,用自噬激活剂RAPA 治疗TNBS 诱导的小鼠模型可以降低促炎因子(TNF-α、COX-2、IL-1β、诱导型NOS和IL-6)水平,并增加抗炎因子IL-10 的表达。另一方面,自噬与ECM 也存在着复杂的关系[27]。研究发现[28],在肠道纤维化模型小鼠中,自噬减弱,在刺激自噬后,肠道纤维化减轻,成纤维细胞的胶原蛋白降解增多,而抑制自噬则加剧纤维化,改变炎症反应,减弱胶原蛋白降解。表明自噬刺激可能是治疗肠道纤维化的一个重要机制。在本研究中,TFA可以上调IFs细胞中自噬标志蛋白LC3Ⅱ、Atg16L1、Beclin-1的表达,降低自噬底物蛋白p62的水平,增加自噬流,表明TFA 具有激活IFs细胞自噬的作用。
AMPK/mTOR 通路与自噬机制密切相关,并且能够参 与 调控 纤维化 疾病[9]。p70S6K 和4EBP1 作 为mTORC1 的下游因子,其磷酸化可以促进蛋白质合成。研究表明激活AMPK 通路、抑制mTOR/p70S6K通路可抑制心肌成纤维细胞的增殖,并减少细胞内的α-平滑肌肌动蛋白和Ⅰ型胶原蛋白[29]。ZHANG等[30]报道通过激活AMPK/mTOR 通路刺激人真皮成纤维细胞的自噬,能够抑制该细胞的增殖和迁移以改善术后关节纤维化。此外,文献报道通过调节AMPK/mTOR 通路激活自噬可以改善肠道炎症和损伤。GAO 等[31]发现尼古丁具有激活AMPK/mTOR 通路,增加自噬水平从而降低溃疡性结肠炎模型小鼠结肠损伤和炎性因子水平的作用。SU 等[32]也发现黄连素能够调控AMPK/mTOR 通路降低溃疡性结肠炎模型小鼠肠黏膜损伤,增加肠道菌群的丰度和有益菌的含量。因此,AMPK/mTOR 通路或许是改善CD 肠道纤维化的关键靶点。为探讨TFA 调控IFs 细胞与AMPK/mTOR 通路是否存在联系,本研究中使用AMPK 抑制剂CC 及mTOR 抑制剂RAPA 联合TFA 处理IFs 细胞模型。发现TFA 联合CC 处理IFs 细胞,会降低细胞中的自噬水平,促进Collagen Ⅰ的表达,而TFA 联合RAPA处理IFs细胞,情况则与之相反。说明AMPK/mTOR 通路对TFA 干预IFs 细胞模型具有调控作用,激活AMPK/mTOR 通路能促进IFs 细胞的自噬,抑制Ⅰ型胶原蛋白的合成。另外,实验结果显示,TFA 促进IFs 细胞中p-AMPK 蛋白表达,抑制p-mTOR、p-p70S6K、p-4EBP1蛋白水平,表明TFA能激活IFs 细胞的AMPK/mTOR 通路。TFA 可能通过激活AMPK/mTOR通路调节自噬来抑制IGF-1诱导肠道成纤维细胞中I型胶原蛋白的合成。
综上所述,本研究以肠道成纤维细胞为研究对象,从细胞层面探索TFA 对CD 肠道纤维化的作用及机制。实验发现,TFA 通过调控AMPK/mTOR 通路,促进肠道成纤维细胞自噬,抑制肠道成纤维细胞合成Ⅰ型胶原蛋白,进一步证实了TFA 具有改善CD 肠道纤维化的作用,为TFA 治疗CD 肠道纤维化的应用提供了理论支持。但是,当前的研究只局限于体外实验,未来仍有必要开展动物实验,进一步验证其中的机制。

