拜颤停复方对MPP+诱导SH-SY5Y细胞自噬及凋亡机制研究
高鑫,王一晴,卢芳,陈平平,刘树民
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
帕金森病(Parkinson's disease,PD)是一种常见的神经退行性疾病,以静止性震颤、运动迟缓和肌强直三联征为特点。西医采用左旋多巴和外科手术的方法治疗,但会产生毒副作用和神经损伤后遗症。中医学认为,肝肾阴血亏虚日久则筋失濡养,造成机体痉挛颤动,采用方药随证加减治疗PD,取得很好的临床疗效。本研究选择的拜颤停复方是由临床治疗PD 的经验方复元平颤宁[1]精制而得,由刺五加、白芍及钩藤三味中药组合而成。方中刺五加益气补肾为君药;白芍可养血柔肝为臣药,助君药滋养肝肾;钩藤清热平肝为佐药。三药合用,达到滋补肝肾、补气养血之疗效,可谓“标本兼治”,前期研究表明其对PD疗效显著[2-3]。
现代研究表明,PD 的发生与细胞自噬和凋亡平衡失调有关[4-5]。自噬和凋亡的正常进行可以使相关通路在脑组织中处于激活状态,从而促进神经细胞正常发育过程[6]。那么拜颤停复方的神经保护及治疗作用机理与调节自噬与凋亡过程是否有关?基于此问题,本研究选择采用MTT 法检测细胞活性,明确拜颤停复方的神经保护作用;采用流式细胞技术和荧光染色技术观测细胞自噬、凋亡和死亡程度,明确用药前后细胞自噬、凋亡和死亡方式变化;采用蛋白质印迹法检测PD 模型细胞中自噬与凋亡蛋白含量变化,明确自噬凋亡信号蛋白表达在PD中的情况,揭示拜颤停复方的神经保护作用机制。
1 材料与方法
1.1 实验细胞
SH-SY5Y 细胞株,购于中国科学院上海细胞库。RPMI 1640培养液(含100 U/mL青霉素、100 μg/mL链霉素和10%胎牛血清),置于培养瓶中,于37 ℃、5% CO2的培养箱中培养,取对数生长期的细胞进行实验。
1.2 实验药物
1.2.1 药材
刺五加药材(批号:170634)购自黑龙江省五常市世一堂中药材有限公司,为五加科植物刺五加[Acanthopanax senticosus(Rupr.et Maxim.)Harms]的干燥根和根茎或茎;白芍药材(批号:17052594)购自安徽亳州市药材总公司,为毛茛科植物芍药(Paeonia lactifloraPall.)的干燥根;钩藤药材(批号:17053549)购自贵州剑河县国鸿中药材有限责任公司,为茜草科植物钩藤[Uncaria rhynchophylla(Mia.)Miq.Ex Havil.]的干燥带钩茎枝。均经黑龙江中医药大学中药资源学教研室王振月教授鉴定,符合2015 版《中华人民共和国药典》规定。
1.2.2 制备方法
本研究使用的拜颤停复方中各味中药的最佳配伍比例参考课题组前期实验所得[2-3],最佳配伍比例为:刺五加提取物∶白芍提取物∶钩藤提取物= 54.0∶45.0∶82.5。拜颤停复方按照《中华人民共和国药典》规定的每日最高用量进行换算。实验室自行制备拜颤停复方药液,样品保存在黑龙江中医药大学中医药研究院中药药性理论研究室(20190702)。
小鼠给药量= 生药量(g/60 kg)×9.1×出膏率
1.3 试剂
RPMI 1640 培养基(上海阿拉丁生化科技股份有限公司,批号:H20010304);胰蛋白酶(美国Hyclone 公司,批号:H107-50);胎牛血清(美国Hyclone 公司,批号:H7589);MPP+(北京谨明生物科技有限公司,批号:2018041023);吖啶橙染色剂(西安百萤生物科技有限公司,批号:160110005);SDS-PAGE 凝胶配制试剂盒(美国Biosharp 公司,批号:BL508A);Tween 20(德国BIOFROXX 公司,批号:1247ML100);Western blot一抗二抗去除液(上海碧云天生物科技有限公司,批号:P00258);Albumin Bovine V(美国Amresco 公司,批号:0332);飞克特超敏ECL 发光液(Meilunbio,批号:MA0186-L);Beclin(北京博奧森生物技术有限公司,批号:bs-1353R);LC3B(武汉三鹰生物技术有限公司,批号:18725-1-AP);p53(英国abcam公司,批号:Ab26);AMPK(英国abcam 公司,批号:Ab80039);mTOR(英国abcam 公司,批号:Ab2732);Bax(北京博奧森生物技术有限公司,批号:bs-0127R);Bcl-2(北京博奧森生物技术有限公司,批号:bs-0032R);Casepase-3(北京博奧森生物技术有限公司,批号:bs-0081R);GAPDH(北京博奧森生物技术有限公司,批号:bs-10900R)。
1.4 仪器
HF90 CO2培养箱(香港力康生物医疗科技控股集团);荧光显微镜(日本奥林巴斯有限公司);KDC-160HR 高速冷冻离心机(安徽科大创新股份有限公司);UV-2450 紫外分光光度计(日本岛津);DP72 显微摄像系统(日本奥林巴斯有限公司);Motic Med 6.0数码医学图像分析仪(北京麦克奥迪图像技术有限公司);全自动样品快速研磨仪(上海净信科技);全波长读数仪(Thermo);Trans-blot 转膜仪(Thermo);Pharos FX 激光成像系统(Bio-Rad);Guava easycyte 流式细胞仪。
1.5 方法
1.5.1 实验分组及给药
将SH-SY5Y细胞分为正常对照组、模型对照组、拜颤停复方组和3-MA组。拜颤停复方组的给药剂量为193.6 μg/mL(课题组前期实验筛选所得的最佳剂量[7-9]),且拜颤停复方对细胞的毒性作用甚微,可以忽略不计[10]。正常对照组用完全培养基培养细胞,其余各组均加入0.437 mmol/L 的MPP+干预。2 h 后,拜颤停复方组加入193.6 μg/mL浓度拜颤停药液,3-MA组加入193.6 μg/mL拜颤停药液和5 mmol/L 3-MA试剂。
1.5.2 PD细胞模型活性实验
选择MTT 法检测细胞活性。96 孔细胞培养板中,每孔接种2×104个细胞,于5%CO2细胞培养箱中以37 ℃培养24 h,至细胞单层铺满孔底。每孔加入20 μL MTT(5 mg/mL)溶液,静置于细胞培养箱2 h 后吸去上清液,加入Formazan 溶解液150 μL,水平摇床振荡10 min,使结晶物充分溶解。在酶标仪上测定各孔光吸收值,选择波长为490 nm,记录结果并根据公式计算细胞活性。
细胞活性(%)=(给药组OD值-空白组OD值)/(模型组OD值-空白组OD值)×100%
1.5.3 PD细胞模型凋亡实验
依据Annexin V-FITC 细胞凋亡检测试剂盒说明,使用流式细胞仪对细胞凋亡情况进行检测。
1.5.4 PD细胞模型自噬实验
选择吖啶橙染色法。取各组对数生长期细胞,加入吖啶橙(1 mg/mL)避光染色15 min,荧光显微镜观察并拍照。每张片取5 个视野,计数5 个视野中每100 个细胞中染色阳性(有自噬囊泡)的细胞数,进而计算吖啶橙染色自噬囊泡细胞数目的百分数。
1.5.5 PD细胞模型自噬与凋亡蛋白实验
选择Western blot 检测方法。上样后连接电泳仪,起始电压为80 V,当溴酚蓝跑到分离胶后,提高电压到120 V,至溴酚蓝达分离胶底部,电泳结束。海绵和PVDF 膜用转移缓冲液浸泡,去掉浓缩胶后与其一起放入湿转电泳槽中,连接电泳仪,选择电压110 V,电泳100 min。电泳完毕后将膜浸于5%封闭液中,置于摇床,室温封闭2 h。封闭结束结合一抗,然后结合二抗,最后将膜浸于ECL发光液中,避光显色2 min,置于全自动化学发光图像分析系统扫描。
2 结果
2.1 对PD细胞模型活性的影响
与正常对照组比较,模型对照组细胞活性极显著降低(P<0.01);与模型对照组比较,拜颤停复方组细胞活性显著升高(P<0.05),3-MA 组细胞活性无显著变化(P >0.05)。见表1。
表1 各组PD细胞模型活性比较(±s)

表1 各组PD细胞模型活性比较(±s)
注:与正常对照组比较,##P <0.01;与模型对照组比较,*P <0.05。
?
2.2 对PD细胞模型凋亡的影响
从流式细胞FITC/PI散点图可以看出,正常对照组散点主要集中在3 区,而且由于操作等原因导致的机械致死细胞很少。模型对照组散点主要集中在2 区和4 区,凋亡早期、凋亡晚期和坏死细胞数量较多;3区散点较少,活细胞较少。与模型对照组比较,拜颤停复方组散点主要分布于3区和4区,活细胞数量较模型对照组提高且明显,凋亡早期细胞数量较模型对照组减少;2 区几乎没有散点分布,晚期凋亡或坏死细胞很少。与模型对照组比较,3-MA 组散点主要分布于2 区和4 区,样本细胞凋亡程度高;3 区散点零星分布,活细胞数量少。见图1。
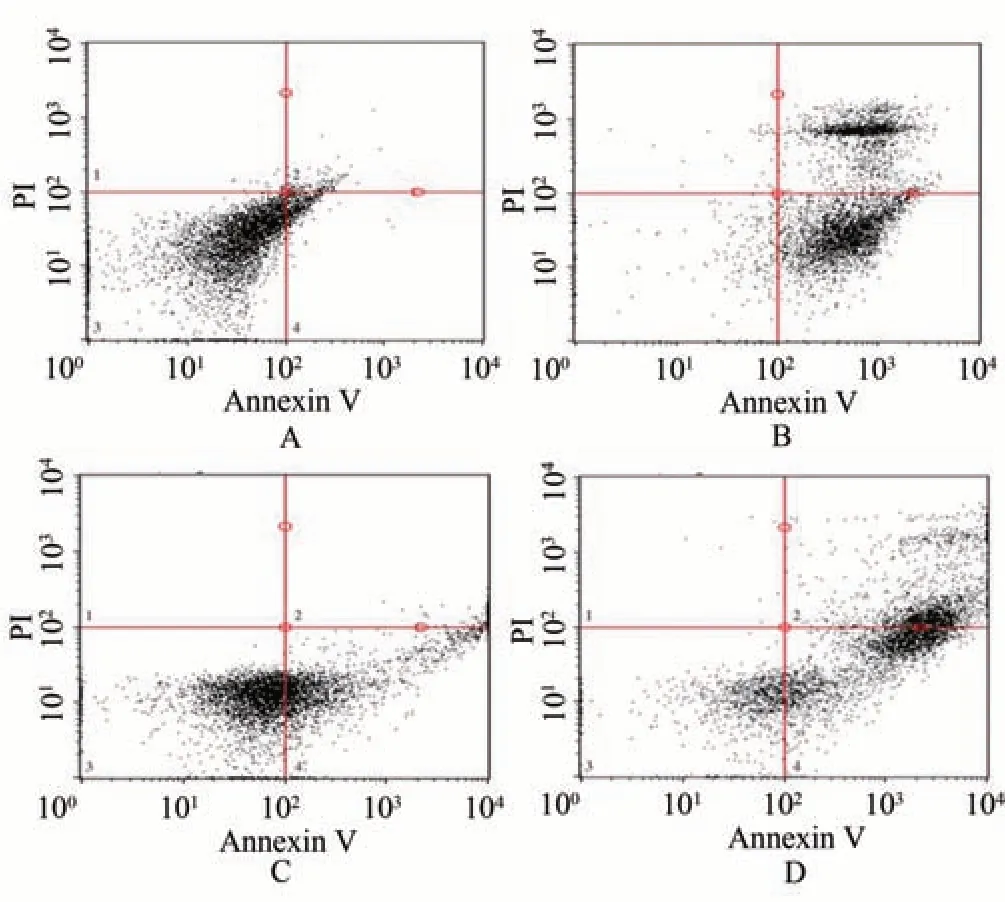
图1 各组PD细胞模型凋亡情况
2.3 对PD细胞模型自噬的影响
吖啶橙染色结果显示,与正常对照组比较,模型对照组黄绿色荧光数量较多,自噬囊泡数显著降低(P<0.05),自噬程度高;拜颤停复方组黄绿色荧光数量回调,自噬囊泡数显著升高(P<0.05),即拜颤停复方组含有自噬囊泡细胞数量回调;3-MA 组黄绿色荧光数量较少,自噬囊泡数差异无统计学意义(P>0.05),即3-MA 组含有自噬囊泡数量与模型对照组比较差异无统计学意义。见表2和图2。

图2 各组PD细胞模型自噬情况
表2 各组PD细胞模型自噬囊泡数目比较(±s)

表2 各组PD细胞模型自噬囊泡数目比较(±s)
注:与正常对照组比较,#P <0.05;与模型对照组比较,*P <0.05。
组别正常对照组模型对照组拜颤停复方组3-MA组自噬囊泡数目(%)30.54±2.20 6.48±1.94#22.96±1.18*5.21±1.23
2.4 对PD细胞模型自噬、凋亡蛋白的影响
利用蛋白质免疫印迹法观察拜颤停复方对细胞自噬及凋亡的影响。与正常对照组比较,模型对照组Bax蛋白含量显著升高(P<0.05);与模型对照组比较,拜颤停复方组Bax蛋白含量显著降低(P<0.05),3-MA 组Bax蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组Bcl-2 蛋白含量显著降低(P<0.05);与模型对照组比较,拜颤停复方组Bcl-2显著升高(P<0.05),3-MA组Bcl-2蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组Caspase蛋白含量显著升高(P<0.05);与模型对照组比较,拜颤停复方组Caspase 蛋白含量显著降低(P<0.05),3-MA 组Caspase 蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组LC3B 蛋白显著降低(P<0.05);与模型对照组比较,拜颤停复方组LC3B蛋白显著升高(P<0.05),3-MA组LC3B蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组AMPK蛋白显著升高(P<0.05);与模型对照组比较,拜颤停复方组AMPK 蛋白显著降低(P<0.05),3-MA 组AMPK 蛋白差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组mTOR 蛋白含量显著升高(P<0.05);与模型对照组比较,拜颤停复方组mTOR 蛋白含量显著降低(P<0.05),3-MA 组mTOR蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组Beclin蛋白含量显著降低(P<0.05);与模型对照组比较,拜颤停复方组Beclin蛋白含量显著升高(P<0.05),3-MA 组Beclin蛋白含量差异无统计学意义(P>0.05)。与正常对照组比较,模型对照组p53蛋白含量显著升高(P<0.05);与模型对照组比较,拜颤停复方组p53蛋白含量显著降低(P<0.05),3-MA 组p53蛋白含量差异无统计学意义(P>0.05)。见表3、图3。
表3 各组PD细胞模型自噬、凋亡蛋白表达量比较(±s,%)
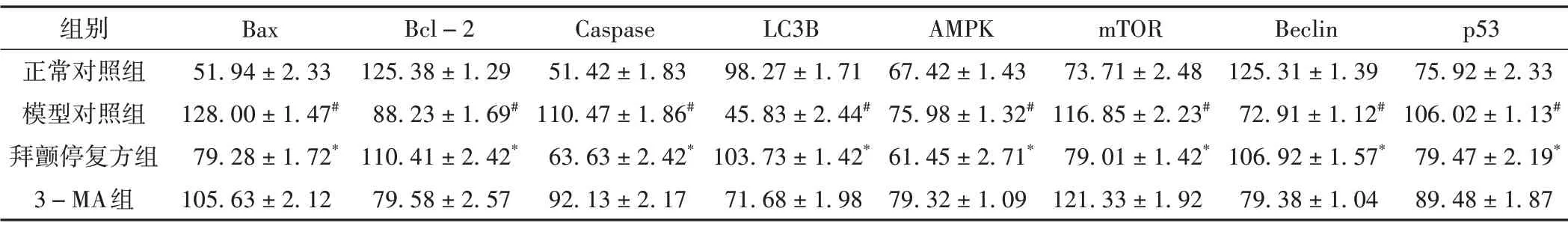
表3 各组PD细胞模型自噬、凋亡蛋白表达量比较(±s,%)
注:与正常对照组比较,#P <0.05;与模型对照组比较,*P <0.05。
组别正常对照组模型对照组拜颤停复方组3-MA组Bax 51.94±2.33 128.00±1.47#79.28±1.72*105.63±2.12 Bcl-2 125.38±1.29 88.23±1.69#110.41±2.42*79.58±2.57 Caspase 51.42±1.83 110.47±1.86#63.63±2.42*92.13±2.17 LC3B 98.27±1.71 45.83±2.44#103.73±1.42*71.68±1.98 AMPK 67.42±1.43 75.98±1.32#61.45±2.71*79.32±1.09 mTOR 73.71±2.48 116.85±2.23#79.01±1.42*121.33±1.92 Beclin 125.31±1.39 72.91±1.12#106.92±1.57*79.38±1.04 p53 75.92±2.33 106.02±1.13#79.47±2.19*89.48±1.87
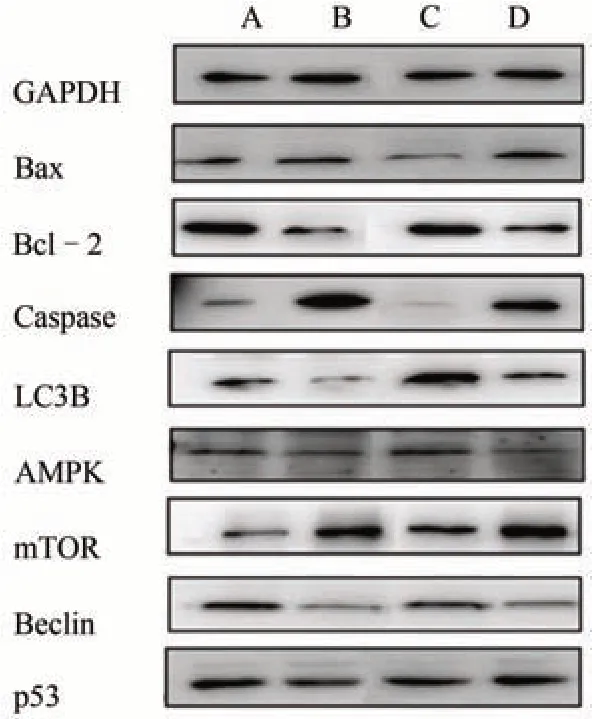
图3 各组PD细胞模型自噬、凋亡蛋白情况
3 讨论
细胞自噬和凋亡的关系是错综复杂的,在病毒、感染和饥饿等应激条件下,细胞自噬被诱导发生,当持续应激导致细胞病变无法修复时,细胞凋亡则被激活,自噬和凋亡过程中涉及的关键调节蛋白的双重调节作用成为近年来研究两者关系的重点[11-12]。那么拜颤停复方治疗PD 的机制是否是通过调控细胞自噬与凋亡实现的?基于此,本课题组展开了相关研究。
PD 细胞模型活性影响的实验中,拜颤停复方可以减弱MPP+对SH-SY5Y 细胞的毒性作用,从而保护神经元;3-MA 组细胞活性低于拜颤停复方组,与模型对照组类似,推测拜颤停复方保护神经元的作用是通过促进细胞自噬实现的,当自噬被主动抑制时,拜颤停复方的作用效果减弱。
PD 细胞模型凋亡的影响实验与吖啶橙染色实验中,模型对照组荧光几乎淬灭,总体凋亡趋势明显,自噬程度低,符合MPP+对细胞的毒性损伤[13-14]。拜颤停复方组自噬程度提高,凋亡被抑制,反映了其神经保护作用。3-MA 组荧光淬灭程度与模型组相似,说明抑制细胞自噬会降低拜颤停复方的作用效果,推测复方主要通过促进自噬发挥作用。
为深入探索拜颤停复方调控的自噬和凋亡相关蛋白以及具体的调控方式进行了自噬、凋亡蛋白影响实验。Bax 和Bcl-2 是自噬与凋亡主要的活性调控因子,Bax 被激活会从胞浆中转移到线粒体膜上,导致细胞色素的释放,从而引起细胞凋亡。Bax 相对量多于Bcl-2 时,细胞凋亡被促进,反之则被抑制[15]。Caspase 蛋白与细胞凋亡密切相关,Caspase-3 直接作用于内质网凋亡途径和内源凋亡途径,激活后凋亡将不可逆转[16];Caspase-9 会在外源凋亡途径中诱导凋亡的发生,刺激线粒体释放细胞色素C 从而使细胞凋亡[17];故Caspase-3 和Caspase-9 会以内外联动的方式加速细胞凋亡。LC3B 是自噬小体膜蛋白的一种亚型,它是可检测自噬发生的标志性蛋白[18-19],Beclin 是与自噬调控相关的关键因子,ULK1的激酶通过磷酸化Beclin,诱导了细胞自噬发生[20],这两种因子在机体内的表达量与自噬呈正相关。AMPK/mTOR/p53 是机体一条调控自噬-凋亡的重要途径,激活此通路可延长细胞存活周期,使凋亡得到抑制[21-22]。其中,AMPK 能够通过切断细胞能量供应使其凋亡。p53 激活后会通过诱导AMPK 亚基的表达调节诱导凋亡。同时随着p53 的增高,AMPK 的磷酸化水平被促进,mTOR 的磷酸化水平受到抑制[23-24],促自噬抑凋亡。因此,病理模型中能够促进自噬的蛋白如Bcl-2、LC3B、AMPK、Beclin、p53明显下调,促进凋亡的蛋白如Bax、Caspase、mTOR 明显上调;经拜颤停复方干预后自噬和凋亡蛋白变化趋势相反。自噬被抑制后,复方抑制凋亡作用减弱。
综上所述,拜颤停复方通过促进神经元自噬,干预了自噬与凋亡平衡,从而反馈性抑制凋亡,实现神经保护作用,从而治疗PD。本研究从自噬和凋亡的角度揭示拜颤停复方防治PD 的新机制,为PD 的治疗提供新的靶点和疗法。

