基于网络药理学探讨青蒿改善心肾毒性的潜在作用机制
廖奕娇,邹凌,何日明,易铁钢✉
(1.广州中医药大学第四临床医学院,广东 深圳 518033;2.广州中医药大学惠州医院,广东 惠州 516001)
恶性肿瘤至今仍是发达国家的第一大致死原因,是发展中国家第二大致死原因[1]。癌症的发病率及病死率在我国呈上升趋势,给我国的医疗经济带来巨大压力,极大降低了癌患的生活质量。目前,常见的化疗药物有铂剂类、抗肿瘤抗生素类、生物碱类、代谢类药物和烷基化药物等,但抗癌药物毒副作用严重限制了其临床疗效。细胞毒性化疗药物虽为常见的癌症治疗手段,然而其临床用药的剂量受药物的耐药性和毒副作用限制。抗癌药物常见的毒副作用有肾毒性、心脏毒性、胃肠毒性、周围神经病变和骨髓抑制等[2]。毒副作用的严重程度又与抗癌药物的类型、给药剂量和途径密切相关。抗癌治疗出现心肾毒性可导致癌症患者病死率增加,特别是既往有心脏病和/或肾脏病史的病患[3]。化疗药物的毒副作用常迫使给药剂量降低,在出现严重不良反应的情况下,还往往被迫中断治疗,导致病情的恶化。
由于抗癌药物的毒副作用发病机制复杂,临床上尚无有效治疗药物可减少毒副作用的发生。近年来中药、中药提取物等作为治疗放化疗不良并发症的新兴方法已取得一定疗效,受到了广泛关注。中医药可以通过不同的作用机制减少抗肿瘤药物的毒副作用,如抗氧化、抑制凋亡、减少炎症因子,以及改善临床症状、提高免疫力等,从而防止药物毒性对正常细胞的损害[1,4]。研究发现青蒿及其衍生物具有一定的抗肿瘤作用,然而对其抗肿瘤疗效的研究大多侧重于耐药性方面[5],青蒿对抗癌药物的心肾毒副作用是否具有减轻作用却鲜有报道。网络药理学是一门综合性学科,可通过构建药物与疾病的靶标分子网络,预测药物对疾病的潜在通路及作用机制,对阐明中医药的疗效机制具有极大的作用。因此,本研究基于网络药理学方法,对青蒿改善心肾毒性的有效成分及靶点进行分析,以探讨其减轻心肾毒性的潜在机制,为中医药治疗心肾毒性相关疾病提供参考。
1 资料与方法
1.1 青蒿的活性成分及靶点筛选
通过中医药系统药理学平台(TCMSP)[6]对青蒿的组成成分进行检索,并筛选其活性成分及蛋白靶点,标准为口服生物利用度(OB)≥30%、类药性(DL)≥0.18,并查阅文献对青蒿的成分靶点进行补充。将筛选出的蛋白靶点通过Uniprot 蛋白质数据库(https://www.uniprot.org)对其名称进行规范化处理和整合。
1.2 构建青蒿“活性成分-靶点”网络图
利用Cytoscape 3.8.2 软件构建青蒿的“活性成分-靶点”网络图,通过“节点”(node)和“边”(edge)将活性成分与靶点关系可视化。通过对青蒿的成分靶点进行网络拓扑学参数运算,得到连接度(Degree)、介度(Betweenness)及紧密度(Closenesss)等数值,以分析药物的核心靶点和关键的活性成分。
1.3 心肾毒性相关疾病靶点获取
通过GeneCards 数据库(https://www.genecards.org)搜索以“cardiotoxicity and nephrotoxicity”为关键词的心肾毒性相关疾病的靶点蛋白,再将获得的疾病靶点蛋白利用Uniprot 数据库核对蛋白名称,确认其对应的Uniprot ID。
1.4 青蒿成分-心肾毒性PPI图构建及分析
由Draw Venn Diagram 在线平台(http://bioinformatics.psb.ugent.be)获得中药青蒿与心肾毒性相关疾病的交集靶点基因信息,并进行Venn图绘制。将交集靶点输入STRING 数据库(https://string-db.org),设置物种为“homo sapiens”,作用阈值为“medium confidence >0.4”,绘制(Protein-protein interactions,PPI)网络图。将获取数据进一步输入Cytoscape 3.8.2软件进行参数分析,研究其蛋白相互作用关系。
1.5 通路富集分析
利用DAVID数据库(https://david.ncifcrf.gov/summary.jsp)进行生物通路富集分析,设置生物物种为“homo sapiens”,获得基因本体(GO),即包括生物途径(BP)、分子功能(MF)和细胞成分(CC);获取京都基因与基因组百科全书(KEGG)相关数据。筛选前20条富集条目(P<0.05),并绘制GO及KEGG富集图。
1.6 青蒿成分-心肾毒性靶点-通路网络图的构建
运用Cytoscape 3.8.2软件对青蒿的活性成分与心肾毒性的交集靶点,以及KEGG 相关通路基因进行网络图绘制,通过拓扑学参数分析及网络图的可视化,进一步探究药物与疾病的关系。
2 结果
2.1 青蒿的活性成分及相关靶点
通过TCMSP 对中药青蒿进行检索,共获取126 种活性成分。经ADME 筛选后最后获得19 种主要活性成分,见表1。将靶点预测结果整合重复项后,共得到青蒿的靶点为203个。

表1 青蒿的19种主要活性成分
2.2 构建青蒿“活性成分-靶点”网络
利用Cytoscape 3.8.2 软件对青蒿的19 种主要活性成分及对应靶点进行绘制与分析,共获得222 个节点(203 个靶点和19 个活性成分)和486 条边。度值(Degree)是衡量节点与边连接数量多少的数值,Degree值越大表示该节点在网络中越重要。由网络拓扑学参数运算结果得出Degree 值最大的前3 种成分为QH19(槲皮素,Quercetin)、QH6(山柰酚,kaempferol)和QH10(木犀草素,Luteolin),Degree 值分别是146、61、57;排名前3 的靶点分别为PTGS2、NCOA2、DPP4,Degree值分别是16、14、14。见图1。

图1 青蒿活性成分-靶点网络图
2.3 获取心肾毒性相关靶点和构建PPI网络图
利用GeneCards数据库对心肾毒性靶点进行检索,最终删除重复值获得疾病靶点104 个。将药物203 个靶点与疾病104 个靶点进行Venn 图绘制,见图2。由Venn 图可知药物-疾病的共同靶点有36 个。将药物与疾病的交集靶点导入STRING 在线平台进行分析与绘图,构建青蒿作用于心肾毒性的相关靶点的PPI 蛋白网络图,见图3。
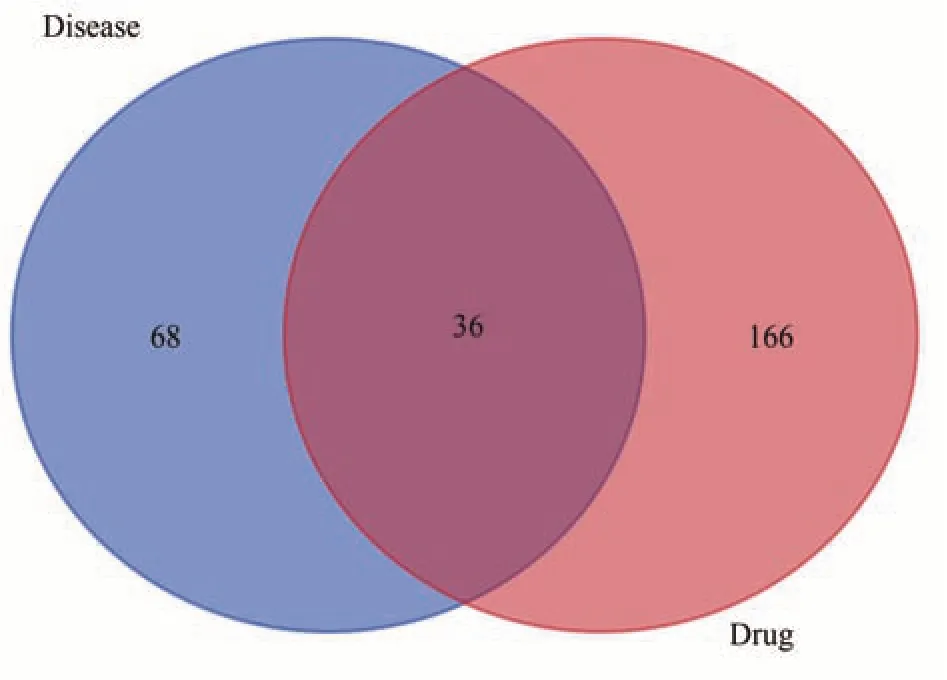
图2 青蒿活性成分-心肾毒性相关疾病靶点Venn图
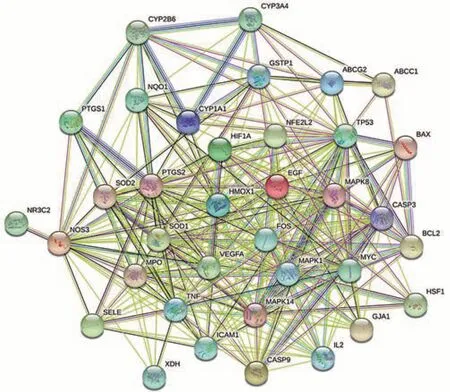
图3 青蒿活性成分-心肾毒性相关疾病靶点PPI网络图
2.4 青蒿改善心肾毒性相关疾病的GO和KEGG通路分析
利用DAVID 数据库对收集的36 个交集靶点进行检索,获得GO(BP、CC、MF)和KEGG 通路的富集结果再筛选删除,最后得到条目BP、MF、KEGG 各20 个和CC 17 个。通过R 语言将BP、CC、MF 通路绘制成条形图,见图4~图6。其中横轴代表节点的数量(Count),纵轴为通路名称,条形颜色根据P值呈现渐变,颜色越红则代表越显著。以气泡图对KEGG 通路图进行可视化,横轴为通路基因占总基因的比率,纵轴为通路名称。气泡的大小根据基因Count值调节,颜色则由P值大小呈现由蓝到红渐变,颜色越红代表越显著,见图7。KEGG通路结果见表2。

表2 青蒿改善心肾毒性相关疾病靶点通路富集结果
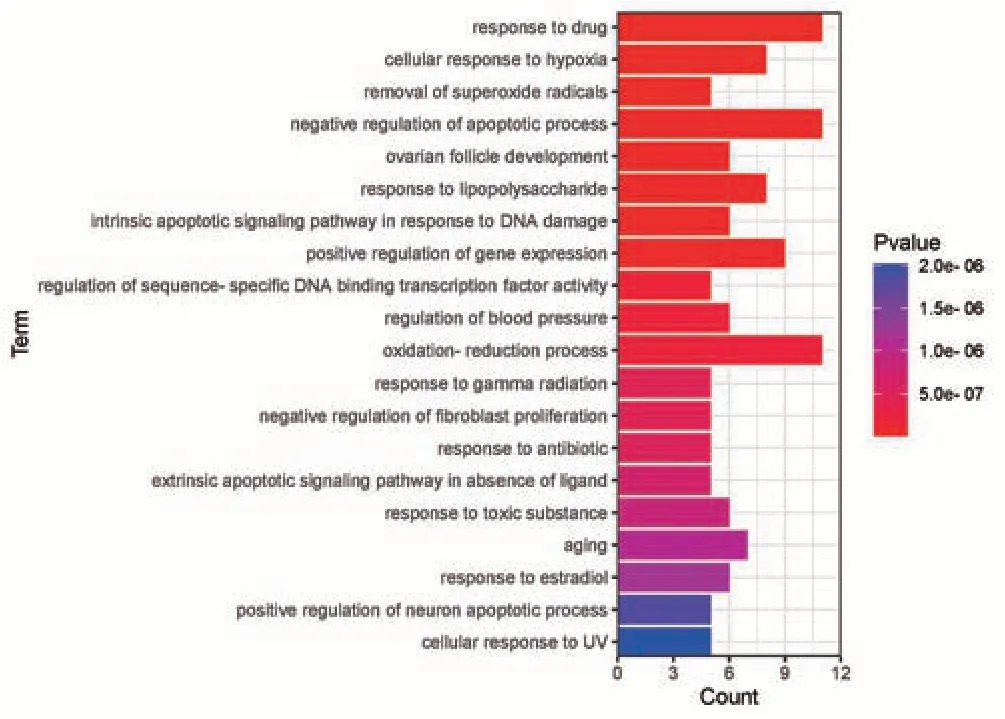
图4 基于分子功能的GO-BP富集分析图

图5 基于分子功能的GO-CC富集分析图

图6 基于分子功能的GO-MF富集分析图

图7 KEGG通路富集气泡图
2.5 构建青蒿活性成分-心肾毒性靶点-通路网络图
利用Cytoscape 3.8.2软件进行药物成分-疾病靶点-通路构建,见图8。由分析的网络拓扑学参数得知:槲皮素(Degree 值:31,Betweenness 值:0.351 2,Closenesss 值:0.588 7)可能是青蒿改善心肾毒性的关键成分。山柰酚、木犀草素、青蒿素的Degree值则分别为15、13、7,可能对青蒿治疗心肾毒性相关疾病起到重要作用;由数据预测MAPK1(Degree 值:20,Betweenness 值:0.077 6,Closenesss 值:0.480 2)可能是作用的主要靶点,其次是PTGS2、MAPK14、TP53、CASP3、TNF,Degree值分别是19、16、15、14、14。

图8 青蒿活性成分-心肾毒性靶点-通路网络图
3 讨论
药物的毒性反应可能引起器官结构的病理改变,甚至会导致患者死亡,是药物开发和临床应用面临的巨大难题[7]。常见的药物毒性损伤如铂剂类抗癌药的肾毒性损伤,研究表明接受顺铂治疗的患者约有20%出现肾毒性改变[8]。此外,蒽环类药物也会引起心脏毒性损伤,特别是心功能不全的老年患者,严重者可发生心力衰竭和心肌梗死[9]。目前尚无针对药物所致心肾毒性损害的有效临床药物。中药具有毒副作用小、治疗效果好、作用靶点多的特点,且临床研究表明中药与抗癌药物联用可以达到增效减毒的作用[10]。ZHAI等[11]通过蒽环类药物阿霉素作用于H9c2 细胞和小鼠的实验,证实了黄芪提取物可以通过减少凋亡、抑制氧化应激、调节Sirt1-NLRP3 通路,对阿霉素诱导的心毒性起保护作用。
青蒿为清虚热类中草药,性味苦、辛、寒,《本草纲目》记载:“青蒿,治疟疾寒热”,随着对青蒿及其提取物的深入研究,发现其在治疗癌症方面具有一定的作用,这意味着青蒿及其提取物在未来抗癌药市场可能占据重要地位[12]。目前针对青蒿抗癌作用的研究主要集中在青蒿素及其衍生物的作用机制探讨,然而青蒿的有效成分很多,且其有效成分到底是通过减少药物毒性还是抑制癌细胞等方面发挥作用,均需要深入研究。中医认为,心火与肾水互相交济,以使君相安位、精血互生。《金匮要略》曰:“水不行,则心火气盛”,若心肾不交则导致心火上炎,故以阴虚之证候多见,久则亦可致心肾阳虚。人体作为一个整体,心毒性与肾毒性亦是互相作用。因此,本研究通过网络药理学方法,对青蒿主要活性成分改善心肾毒性相关疾病的机制进行探究。
3.1 青蒿改善心肾毒性相关疾病的主要活性成分分析
由分析结果可知,槲皮素是青蒿改善心肾毒性的主要活性成分,此外还有山柰酚、木犀草素和青蒿素。目前研究认为心肾毒性的发生可能与活性氧的产生、炎症反应以及凋亡密切相关[13]。槲皮素是一种黄酮类化合物,普遍存在于中药、水果和蔬菜中,具有广泛的生物学作用,包括抗癌、抗氧化、抗炎和抗菌等。槲皮素可以通过促凋亡,调节细胞周期蛋白、PI3K/Akt、MAPK 等分子通路,减少细胞增殖,诱导细胞凋亡,导致细胞周期阻滞[14]。槲皮素具有双向调节和剂量依赖的特点,即在低浓度时槲皮素作为一种抗氧化剂,可起到化学预防作用;在高浓度时槲皮素作为一种促氧化剂,可对化疗的毒副作用起影响作用[15]。但槲皮素是一种亲脂性化合物,只有改善其溶解性、生物累积性和传递进入细胞系统的方式,才能更好地靶向治疗癌症[16]。山柰酚的摄入与各种癌症的发病率下降有关,其中包括皮肤、肝脏、结肠、卵巢等器官癌症[17]。其主要通过增加细胞凋亡来抑制癌细胞的增殖发挥对癌症的预防作用,由于它的亲脂性可通过被动或主动运输在小肠中吸收。被吸收的山柰酚通过结肠中的细菌菌群代谢后,再通过粪便和尿液排出体外[18]。而富含木犀草素的中药则有治疗高血压、炎症相关疾病和癌症的功效,木犀草素的抗癌功能可能与它的抗炎作用、诱导细胞凋亡及氧化还原调节相关。木犀草素等黄酮类化合物是重要的天然抗氧化剂,在体内外均有较强的抗癌作用[19]。此外,研究发现木犀草素单独或联合抗癌药物使用,可促进Bax/Bcl-2 的表达和p53 的表达,可以增强PARP 的裂解和减少二氢嘧啶脱氢酶生成,还可调节ICAM-1、LFA-3 和PCNA 等蛋白的表达,从而达到治疗肝癌的效果[20-21]。青蒿素作为一种过氧桥的倍半萜内酯类化合物,它除了抗疟之外,还具有抗肿瘤、抗病毒、抗炎的作用,而且这些功能与其过氧桥基团密切相关[22]。屠呦呦团队还发现青蒿素衍生物双氢青蒿素可通过抑制抗ds-DNA抗体的产生、TNF-α的分泌和NF-κB 信号通路,达到改善红斑狼疮相关肾炎的效果[23]。青蒿的主要活性成分均有一定的抗癌的作用,然而其药理机制复杂,且当前关于青蒿的研究较为分散尚未形成体系,仍需进一步的针对性的研究才能使青蒿发挥其最大功效。
3.2 青蒿改善心肾毒性的关键靶标和潜在通路分析
通过36 个交集靶点的分析结果显示,青蒿改善心肾毒性的关键靶标可能是MAPK1,此外依次还有PTGS2、MAPK14、TP53、CASP3、TNF、MAPK8、CASP9、BCL2 和BAX。由交集靶点的数据分析,得到KEGG 富集通路82 条和GO 富集284 个,其中包括BP 228 个、CC 20 个、MF 36 个。通过P值、Count 值和结合关键靶点综合分析,发现青蒿改善心肾毒性的主要潜在通路集中于癌症相关通路、TNF 信号通路、HIP-1 信号通路、VEGF 信号通路、MAPK信号通路和凋亡相关通路等。
研究发现线粒体损伤、免疫反应、炎症和细胞死亡是大多数药物毒性的发生和发病机制,然而其分子机制目前仍不清楚[24]。MAPKs 是一类可感知细胞外刺激并触发细胞内反应的丝氨酸/苏氨酸蛋白激酶。活化的MAPKs 可磷酸化多种靶蛋白(如Bcl-2、BAX),进而调节细胞的凋亡、增殖、氧化应激和炎症等[25]。PTGS2 又称环氧化酶2(COX-2),对癌变的发生或促进过程,以及肿瘤细胞的放化疗耐药性均发挥作用。MAPK 家族如p38、ERK1/2 可参与COX-2 的诱导,进而促进癌细胞增殖、侵袭转移和凋亡抵抗等。COX-2的抑制能提高癌症的治疗效果及增强癌细胞对化疗的敏感性[26]。由TP53 基因编码的p53 在细胞周期阻滞、DNA 修复和凋亡的调控中起着重要的抑癌作用,且p53 过表达、突变与抗癌药物的耐药性之间存在关联,p53突变体可以恢复p53的抑瘤功能,增强其化疗的敏感性,从而减少这些药物的用量以降低其毒性[27]。CASP3、CASP9、BCL2、BAX则为凋亡信号通路分子,其中CASP3是细胞凋亡过程中重要的关键信号分子。
由分析靶点和通路分析结果可知,青蒿对心肾毒性的作用机制多与癌症通路相关,这也与临床上心肾毒性药物多以抗癌药为主的现象相符。TNF信号通路则与细胞增殖和炎症、凋亡相关,其中TNF-α 是典型的促炎细胞因子,临床研究及动物实验表明抗癌药能在体内引起严重的全身炎症,包括肝炎、肾炎、静脉炎、黏膜炎等,而且TNF-α 表达增加与顺铂诱导的肾毒性相关[28]。此外,TNF 信号通路还能激活NF-κB 和MAPK 信号通路。HIP-1 信号通路与肿瘤的发生、发展相关,且可活化Caspase-8 促进凋亡的发生。HIP-1 因子的过表达可减少癌细胞对生长因子的依赖从而获得增殖优势,是前列腺癌和结肠癌的潜在治疗靶点[29]。VEGF 信号通路则与肿瘤血管生成相关,可诱导下游ERK1/2信号通路,调节内皮细胞的分化和增殖[30]。
综上所述,由网络药理分析可知青蒿减轻心肾毒性相关疾病的药物主要活性成分为槲皮素、山柰酚、木犀草素和青蒿素,其关键靶点则是MAPK1、PTGS2、MAPK14、TP53、CASP3 和TNF 等,主要潜在信号通路为癌症相关通路、MAPK 信号通路、凋亡相关通路、TNF信号通路、HIP-1信号通路和VEGF信号通路等。药物的心肾毒性对疾病的疗效和患者的生活质量都有重要的影响,由结果分析发现青蒿对心肾毒性有保护作用,其作用可能通过多种机制实现。然而,关于青蒿及其活性成分对毒性的治疗剂量阈值与给药途径,则仍需要进一步的实验和临床研究进行评估,从而达到改善毒性的作用。本研究通过网络药理学方法对青蒿改善心肾毒性靶点进行筛选,为日后实验研究提供新思路,同时也证明了中药在靶向治疗恶性肿瘤方面具有一定潜力。

