鲍曼不动杆菌Hcp 基因原核表达载体的构建及蛋白纯化
胡音音,杜伟鹏,张亚东,卢庆文,李向阳
(1.南阳市中心医院检验科,河南 南阳473009;2.南阳市中心医院肝脏外科,河南 南阳473009;3.温州医科大学附属第二医院育英儿童医院,浙江 温州325027)
随着鲍曼不动杆菌临床分离率的不断攀升及多重耐药和泛耐药菌株的不断涌现, 该菌的感染已成为国内乃至世界面临的一大公共卫生问题。Ⅵ型分泌系统(Type ⅥSecretion System, T6SS)是存在于大多数革兰阴性杆菌中的一种新型分泌系统, 对其功能研究发现该系统不仅参与细菌间的种群竞争作用,具有杀伤异种菌功能,还与细菌毒力相关[1-2]。 作为T6SS 的核心组分,溶血素共调节蛋白(Hemolysin-coregulated protein,Hcp)的 检 测是验证T6SS 活性最重要的方法,因此其单克隆抗体的制备显的尤为重要。 另外,Hcp 蛋白家族本身又是一种效应因子,参与细菌的致病过程[3],但其在鲍曼不动杆菌致病性中的研究甚少。 本研究拟构建鲍曼不动杆菌Hcp 原核表达载体, 探索蛋白表达情况并纯化Hcp 蛋白,为后续研究奠定基础。
1 材料与方法
1.1 材料 pET-28a(+)质粒、ATCC17978 标准菌株和E.coli BL21(DE3)菌株为本实验室自存。pJET1.2克隆载体和CloneJET PCR Cloning 试剂盒购于美国Thermo 公司,IPTG、卡那霉素及质粒提取、DNA回收、PCR 产物纯化的试剂盒均购于上海捷瑞生物有限公司,T4 DNA Ligase、Xho Ⅰ和Nco Ⅰ内切酶购于大连宝生生物有限公司,细菌DNA 提取试剂盒、His 蛋白纯化试剂盒、鼠抗-His 多克隆抗体、羊抗鼠IgG(HRP 标记)、蛋白酶抑制剂(PMSF)均购于碧云天上海生物有限公司, PVDF 膜、蛋白超滤管等购于美国Millipore 公司。
1.2 方法
1.2.1 Hcp 基因扩增及产物纯化 采用DNA 提取试剂盒提取ATCC17978 菌株全基因组DNA,根据Hcp 基因序列,参照pET-28a (+)质粒的限制性酶切位点设计合成一对带有Xho Ⅰ和Nco Ⅰ位点的特 异性引物。 引 物 序 列 如 下:F: 5’—GCATCCATGGATGAAAGATATATACGTTGA—3’,R:5’—CCGCT CGAGCGCTGCGTAAGAAGCTGTAT—3’(黑体示酶切位点)。 Hcp 基因扩增通过PCR 技术完成,反应条件为:94℃10 min;94℃40 s,50℃30 s,72℃30 s,30 个循环;72℃10 min。 产物经琼脂糖凝胶电泳进行回收并纯化备用。
1.2.2 pET-28a (+)-Hcp 重组质粒的构建及鉴定根据CloneJET PCR Cloning 试剂盒说明书将Pjet1.2 平末端载体与Hcp 基因纯化物连接, 随后立即转化E.coli DH5α 感受态细胞构建Pjet1.2-Hcp 克隆载体转化株并验证。用Nco I 和Xho Ⅰ对pET-28a(+)和Pjet1.2-Hcp 进行酶切,回收有切口的pET-28a(+)和Hcp 基因片段,将两者以3~5:1(摩尔比)的比例在16℃环境下连接16 h。 连接产物转化E.coli BL21(DE3)感受态细胞,转种LB 固体培养基(用卡那霉素进行筛选),挑取单克隆菌落进行PCR 鉴定、酶切鉴定及测序鉴定。
1.2.3 Hcp 的诱导表达、表达方式的探索及western blot 验证 将导入pET-28a (+)-Hcp 重组质粒的E.coli BL21(DE3)(后面简称“重组菌”)转种含卡那霉素的LB 液体培养基,37℃,250 rpm 培养过夜,次日取适量菌液再次转种, 同样条件培养至OD600≈0.5。 取出2 mL 菌液作对照样品,剩余菌液加入IPTG(终浓度为1 mmol/L)诱导,于相同条件下培养5h(作为对照,导入pET-28a(+)的E.coli BL21(DE3)也同时进行诱导处理),取适量诱导后的菌液备用。 剩下的菌液用超声裂解处理分离沉淀和上清。 取诱导前后的菌液、 空载体诱导菌液100℃煮沸裂解及超声裂解的沉淀和上清进行SDS-PAGE 电泳, 并用western blot 验证目的蛋白。
1.2.4 探索IPTG 诱导Hcp 表达的浓度和时间 取适量过夜培养的重组菌转种LB 液体培养基培养至OD600≈0.5,以不同终浓度的IPTG(0.3 mmol/L、0.5 mmol/L、0.7 mmol/L 和1.0 mmol/L)诱导表达5 h 或以终浓度为1.0 mmol/L 的IPTG 分别诱导表达3 h、5 h、7 h、9 h、10 h。离心收集并处理菌体,经SDS-PAGE 电泳分析结果。
1.2.5 大量表达Hcp 重组蛋白、分析表达方式及纯化 将重组菌转种大量LB 液体培养基培养至OD600≈0.5,以最佳的IPTG 浓度诱导5~7 h,离心收集菌体。加入含PMSF 的超声裂解液及终浓度为1 mg/mL 的溶菌酶重悬菌体,于冰上超声裂解重悬菌, 分离上清和沉淀。 上清和沉淀均进行SDSPAGE 电泳以分析重组蛋白的存在形式。纯化重组蛋白据试剂盒说明书进行。 纯化蛋白液用10 KD的超滤管浓缩,经0.22 μm 滤菌器除菌后分装、保存。
2 结果
2.1 扩增Hcp 基因及PCR 产物纯化 扩增Hcp 基因并纯化后经1.5%琼脂糖凝胶电泳, 获得约500 bp 的基因扩增物,与预期大小一致,见图1。

图1 Hcp 基因扩增产物纯化电泳图
2.2 重组质粒pET-28a (+)-Hcp 的构建及鉴定pET-28a (+) 和Hcp 基因连接后转化E.coli BL21(DE3)并转种培养基,选取数个菌落行Hcp 基因扩增,如图2 所示,菌落1、4、6 为阳性,菌落2、3、5为阴性。 提取1、4、6 菌落的质粒进行双酶切,电泳显示出预期约500 bp 的目的基因,见图3。
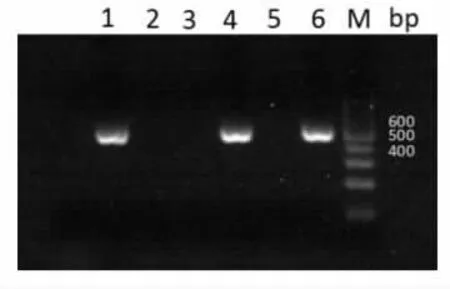
图2 菌落PCR 鉴定结果
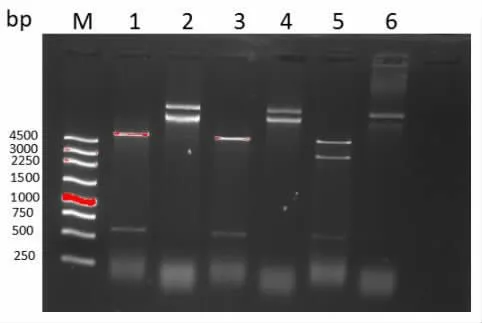
图3 pET-28a(+)-hcp 重组质粒双酶切结果
将上述1、4、6 号菌送上海桑尼生物技术有限公司对Hcp 基因序列测序, 对结果进行比对,与GenBank (CP012004.1):ACX60_11670 相 似 率 达100%。 具体序列如下:GGTACAATTCCCCTCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATAT ACCATGGATGAAAGATATATACGTTGAGTTTCGC GGTAAATATAAAGTTGATGGAGAATCTCGTGATT CTGAGCACAAAGGTTGGTTAGAAGTTAACTCTTG GTCTCATAACATCCGTCAACCTAAATCTGCTACTT CAAGTAGTGTAGGCGGCCACACTGCTGAACGTGT TGAACATTCTGACATGGTTTTCGTAAAAGACTTA GATGCAACTAGCCCTAAATTATGGGAAGCTTGTT CAGCTGGTTATACATTTGATGAAGTACAAATCGA CTTCTATCGTGCAAATGGCGATAAACGTATCAAG TACTTACAAATCAAATTGAAGCACGTTTTAGTTTC TAGTGTGACTCCAACTGTTAACGAAGAAGGCGTT CCTACAGAAGCATTCGGTTTGAAATATGCTGCTG TTGAGTGGACTTATAACCAACAAGATATTAACGG TACTGCTAAAGGTGCTGTTACTAAGAAATGGTCA CTTTCTAATAATACAGCTTCTTACGCAGCGCTCGA GCACCACCACCACCACCACTGAGATCCGGCTGCT AACAAAGCCCGAAAGGAAGCTGAGTTGGCTGCT GCCACCGCTGAGCAATAACTAGCATAACCCCTTG GGGCCTCTAAACGGGTCTTGAGGGGTTTTTTGCT GAAAGGAGGAACTATATCCGGATTGGCGAATGG GACGCGCCCTGTAGCGGCGCATTAAGCGCGGCG GGTGTGGTGGTTACGCGCAGCGTGACCGCTACAC TTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTC TTCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCC CCGTCAAGCTCTAAATCGGGGGCTCCCTTTAGGG TTCCGATTTAGTGCTTTACCGGCACCTC
2.3 Hcp 蛋白的诱导表达 将诱导后的pET-28a(+)导入菌、诱导前后的重组菌煮沸裂解物及重组菌诱导后的超声破菌上清和沉淀同时上样。如图4所示, 重组菌诱导后的煮沸裂解物和超声裂解的上清和沉淀均高表达19KD 的蛋白,而空载体菌和诱导前重组菌则不表达或低表达。
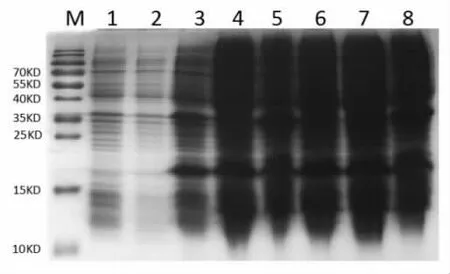
图4 Hcp 蛋白在E.coli BL21 中的表达
2.4 IPTG 诱导Hcp 表达的最佳浓度和时间 如图5A 所示,Hcp 蛋白在0.5 mmol/L IPTG 诱导时表达量最高。如图5B 所示,Hcp 蛋白在诱导5~7 h 后后表达量最高。
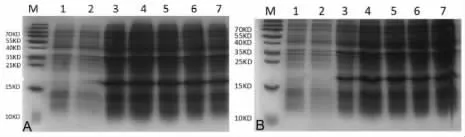
图5 不同IPTG 诱导浓度及不同诱导时间下Hcp 蛋白的表达情况
2.5 蛋白纯化及鉴定 本实验使用重组菌超声裂解的上清液进行重组蛋白的纯化,作为阴性对照,pET-28a(+)导入菌破菌上清也同时同步进行纯化,纯化过程中预留洗涤液、穿流液、洗脱液等验证纯化效果。 电泳显示上清液纯化的洗脱液中仅在19 kD 左右处出现蛋白条带,见图6A。 而pET-28a(+)导入菌破菌上清纯化物中无任何蛋白,见图6B。通过Western blot 进一步鉴定, 蛋白纯化物能与His抗体结合,见图6C。
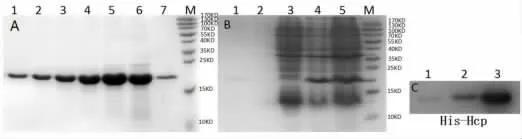
图6 Hcp 蛋白纯化及Western blot 鉴定
3 讨论
鲍曼不动杆菌是一种主要引起医院内感染的革兰阴性菌。 随着近年来多重耐药、泛耐药和高毒力株的出现, 使该菌引起的感染有着高发病率和高死亡率的特点[4-5],因此世界卫生组织已将碳青霉烯耐药的鲍曼不动杆菌列为急需新型抗生素的重点病原体, 广大科研工作者也一直致力于该菌耐药机制和致病机制的研究。
在鲍曼不动杆菌中,Hcp 不仅是T6SS 的核心蛋白,其本身也是一种效应因子,该蛋白常被分泌到细菌培养物的上清液、 感染者的痰液甚至血清中,标志着T6SS 处于活性状态(T6SS+)[6-8]。 因此,大多数科研工作者研究革兰阴性菌T6SS 时的必需首要工作就是制备Hcp 蛋白[1,3,6,9]。本实验通过经典的基因克隆的方法制备了Hcp 原核表达载体并通过测序的方法验证了重组质粒中Hcp 序列未发生突变。 SDS-PAGE 电泳显示重组菌在IPTG 诱导后可大量表达预期大小的蛋白,Western Blot 验证了在原核细胞中高表达的蛋白就是Hcp 重组蛋白。此外,经本实验研究表明,重组菌在0.5 mmol/L的IPTG 诱导5~7 h 的条件下蛋白表达量最高,且目的蛋白在破菌沉淀和上清中的含量相差无异,这为该领域的研究者提供了宝贵经验。 在蛋白纯化上, 本实验选用破菌上清进行目的蛋白的非变性纯化, 同时空载体导入菌也进行同样的操作及纯化,既可验证操作过程的可靠性,又为Hcp 融合蛋白功能的研究提供了对照物。
T6SS 在革兰阴性菌的生存和致病中发挥重要作用[10-12],比如,Hcp 蛋白在洋葱伯克霍尔德菌和鲍曼不动杆菌生物膜形成过程中发挥重要作用[1,13];E.coli K1 引起人脑微血管内皮细胞(HBMEC)炎症反应、 细胞骨架重构和细胞凋亡等方面都有Hcp蛋白家族的参与[3];此外,有研究发现T6SS 的负向调节因子存在于鲍曼不动杆菌内的耐药性质粒上[14],这说明T6SS 与该菌的耐药性也有极大的关联。综上,研究鲍曼不动杆菌的T6SS 有望在其致病机制和耐药机制方面得到新突破。 前期,本团队从基因层面发现Hcp 在感染状态的鲍曼不动杆菌中的表达量较定植状态突出,并且其RNA 水平的表达受到免疫细胞、感染状态和pH 的调节[15],但其蛋白层面的研究并未涉及。Hcp 融合蛋白表达系统的成功构建为上述研究、 去定植研究及疫苗研究等后续研究奠定了坚实的实验基础。
——一道江苏高考题的奥秘解读和拓展

