血清炎症因子对胶质瘤患者术后颅内感染的预测价值
许银才,陈图南,李学刚
1郑州煤炭工业(集团)有限责任公司总医院神经外科,郑州 452371
2陆军军医大学第一附属医院神经外科,重庆 400000
胶质瘤是指源自神经上皮的肿瘤,是临床常见的原发性颅内肿瘤之一,患者的临床症状多为头痛、恶心、呕吐、癫痫等[1]。胶质瘤常采用手术治疗,胶质瘤切除术是神经外科手术,但患者术后易出现严重的颅内感染,加重患者的神经损伤,不利于患者的术后康复,若不及时治疗,可造成不可逆的神经功能损伤,甚至导致患者残疾、死亡等,因此,及时发现、诊断并治疗胶质瘤均有十分重要的意义[2]。临床诊断颅内感染的传统方式包括体征、血液生化、脑脊液检验等,但由于抗菌药物的广泛应用,导致细胞学因子水平发生改变,因此,颅内感染不典型改变难以鉴别诊断[3]。有研究显示,血清学相关炎症因子在颅内感染过程中发挥重要的提示作用,颅内感染早期血清炎症因子可发生明显变化,影响病情进程[4]。本研究旨在探讨血清炎症因子胶质瘤术后对颅内感染的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年4月至2020年6月郑州煤炭工业(集团)有限责任公司总医院收治的胶质瘤患者。纳入标准:①符合《中国中枢神经系统胶质瘤诊断与治疗指南(2015)》[5]中的相关诊断标准;②颅内感染均经腰椎穿刺行脑脊液化验、脑脊液细菌培养及药敏试验明确诊断;③近期未服用过抗感染类药物。排除标准:①合并痴呆,不能正常沟通交流;②合并其他部位感染;③合并自身免疫系统疾病。依据纳入和排除标准,本研究共纳入92例胶质瘤患者,依据术后是否发生颅内感染分为感染组和对照组,每组46例。对照组中男25例,女21例;年龄29~54岁,平均(35.82±4.39)岁;文化程度:小学5例,中学16例,大学25例。感染组中男26例,女20例;年龄28~55岁,平均(35.43±4.51)岁;文化程度:小学4例,中学15例,大学27例。两组患者性别、年龄和文化程度比较,差异均无统计学意义(P﹥0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法
抽取两组患者手术次日清晨空腹静脉血5 ml,5000 r/min离心10 min,取上层血清置于冰箱保存待检。采用双抗体夹心免疫化学发光法检测血清降钙素原(procalcitonin,PCT)水平,PCT正常参考值﹤0.5 ng/ml;采用魏氏法测定血清红细胞沉降率(erythrocyte sediment rate,ESR),ESR正常参考值男性﹤15 mm/h,女性﹤20 mm/h;采用免疫比浊法测定血清C反应蛋白(C-reactive protein,CRP)水平,CRP正常参考值﹤8 mg/L。
1.3 观察指标
①术后比较两组患者血清PCT、ESR和CRP水平。②比较两组患者血清PCT、ESR和CRP阳性率,阳性判定标准:PCT≥0.5 ng/ml、ESR≥20 mm/h、CRP≥8 mg/L。③评估PCT、ESR、CRP单独及联合检测对胶质瘤患者术后颅内感染的诊断价值,三者联合检测时,任何一个指标阳性即判定为阳性。灵敏度=真阳性例数(/真阳性+假阴性)例数×100%,特异度=真阴性例数(/真阴性+假阳性)例数×100%,阳性预测值=真阳性例数(/真阳性+假阳性)例数×100%,阴性预测值=真阴性例数(/真阴性+假阴性)例数×100%。
1.4 统计学方法
采用SPSS 21.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评估PCT、ESR、CRP单独及联合检测对胶质瘤患者术后颅内感染的诊断价值;以P﹤0.05为差异有统计学意义。
2 结果
2.1 术后PCT、ESR、CRP水平的比较
术后,感染组患者PCT、ESR、CRP水平均明显高于对照组,差异均有统计学意义(P﹤0.01)。(表1)
表1 术后两组患者PCT、ESR、CRP水平的比较(±s)

表1 术后两组患者PCT、ESR、CRP水平的比较(±s)
组别PCT(ng/ml)ESR(mm/h)CRP(mg/L)对照组(n=46)1.48±0.2110.24±2.3712.25±3.31感染组(n=46)6.48±1.4538.24±6.0738.26±6.41 t值23.14629.14324.453 P值<0.01<0.01<0.01
2.2 术后PCT、ESR和CRP阳性率的比较
术后,感染组患者血清PCT、ESR和CRP阳性率均明显高于对照组,差异均有统计学意义(P﹤0.01)。(表2)

表2 术后两组患者PCT、ESR和CRP阳性率的比较[ n(%)]
2.3 PCT、ESR、CRP单独及联合检测对胶质瘤患者术后颅内感染的诊断效能
PCT+ESR+CRP诊断胶质瘤患者术后颅内感染的AUC为0.997,高于三者单独检测的0.992、0.994、0.907,此时的灵敏度、特异度、阳性预测值、阴性预测值分别为93.48%、95.65%、95.56%、93.62%。(表3、表4、图1)
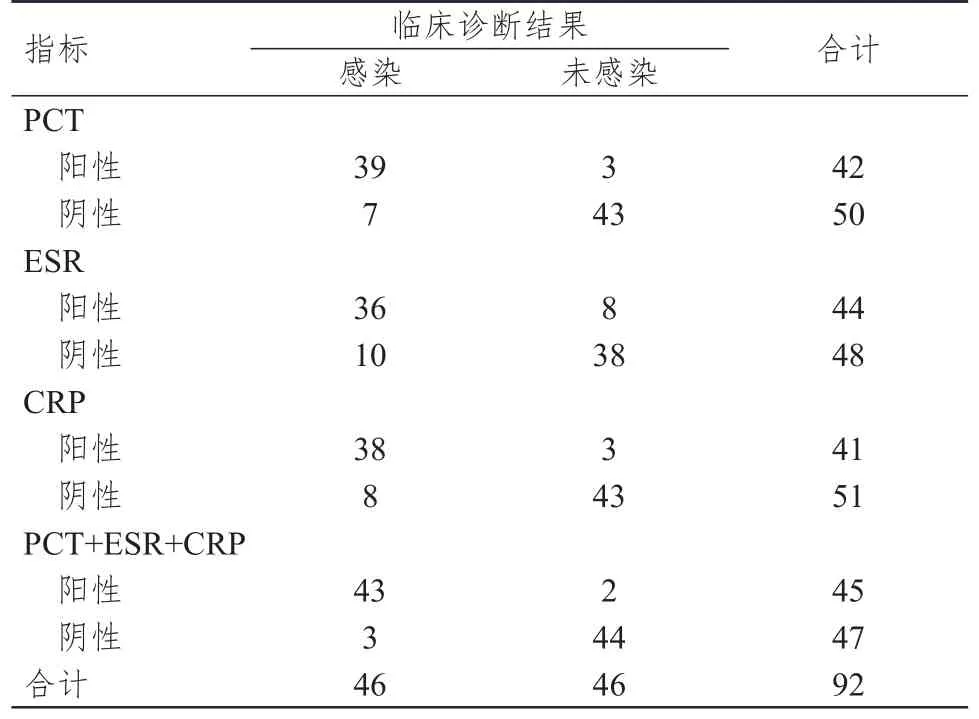
表3 PCT、ESR、CRP单独及联合检测胶质瘤患者术后颅内感染的结果与临床诊断结果的对照
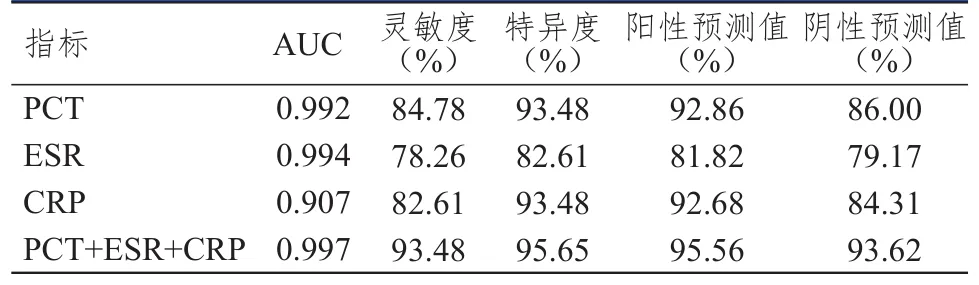
表4 PCT、ESR、CRP单独及联合检测对胶质瘤患者术后颅内感染的诊断效能

图1 PCT、ESR、CRP单独及联合检测诊断胶质瘤患者术后颅内感染的ROC曲线
3 讨论
胶质瘤多由先天遗传因素及环境致癌因素相互作用,导致神经功能受损,引起视觉丧失、运动与感觉障碍、肢体疼痛等[5]。胶质瘤切除术是患者首选的治疗方式,虽然神经外科开颅技术不断提高,但术后患者仍会出现严重的颅内感染,其中以细菌性感染最为常见,若不及时治疗,可引起急性细菌性脑膜炎,不仅给患者身心带来巨大的痛苦,还会因为高额的医疗费用,给患者家庭带来沉重负担[6-7]。
胶质瘤切除术的手术时间长、引流管置入、人工材料置入、脑脊液漏、并发高血压、并发糖尿病等均可引起术后颅内感染,且导致术后颅内感染的病原菌种类较多,包括细菌性炎症、无菌性炎症、血性脑脊液刺激等,患者的临床表现各不相同,但多数患者的临床症状多不典型,因此,传统的诊断方法难以鉴别[8]。抗生素虽然能在一定程度上降低术后感染发生率,但也可使部分细胞学因子相关标志物水平发生变化,导致早期相关症状被掩盖;引流管、人工材料等的置入或脑脊液漏也可引起颅内刺激,其导致的临床症状与颅内感染相似,难以鉴别,给颅内感染的临床诊断带来困难[9-10]。脑脊液虽然是颅内感染的诊断金标准,但该检测耗时长、阳性率较低等,再加上新病原体不断出现,不能及时准确诊断,临床亟需一种灵敏度、特异度均较好的诊断指标[11]。
胶质瘤患者接受手术切除后,颅内外沟通,随着手术时间延长,病原菌通过切口、引流管、置入物等进入血脑屏障,产生大量内毒素直接损伤中枢神经,从而分泌大量促炎性因子,使血清PCT、ESR、CRP水平升高,浸润颅内导致颅内感染[12]。血清炎性因子可影响疾病进展,血清PCT作为降钙素前体,由甲状腺细胞产生,可反映全身炎性反应的活跃程度,有研究证明,当出现严重细菌、真菌感染时,PCT水平会明显升高,但正常生理状态下或自身免疫、病毒感染、过敏等情况发生时,PCT水平不会升高[13-14]。虽然胶质瘤切除术后患者血清PCT水平升高,与血清ESR、CRP相比,PCT更不容易受到手术因素的影响,因此,检测血清PCT水平更有意义[15]。多数颅内感染为局部感染,病原菌刺激产生的内毒素对血清PCT的降解有抑制作用,血清PCT水平显著升高,因此,血清PCT检测对颅内感染的诊断具有重要的指导意义[16]。血清CRP能够通过加强吞噬细胞的吞噬功能,清除侵入机体的病原微生物,发挥机体抗炎及天然免疫作用[17]。有研究显示,正常情况下血清CRP水平较低,但在受到病原菌感染后会迅速升高,并于18~24 h后达到峰值;而胶质瘤切除手术可引起机体防御及免疫反应,血清CRP水平迅速升高,于术后2~3天后达到峰值,在未出现其他并发症的情况下,3~6周后恢复正常[18-19]。因此,血清CRP可作为细菌感染性疾病检测的重要指标之一。血清ESR指红细胞在一定条件下沉降的速度,健康者的红细胞下沉速度较缓慢,ESR波动范围较窄,但感染后多种细胞因子相互作用可导致ESR迅速升高[20-21]。胶质瘤切除术后ESR升高可能是由颅脑内微环境发生改变或手术过程中坏死的组织被机体吸收导致,若术后未发生感染,ESR在3个月内恢复正常;若ESR升高的幅度更大、持续时间更长(ESR升高持续3个月以上,出现第2个高峰),则说明出现颅内感染[22-23]。因此,ESR变化也是诊断颅内感染的重要指标。
本研究结果显示,手术后,感染组患者PCT、ESR、CRP水平均明显高于对照组,PCT、ESR和CRP阳性率均明显高于对照组,PCT+ESR+CRP诊断胶质瘤患者术后颅内感染的AUC为0.997,高于三者单独检测的0.992、0.994、0.907,此时的灵敏度、特异度、阳性预测值、阴性预测值分别为93.48%、95.65%、95.56%、93.62%。表明血清PCT、ESR、CRP对胶质瘤术后颅内感染有一定的诊断价值,但由于本研究纳入的样本量较小,且血清PCT、ESR、CRP均为急性炎症指标,存在一定的信息偏差,术后患者均会发生炎症反应,检测结果可能偏高,因此,血清PCT+ESR+CRP联合检测对胶质瘤术后颅内感染的诊断价值较高,可降低误诊率及漏诊率,便于早期胶质瘤术后颅内感染诊断及治疗。
综上所述,血清PCT+ESR+CRP联合检测对胶质瘤术后颅内感染的诊断价值较高,可降低误诊率及漏诊率,便于早期颅内感染的诊断及治疗。

