人醛缩酶A在大肠杆菌中的表达及纯化
金科华,刘倩倩,向念慈
(1.湖北科技学院医学部医药研究院,湖北 咸宁 437100;2.湖北科技学院医学部基础医学院)
多数肿瘤细胞即便在氧气供应充足的条件下,依然进行旺盛的糖酵解,为其提供能量和合成生物分子的原料,这一特点称为有氧糖酵解或瓦伯格效应[1]。抑制肿瘤细胞的糖酵解途径是极有潜力的抗肿瘤策略[2-4]。醛缩酶A(aldolase 1,ALDOA)是糖酵解途径的重要酶之一,催化1,6-二磷酸果糖裂解为3-磷酸甘油醛和磷酸二羟丙酮。Tang等[5]发现ALDOA的高表达与肝癌的转移与不良预后密切相关;Li等[6]发现ALDOA通过促进糖酵解,加速肝内胆管癌的增值;Tu等[7]体外研究发现过表达ALDOA促进肺癌转移性克隆形成;也有研究[6,8-9]发现抑制ALDOA的活性可降低肿瘤细胞生长速度。本研究旨在利用基因工程在大肠杆菌中表达ALDOA,为发现ALDOA的抑制剂和酶学研究奠定基础。
1 材料与方法
1.1 实验材料
大肠杆菌[Top10及BL21(DE3)]、DNA marker为北京全式金生物技术公司产品。ALDOA cDNA由厦门大学生命科学学院韩家淮院士馈赠。卡那霉素、IPTG、质粒抽提试剂盒、凝胶回收试剂盒为生工生物工程(上海)股份有限公司产品。限制性核酸内切酶为NEB公司产品。Pyrobest DNA Polymerase、DNA连接试剂盒为TaKaRa公司产品。His-Tag蛋白纯化试剂盒(可溶性)购自康为世纪生物科技有限公司。BCA蛋白质定量测定试剂盒为Bio-sharp公司产品。截流分子量10kd超滤管(15mL)为Millipore公司产品。
1.2 扩增ALDOA cDNA
据ALDOA cDNA序列,用Snapgene软件设计扩增引物。上游引物F:CGACATATGATGGCCGCCTACAAACTGG;下游引物R:AGTCTCGAGT-CACTTCTTGGCCTTGCCC。序列的前三个是保护碱基,下划线处分别为Nde I和Xho I位点。引物委托生工生物工程(上海)股份有限公司合成。
将含ALDOA cDNA的菌液按1∶10接种于含100μg/mL卡那霉素的LB,37℃ 220r/min培养48h,按质粒抽提试剂盒提取含ALDOA cDNA的质粒。
PCR体系:cDNA模板1μL,引物F(10μmol/L)和R(10μmol/L)各1μL,10×Pyrobest Buffer 5μL,2.5mmol/L dNTPs 4μL,Pyrobest DNAPolymerase 1μL,H2O 37.5μL。PCR参数:95℃预变性3min;94℃变性30s,58℃退火30s,72℃延长1min,循环30次;72℃延长10min。扩增产物经琼脂糖凝胶电泳鉴定并进行胶回收纯化。
1.3 酶切、连接与转化
cDNA、pET-28a及pET-28a-ALDOA的酶切按表1进行。酶切产物行琼脂糖凝胶电泳分离、胶回收纯化。取酶切纯化的cDNA、pET-28a各2.5μL与5μL Solution I混匀,于16℃连接3h。按Top10感受态细胞说明书转化连接产物、筛选抗性菌落。
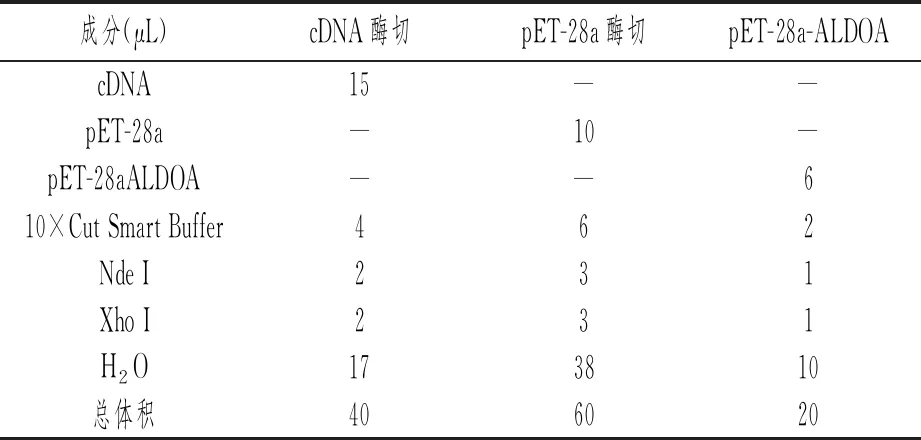
表1 cDNA、pET-28a及pET-28a-ALDOA的酶切
1.4 鉴定重组质粒
重组表达质粒pET-28a-ALDOA按表1酶切,产物于1%琼脂糖凝胶电泳鉴定。酶切鉴定与预期一致的重组质粒送华大基因测序。
1.5 表达与纯化ALDOA
诱导表达与纯化。按1.3将28a-ALD转化BL21(DE3)细胞,将一个单菌落接种于3mL LBK培养基,37℃ 260r/m培养过夜。取过夜培养的菌液1mL接种于100mL LBK培养基,37℃ 260r/m培养至OD600为0.78,加入终浓度0.2mmol/L IPTG,16℃诱导培养24h。12 000r/min,4℃离心5min,收集菌体。加5mL细菌蛋白抽提缓冲液(含1mmol/LPMSF)重悬细胞,以260W超声10s停10s的程序,超声裂解30min。裂解液于12 000r/min,4℃离心10min。将上清与等体积Binding Buffer混匀,得混合液。取1mL Ni2+填料,装入纯化柱,按说明书洗涤、平衡。于4℃纯化ALDOA:将混合液加入纯化柱,流出未结合的蛋白质。分别用含20、40mmol/L咪唑的Binding Buffer各40mL洗涤非特异性结合蛋白质,再用40mL Elution Buffer洗脱ALDOA。
浓缩与缓冲液交换。用截留分子量10Kd的超滤管,将ALDOA洗脱液离心(4℃,4 000g)浓缩至1mL,加入9mL pH7.0磷酸缓冲的盐溶液(PBS)稀释浓缩液,再次离心浓缩至1mL,重复稀释—浓缩15次,最后一次浓缩至4mL。彻底降低ALDOA洗脱液中的咪唑浓度。
取20μL浓缩的ALDOA,用PBS稀释10倍,按BCA蛋白质定量试剂盒测定ALDOA浓度。向剩余的ALDOA浓缩液中加入终浓度2mmol/L PMSF,与等体积的灭菌甘油混匀,分装后保存于-20℃。
2 结 果
2.1 ALDOA cDNA的PCR扩增
PCR产物的琼脂糖凝胶电泳结果如图1,PCR扩增后有介于1000bp和1200bp的条带,与ALDOA cDNA分子量(1095bp)接近(1泳道),阴性对照无扩增条带(2泳道)。可见ALDOA cDNA扩增成功。

1:200bp DNA Ladder;2:ALDOA cDNA PCR产物;3:阴性对照PCR产物
2.2 重组质粒的鉴定
重组质粒pET-28a-ALDOA经Nde I+Xho I酶切产物大片段与pET-28a经相同酶切的产物(图2泳道1)相符,小片段(图2泳道2)与ALDOA cDNA分子量(1 095bp)吻合。可知,PCR产物已插入pET-28a质粒中。
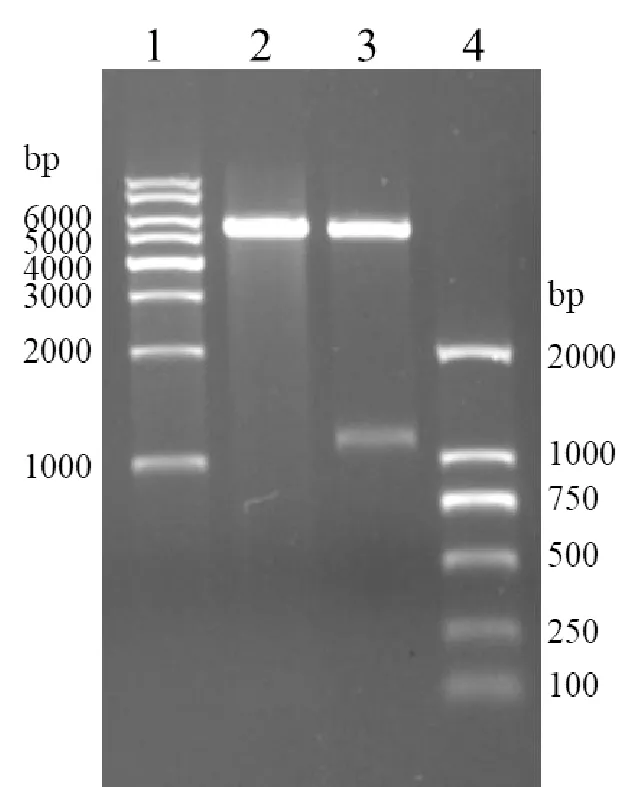
1:1kb DNA Ladder;2:pET-28a Nde I+Xho I酶切产物;3:pET-28a-ALDOA Nde I+Xho I酶切产物;4:Trans2K DNA Marker
pET-28a-ALDOA的测序信号峰如图3所示(展示一部分),序列比对显示插入pET-28a中的序列与ALDOA cDNA序列相同。蓝色下划线序列为pET-28a Nde I位点,红色下划线序列为ALDOA的起始密码子。
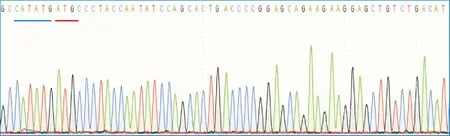
图3 pET-28a-ALDOA测序图
2.3 ALDOA的表达与纯化
ALDOA表达上清SDS-PAGE鉴定结果如图4所示。0.2mmol/L IPTG诱导的pET-28a-ALDOA-BL21(DE3)上清中有一条位于35~40Ku的浓带(泳道3),和ALDOA分子量(39Ku)一致,未经IPTG诱导的菌体无此带(泳道2),可知ALDOA获得了可溶性表达。经Ni2+纯化的ALDOA杂带少,纯度高(泳道4红色箭头示)。ALDOA经超滤浓缩和缓冲液交换后,测定其浓度约为15mg/mL,故100mL IPTG诱导后的菌液共获得60mg纯化的蛋白。由此计算,ALDOA的表达量约为600mg/L。
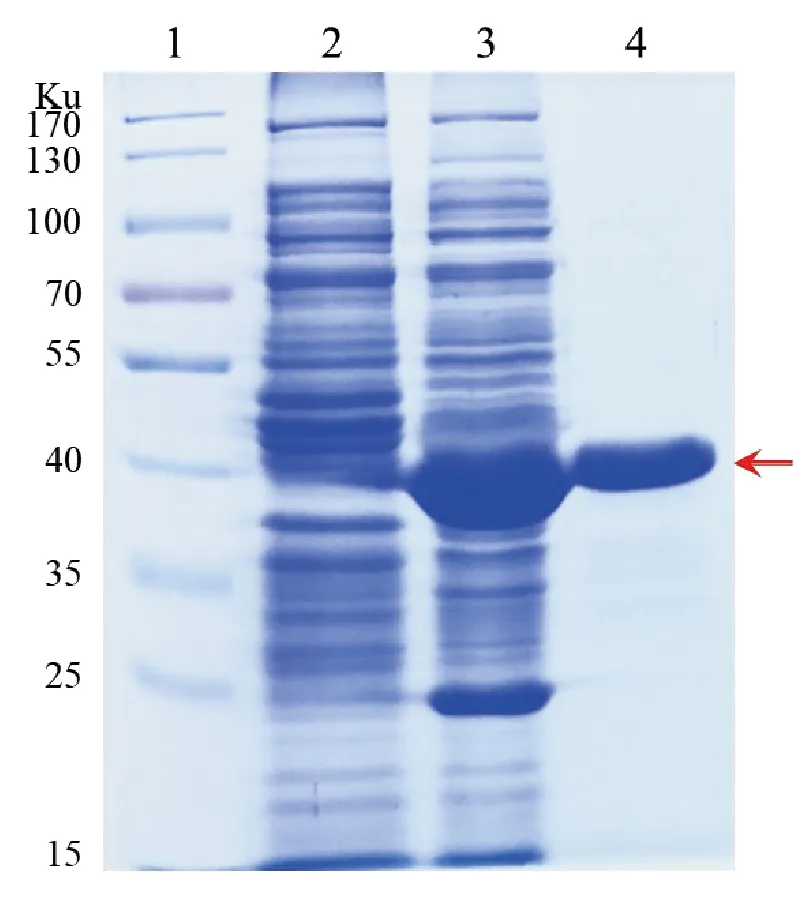
1:ProteinMarker;2:pET-28a-ALDOA-BL21(DE3)未经IPTG诱导的上清;3:pET-28a-ALDOA-BL21(DE3)0.2mmol/L IPTG诱导的上清;4:纯化的ALDOA
3 讨 论
本文利用重组DNA技术构建了ALDOA的大肠杆菌重组表达载体pET28a-ALDOA。重组菌pET28a-ALDOA-BL21(DE3)经0.2 mmol/L IPTG诱导,获得了高纯度的可溶性ALDOA,产量达600mg/L。为降低纯化产物中咪唑对实验的影响,我们用超滤对ADLOA进行浓缩和缓冲液交换,为后续的抑制剂筛选等研究奠定了坚实基础。
1,6-二磷酸果糖经ALDOA催化的产物磷酸二羟丙酮和三磷酸甘油醛不能通过吸光值等简易方法来检测。高压液相色谱和薄层层析虽可将二者分离,但需要购买昂贵且不稳定的磷酸二羟丙酮和三磷酸甘油醛作标准品,加之这些技术步骤多,耗时长,难以建立基于此二者的高通量抑制剂筛选模型。3-磷酸甘油脱氢酶(glycerol 3-phosphate dehydrogenase,GPDH)催化磷酸二羟丙酮与NADH反应,将磷酸二羟丙酮还原为3-磷酸甘油,NADH则被氧化为NAD+。因NADH在340nm波长处有特征吸收值,而NAD+没有,故可以采用ALDOA和GPDH偶联法,利用分光光谱法检测OD340,建立抑制剂筛选模型。为建立ALDOA的抑制剂筛选模型我们正着手构建GPDH的表达载体,生产GPDH。

