碱性神经酰胺酶抑制剂D-e-MAPP对胰腺癌小鼠模型的作用*
陈泰宇,吴 炀,杨慧媚,陈冰丽,张鹏程,喻亚群,肖 娟**
(1.桂林医学院附属医院广西肝损伤与修复分子医学重点实验室,广西 桂林 541001;2.桂林医学院附属医院广西神经鞘脂代谢相关疾病基础研究重点实验室;3.桂林医学院附属医院肝胆胰外科)
胰腺癌(pancreatic adenocarcinoma,PAAD)恶性程度高,同时早期诊断困难[1-2],具有病程短、进展快、预后差等特点,其癌症死亡率排第7位[3]。除手术切除外,化学疗法是主要的治疗手段。吉西他滨已成为治疗胰腺癌的标准化疗方法,但其单药治疗有效率不到20%[4]。胰腺癌患者的五年生存率不到10%[5],大多数患者死于耐药性转移性疾病。神经酰胺酶(ceramidase,Cer)已被证实在多种癌细胞中过量表达[6],说明这可能是一个潜在的靶点。神经酰胺酶对肝癌的作用效果先前已有报道[7],而对胰腺癌的作用鲜有报道。D-e-MAPP是一种碱性神经酰胺酶(alkaline ceramidase,ACER)抑制剂,可促进肿瘤细胞凋亡以抑制肿瘤增殖。本研究通过建立Pan02-luc胰腺癌细胞株小鼠移植瘤模型,观察D-e-MAPP对小鼠移植瘤生长的影响,并检测肿瘤组织中碱性神经酰胺酶表达量变化及Ki-67蛋白表达情况,探讨其可能的作用机制。
1 材料与方法
1.1 试剂与材料
胰腺癌细胞系Pan02-luc购自上海中乔新舟生物科技有限公司;无病原体雄性C57/BL小鼠购自湖南斯莱克景达实验动物有限公司;DMEM高糖培养基购自美国Gibco公司;胎牛血清购自浙江天杭生物科技股份有限公司;D-e-MAPP购自美国Cayman Chemical公司;荧光素酶底物D-Luciferin购自美国MedChemExpress公司。
1.2 实验方法
1.2.1 细胞培养
胰腺癌Pan02-luc细胞置于含10%胎牛血清的DMEM培养基,37℃ CO2培养箱中。胰酶EDTA消化传代,每2~3d传代一次。待细胞达到所需数量时,取对数生长期的细胞,用培养基重悬为1×107/mL。
1.2.2 建立肿瘤模型及给药
C57/BL小鼠在无病原体条件下喂养,待小鼠生长至6周时,在每只小鼠右背侧近腋部皮下注射200μL胰腺癌Pan02-luc系细胞,7d内移植瘤出现表示模型建立成功。随后挑选成瘤大小相似的16只小鼠随机分为低剂量治疗组、高剂量治疗组、低剂量对照组、高剂量对照组,每组4只。低、高剂量治疗组分别于肿瘤周围皮下注射20mg/kg、30mg/kg D-e-MAPP,低、高剂量对照组注射等量溶剂。皮下注射药物或溶剂持续2周,2次/周。每隔7d记录小鼠体重变化。
1.2.3 生物发光活体成像
每次给药后1d采用活体成像系统检测荧光信号强度。观测前先按30mg/kg腹腔注射D-Luciferin,约10min用异氟烷气体麻醉小鼠后放入活体成像系统,观察皮下肿瘤的荧光强度。
1.2.4 肿瘤体积测定及肿瘤抑制率
在停止治疗2d后,采取颈椎脱臼处死小鼠,取肿瘤组织。通过测量肿瘤长径(L)和短径(W)计算肿瘤体积,计算公式为:肿瘤体积V(cm3)=L×W2/2×100%。
1.2.5 HE染色观察肿瘤形态学变化
肿瘤经多聚甲醛固定并石蜡包埋切片后,经脱蜡、水化、蒸馏水冲洗,转入苏木精中染色10min,经1%盐酸酒精分色和蒸馏水冲洗,然后使用伊红染液染色3min,经酒精脱水、二甲苯透明后封片扫描切片观察并拍照。
1.2.6 免疫组化法检测肿瘤Ki-67表达
切片脱蜡复水处理,用内源性过氧化物酶阻断剂37℃处理20min,然后用免疫染色封闭液37℃封闭10min,随后在4℃过夜避光孵化抗Ki-67抗体。次日用PBS冲洗3次,在室温下避光孵育二抗1h,加入DAB显色8min,苏木素复染10s,中性树胶封片后扫描并拍照。使用ImageJ软件计算积分光密度值(integrated optical density,IOD)[8]。
1.2.7 Western blot检测碱性神经酰胺酶表达量
将经过处理后的肿瘤组织转移至1.5mL离心管中,1 500r/min离心5min,弃上清,加入适量细胞裂解液,冰上裂解30min,12 000r/min离心10min获得蛋白样品。进行凝胶电泳、转膜,脱脂牛奶封闭1h后TBST清洗3次,5min/次;一抗稀释液(1∶1 000)4℃过夜孵育;二抗稀释液(1∶4 000)室温孵育1h,ECL化学发光法置于成像系统中观察并拍照,以β-Tubulin为内参,并通过Image J软件进行灰度值扫描分析。
1.3 统计学方法

2 结 果
2.1 D-e-MAPP对小鼠体重、肿瘤体积的影响
实验期间各组小鼠饮食、体征均正常,无死亡情况。各组小鼠体重无明显差异(P>0.05)。计算各组小鼠的肿瘤体积大小,与对照组相比,高低剂量的D-e-MAPP处理后,小鼠肿瘤体积均值均下降,且高剂量治疗组抑瘤率大于低剂量治疗组,但组间肿瘤大小差异不具有统计学意义(P>0.05)。表明本实验条件下D-e-MAPP对胰腺癌皮下荷瘤的体积无明显影响。见图1、2,表1。
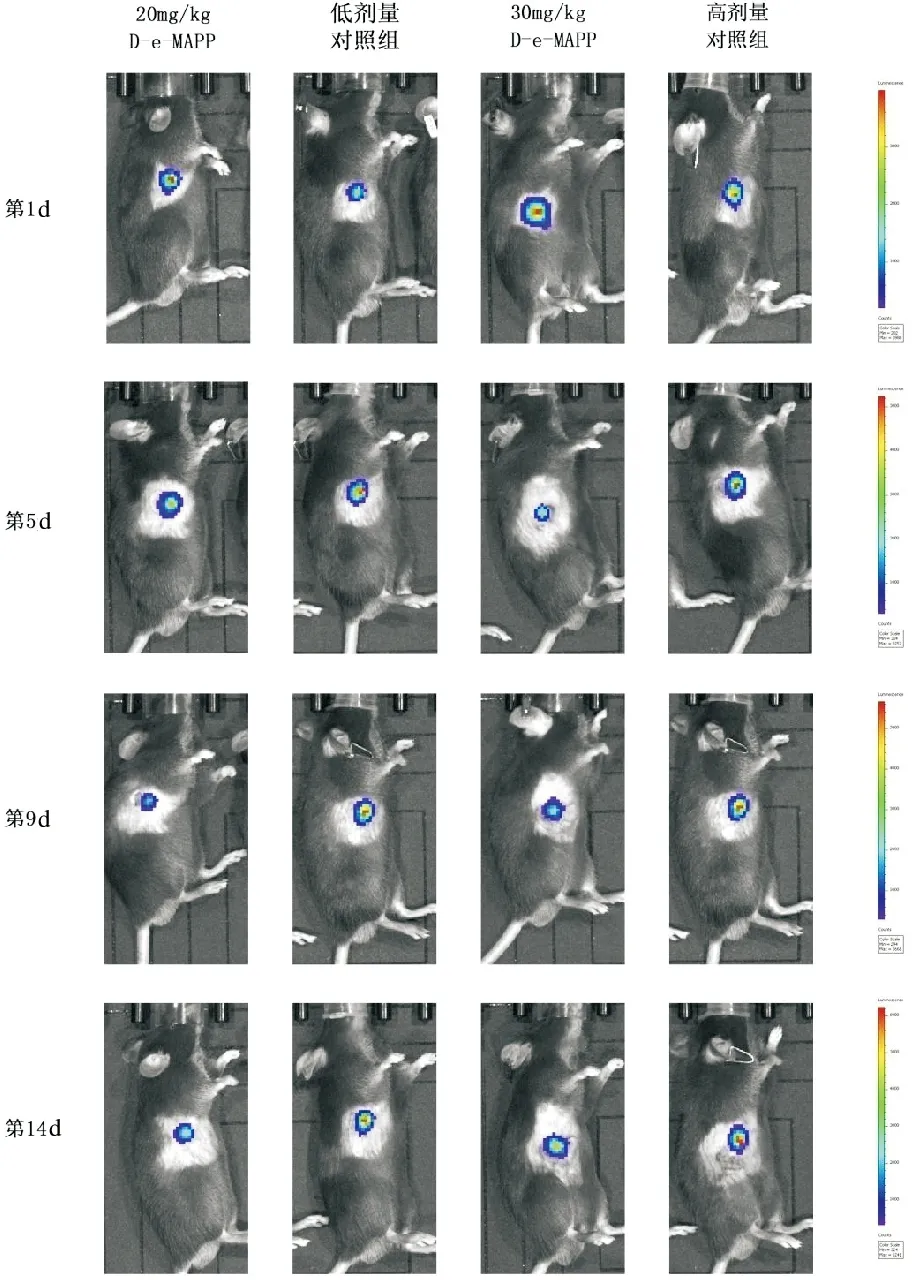
图1 各组小鼠活体荧光成像结果
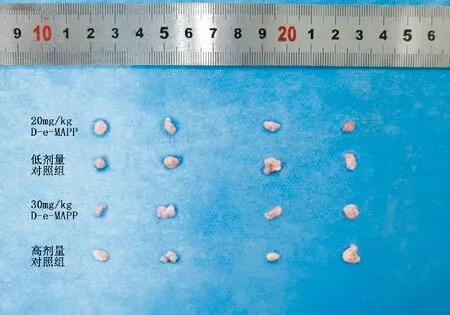
图2 各组小鼠剥离的肿瘤组织

表1 D-e-MAPP对小鼠体质量及皮下肿瘤大小的影响
2.2 D-e-MAPP对肿瘤细胞增殖及凋亡的影响
HE染色后可见治疗组肿瘤细胞排列疏松,出现纤维化和组织空缺区域。Ki-67免疫组化染色后可见低剂量治疗组Ki-67阳性表达降低但未达到统计学意义(P>0.05),高剂量治疗组Ki-67阳性表达显著降低(P<0.05),低剂量治疗组平均表达率降低更明显。见图3。
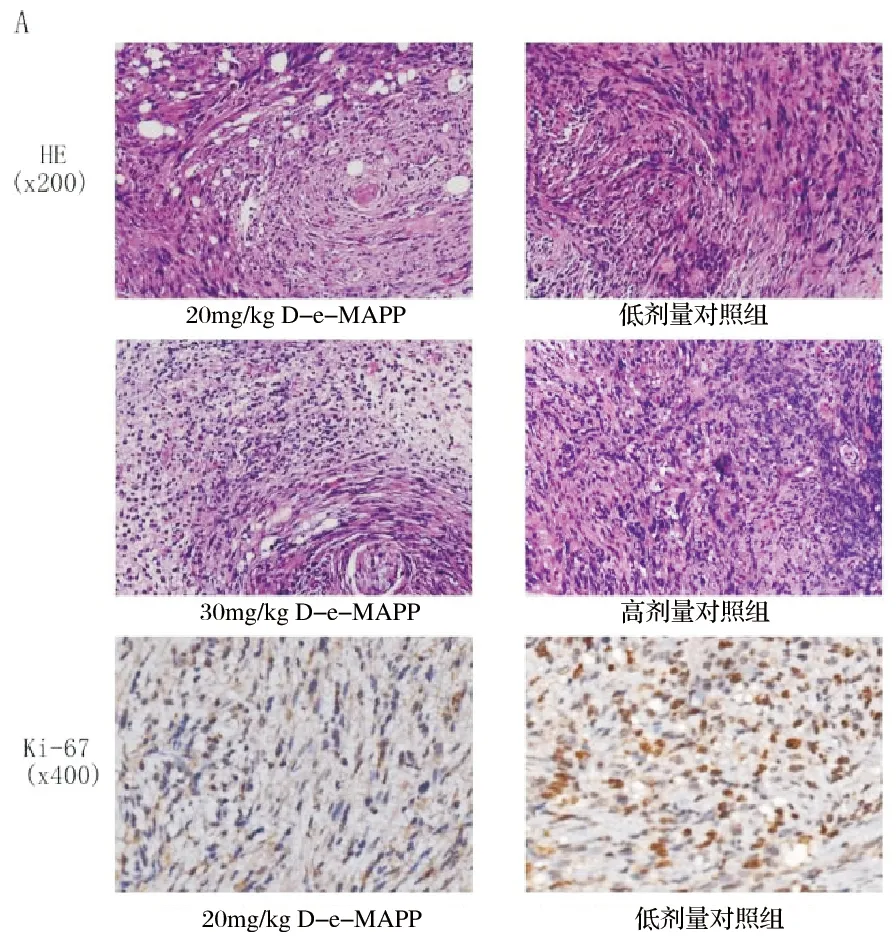
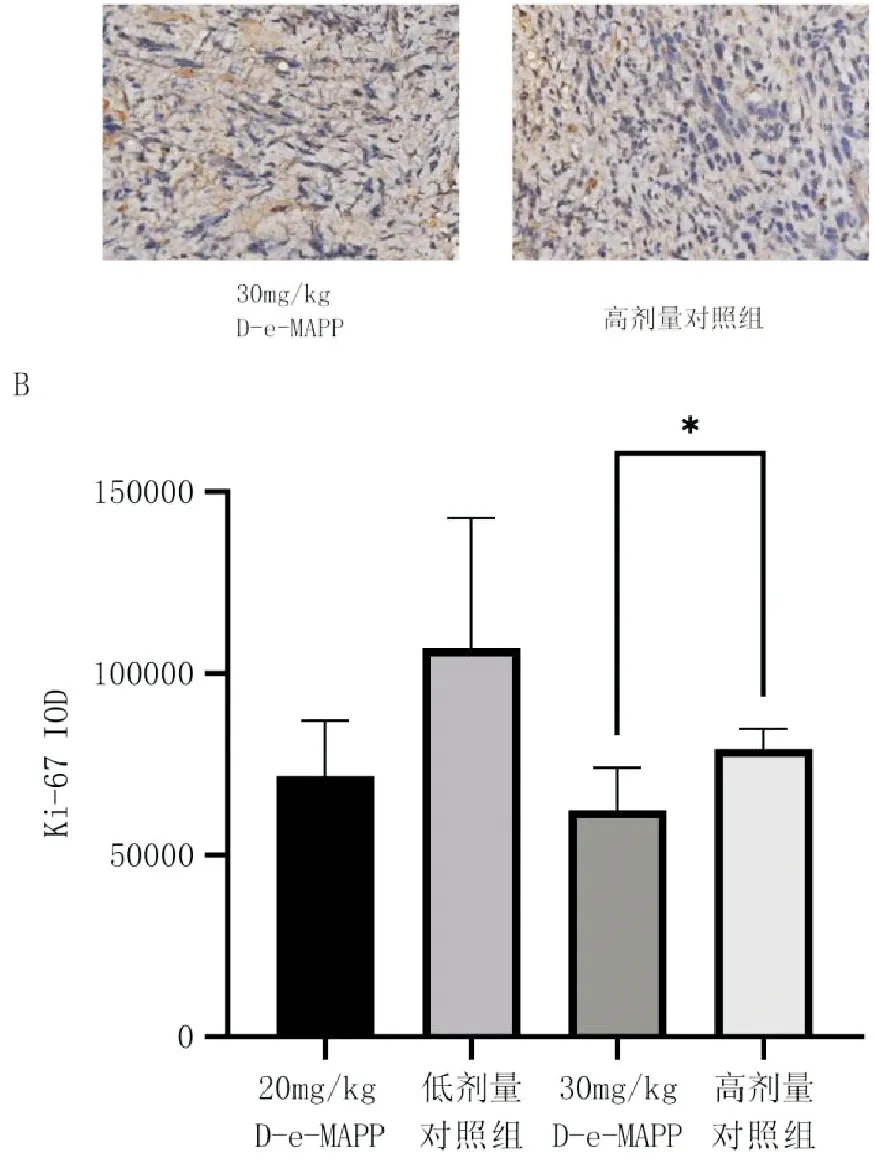
与对照组比较,P<0.05,n=4
2.3 Western-blot检测各组肿瘤组织中碱性神经酰胺酶表达量变化
Western-blot检测ACER1后可见低、高剂量治疗组的ACER1表达降低,且低剂量治疗组降低更明显。可见D-e-MAPP抑制肿瘤增殖可能与抑制碱性神经酰胺酶有关。见图4。

图4 Western-blot检测各组肿瘤组织中ACER1蛋白表达
3 讨 论
神经酰胺酶能够调节Cer、鞘氨醇(sphingosine,SPH)、1-磷酸鞘氨醇(sphingosine1-phosphate,S1P)之间的代谢平衡[9]。Cer和SPH可以抑制细胞生长、促进凋亡,S1P发挥相反作用。抑制神经酰胺酶,可以增加Cer和SPH,减少S1P,从而抑制肿瘤生长[10]。有研究[11]表明D-e-MAPP可以通过抑制ACER显著抑制S1P,而研究[12]表明ACER2在多种癌症中发挥重要作用。本实验通过向胰腺癌小鼠注射D-e-MAPP后ACER1的水平降低,表明D-e-MAPP可能通过抑制碱性神经酰胺酶抑制肿瘤生长。但本课题对ACER2、ACER3的作用未进行检测,不能排除ACER2及ACER3的作用。
本实验结果发现,药物对小鼠体重无明显影响(P>0.05);D-e-MAPP对肿瘤体积无显著影响(P>0.05);高剂量D-e-MAPP显著抑制小鼠肿瘤组织中Ki-67的表达(P<0.05);说明D-e-MAPP作用后,ACER1表达水平降低。产生这一现象的原因可能是D-e-MAPP给药的频次,时间只能在分子水平影响肿瘤,还不足以引起肿瘤体积的改变。而高剂量治疗组抑制ACER1不如低剂量治疗组明显可能是由于较高剂量的DMSO影响了D-e-MAPP的药效。
有研究[13-14]表明microRNA在胰腺癌的增殖和吉西他滨的耐药方面密切相关。本实验结果表明,碱性神经酰胺酶抑制剂D-e-MAPP对Pan02-luc胰腺癌细胞的增殖具有一定抑制作用,对于D-e-MAPP与microRNA及耐药的相关性还有待进一步研究。

