抗乙肝病毒药物拉米夫定和恩替卡韦对OH2溶瘤效果的影响
李 楠,张思琪,刘滨磊,高 卉*
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.武汉滨会生物科技股份有限公司)
慢性乙型肝炎是我国常见的慢性传染病之一,严重危害人民健康[1]。慢性乙型肝炎可以发展成为肝硬化,同时有研究表明乙肝病毒是诱发肝癌最主要的危险因素之一[2]。在治疗乙型肝炎诱发的肝癌过程中要同时给予合理的抗病毒治疗,减少相关并发症[3]。拉米夫定(Lam)和恩替卡韦(Ente)作为在临床上治疗慢性乙型肝炎效果较好的核苷酸类药物[4],可用于乙型肝炎引起的原发性肝癌的临床抗病毒治疗。
重组人GM-CSF溶瘤Ⅱ型单纯疱疹病毒(OH2)是通过基因编辑技术在野生型的Ⅱ型单纯疱疹病毒去除神经毒性因子(ICP34.5)和免疫抑制因子(ICP47),同时在ICP34.5基因位点插入基因序列人粒细胞-巨噬细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor,hGM-CSF)构建的一种溶瘤病毒[5],其对肿瘤治疗活性强,针对性强,能携带各种外源基因,同时具有安全性高等特点。在临床试验过程中对于乙型肝炎导致的肝癌治疗中,使用OH2注射液需要同时服用抗乙肝病毒药物。本实验主要研究OH2注射液在治疗携带乙型肝炎的肝癌患者时,Lam和Ente这两种抗乙肝病毒药物是否会影响到OH2注射液的疗效,为OH2在临床试验中治疗肝癌提供证据。
1 材料与方法
1.1 实验材料
18只雌性BALB/c小鼠,购自湖北省食品药品安全评价中心,在无致病原的动物实验室中进行饲养,动物给药时其大小为4~6周,通过标记小鼠尾巴加以区分。
实验过程中使用的CT26-iRFP细胞由本实验室前期保存,细胞培养需要的DMEM/F-12、MEM培养基来自HyClone,USA、胎牛血清(FBS)购买于浙江天杭,胰酶采购于Gibco公司,OH2注射液由本实验室提供,病毒稀释用的肌醇山梨醇缓冲液(IS Buffer)由本实验室自配,IS Buffer重悬的OH2病毒分装冻存于-70℃超低温医用冰箱,使用前快速解冻。拉米夫定片、恩替卡韦分散片均购于湖北省中西医结合医院(湖北新华医院),所有药物使用时均获得国药准字号,且均在保质期内。细胞计数仪器采购于赛默飞公司,小动物活体成像仪购于PE公司,CO2培养箱购于日本松下公司。
1.2 实验方法
1.2.1 CT26-iRFP细胞制备
提前一天将CT26-iRFP细胞从液氮罐中取出进行复苏,然后用含10%FBS的DMEM/F12重悬于T75细胞瓶中放置于37℃ 5%CO2培养箱。培养至细胞汇合度达到80%~90%进行传代,37℃ 5%CO2培养箱中培养48h后观察,待CT26-iRFP细胞汇合度达到80%~90%后,离心机800转离心5min收集细胞,用DMEM/F12将细胞稀释到1×107个/mL。
1.2.2 OH2病毒准备
将按照标准生产流程(SOP)生产的OH2病毒解冻后混匀,用IS Buffer将1×108CCID50/mL的病毒稀释至1×107CCID50/mL,分装后保存于-70℃超低温医用冰箱。
1.2.3 Lam和Ente药物准备
根据人和小鼠的体表面积比例并根据药物使用说明书计算小鼠的给药量,如:人(70kg)100mg/d,小鼠(20g)体表面积是人的0.0026倍,故小鼠每日剂量为100 000μg×0.0 026=260μg的比例,所以Lam小鼠每日注射量为260μg/100μL,Ente小鼠每日注射量为2.6μg/100μL。分别用无菌PBS充分溶解后定容并用0.22μm的滤头在生物安全柜中过滤除菌,分装后4℃避光保存。
1.2.4 BALB/c小鼠皮下肿瘤诱导
18只BALB/c雌性小鼠,右侧背部皮下接种CT26-iRFP肿瘤细胞100μL,包含106个细胞诱导肿瘤,观察出瘤情况并测量肿瘤直径(L)和短径(W),按照小鼠肿瘤体积计算公式:0.5×L×W2,计算肿瘤体积并绘制肿瘤生长曲线。
1.2.5 小鼠分组给药及量取肿瘤体积
植瘤6d后观察小鼠肿瘤,待肿瘤体积达到60mm3时,将18只小鼠随机分为4组,OH2组(n=4)、OH2+Lam组(n=5)、OH2+Ente组(n=5)、阴性对照组(n=4)。实验组将1×107CCID50/mL100μL的OH2病毒瘤内注射,稀释后的Lam和Ente通过腹腔注射给药,阴性对照组瘤内注射IS Buffer100μL。将首次给药治疗记为第0d,连续给药治疗7d;OH2+Lam组、OH2+Ente组每日腹腔注射100μL有效剂量的抗乙肝病毒药物,OH2组、阴性对照组给予等量的PBS。OH2病毒组分别在第0、4、7d给药。在首次给药治疗后测量肿瘤大小并评估抑制肿瘤效果。
1.2.6 小鼠CT26-iRFP肿瘤模型建立
首次给药治疗后的第21d,用小动物活体成像系统拍摄各组小鼠肿瘤近红外荧光表达,并比较在相同面积下各个小鼠肿瘤的荧光强度。
1.3 统计学方法
用GraphPad Prism 7软件进行统计学分析,各个小组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 BALB/c小鼠量瘤结果
研究结果显示,与阴性对照组相比较瘤内注射OH2病毒的动物肿瘤生长趋势相对平缓,见图1。首次给药治疗后第21d与阴性对照组比较OH2组、OH2+Ente组治疗效果明显,具有显著性差异(P<0.05);OH2+Lam组与阴性对照组相比未见明显差(P>0.05)。其中OH2组和OH2+Ente组之间无显著性差异(P>0.05),见图2。在给药7d后停药一段时间发现OH2+Ente组和OH2组这两组药物肿瘤治疗效果未见明显反弹。
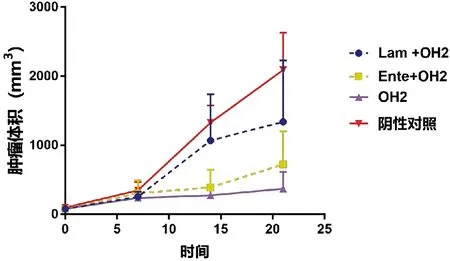
图1 小鼠肿瘤生长趋势
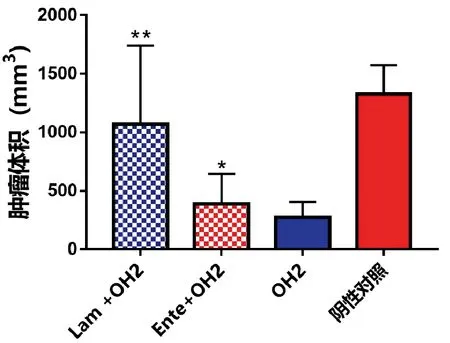
与阴性对照组比较,*P<0.05,**P<0.01
2.2 BALB/c小鼠肿瘤荧光强度结果
在给药后第21d对小鼠进行红外荧光强度检测,用小动物活体成像拍照荧光结果显示与小鼠测量肿瘤大小数据大致相同,见图3。其中OH2+Ente组与阴性对照组具有显著性差异(P<0.05),OH2组和OH2+Lam组未见明显差异(P>0.05),但阴性对照组的荧光强度(1.38×1010±1.95×109)明显高于OH2组(6.21×109±2.43×109),OH2+Lam组(1.79×1010±2.33×109)总荧光强度相比较阴性对照组总荧光强度强些。见图4。
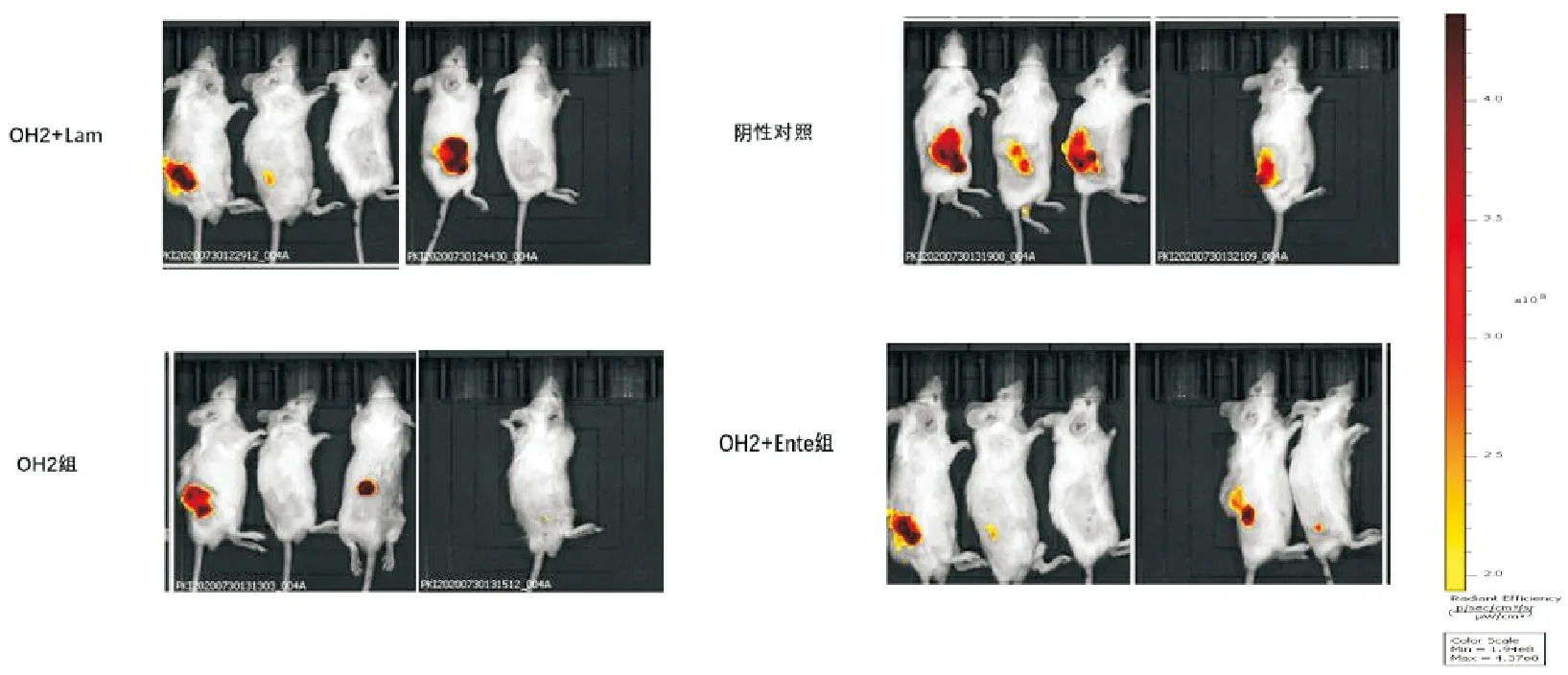
图3 首次给药后第21d小鼠肿瘤荧光图
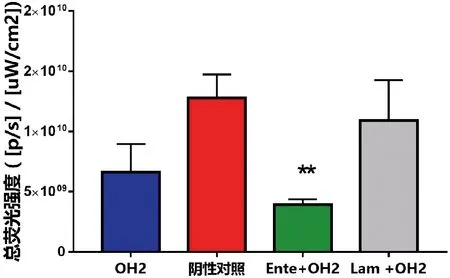
与阴性对照组比较,**P<0.01
3 讨 论
在目前的临床试验过程中溶瘤病毒(OH2注射液)的治疗效果良好,患者对药物的耐受性表现良好,并且患者注射部位反应较小,安全性好,具有较好的应用前景[6]。对于患有携带乙肝病毒的肝癌患者,在服用抗乙肝病毒药物时接受OH2注射液治疗会产生影响[7],值得我们关注。
本研究主要是通过分别腹腔注射Lam和Ente药物后,瘤内注射OH2对CT26-iRFP肿瘤模型的治疗效果来评价,观察这两种药物对OH2注射液溶瘤情况的影响。研究结果表明OH2+Ente组有明显抑制小鼠肿瘤生长趋势,与OH2组治疗后的小鼠肿瘤大小相比较无明显差异,OH2+Ente组治疗后的小鼠总荧光强度稍弱于OH2组。我们可以认为Ente药物在OH2溶瘤过程中并无影响。OH2+Lam组在给药结束后小鼠肿瘤生长速度明显高于OH2组,但与阴性对照相比小鼠肿瘤生长速度稍低。从小鼠肿瘤荧光强度图中我们可发现OH2+Lam组肿瘤荧光强度较高同时又具有个体差异性,其中两只小鼠肿瘤体积过大荧光强度过高从而影响最终实验结果导致与阴性对照组无明显差异。这种情况的发生有可能是Lam药物影响了OH2中hGM-CSF的表达从而影响了其抗肿瘤的作用,从而导致OH2注射液在治疗后期,肿瘤的增长速率增快,最终没有达到理想的抗肿瘤效果。综上可得出Ente药物更适用于OH2临床试验过程中的携带乙肝病毒的肝癌患者,其在服用Ente抗乙肝病毒过程中并不会影响OH2的溶瘤效果。

