海藻酸钠疏水改性及负载大黄素体外缓释研究*
陈 乐,吴建龙,袁佳新,刘思慧,庞义军,罗斌华
(湖北科技学院医学部药学院,湖北 咸宁 437100)
大黄素的免疫抑制、降压、抗肿瘤等作用受到极大关注[1-2]。但大黄素几乎不溶于水,导致其在临床应用中溶出速度慢,生物利用度很低,限制了其临床应用。相关研究发现将大黄素制成脂质体[3]、固体分散体[4]、纳米乳[5]等制剂以克服这些缺点。因此,要实现大黄素的应用,关键在于开发一种既有良好的生物相容性,又能很好地装载大黄素到达释药部位的载体材料。
聚乳酸(PLA)具有良好的生物相容性,受到广泛关注[6],而PLA为疏水性聚合物,表面缺乏可反应的官能团,降解周期难于控制等缺点严重限制了其在生物医学领域的应用[7]。海藻酸钠(sodium alginate,SA)是一种天然多糖,它由α-L-古罗糖醛酸(guluronate,G)和β-D-甘露醛酸(mannuronate,M)通过1,4糖苷键聚合而成。海藻酸钠具有良好的生物相容性,是一种很有前景的药物载体材料,但海藻酸凝胶用作药物载体时会导致药物突释,限制了其应用。
因此,本文将利用分子量可控的PLA作为疏水材料,在催化剂存在条件下,利用酰胺化反应对海藻酸钠实现疏水改性,以提高疏水药物大黄素的负载率,避免突释,拓宽应用范围。
1 材料与方法
1.1 药品与试剂
透析袋(MW 8000,上海源叶生物);大黄素(上海诗丹德);其他药品与试剂均购自国药集团,分析纯。
1.2 仪器与设备
紫外荧光分光光度计(IX71-F22FL/PH,中国);傅里叶变换红外光谱仪(IRAFFINITY-1,日本岛津);冷冻干燥机(PD5-4T,美国SIM);热重分析仪(TG 209 F3,德国耐驰);电子分析天平(德国赛多利斯);搅拌仪(德国IKA);气浴恒温振荡器(ZD-85,巩义予华)。
1.3 实验方法
1.3.1 端链氨基化聚乳酸的合成
丙交酯的合成:首先将乳酸在低温条件下脱水缩合形成低聚乳酸,然后将形成的低聚乳酸在高温下裂解环化形成白色丙交酯,过程如图1。
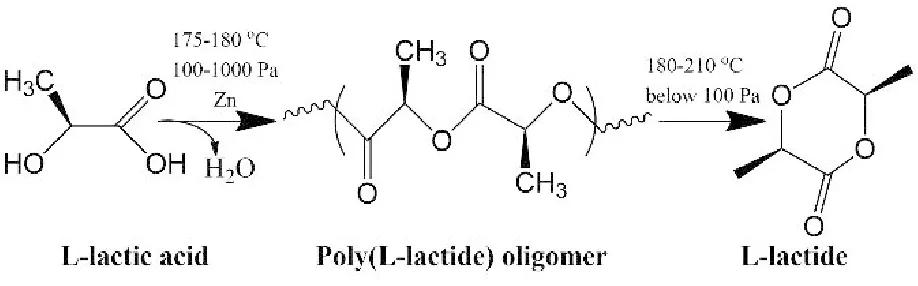
图1 丙交酯的合成过程
丙交酯的纯化:称取大约2g左旋丙交酯晶体粉末,加入3mL乙酸乙酯溶液中,60℃的水浴下搅拌溶解,待降到室温后放入4℃的冰箱冷藏2h,过滤,常温下真空干燥箱干燥24h,得到丙交酯的晶体粉末,重复上述操作2次。
PLA-NH2的合成:称取重结晶丙交酯适量,加入50mL单口圆底烧瓶中,加辛酸亚锡、EABoc适量,抽真空,充氮气两次,在氮气保护下120℃反应3h。反应后生成的固体用二氯甲烷溶解,沉淀于无水乙醇中,在常温下真空干燥24h即得到末端氨基化的聚乳酸,记为PN。PN分子量可以通过控制引发剂与丙交酯的比例进行调变,反应过程见图2。
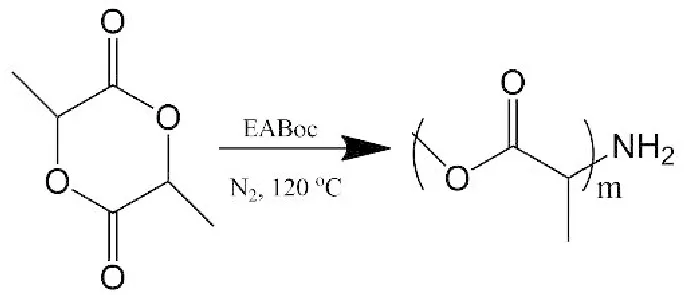
图2 末端氨基化聚乳酸合成过程
1.3.2 海藻酸钠酰基化改性
反应过程见图3,称取一定量的海藻酸钠溶于蒸馏水中,通过滴加2mol/L HCl调节溶液pH至6.0左右,搅拌待溶液pH保持稳定后,加入一定量的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS),获得海藻酸溶液A;称取约50mg的PN于10mL四氢呋喃(THF)溶液中搅拌,于40℃的水浴中搅拌溶解,加入一定量的N,N-二甲基甲酰胺(DMF),得到溶液B。将B溶液缓慢滴加到A溶液中,滴加完毕后将混合液置于40℃水浴中,继续搅拌24h。
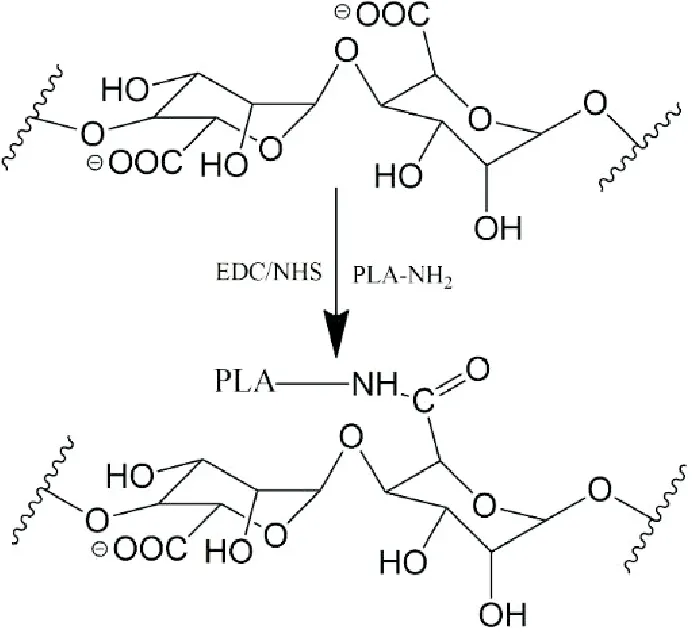
图3 海藻酸的酰基化改性过程
反应完毕,将混合液离心,超纯水洗涤3次,冷冻干燥即得到白色固体粉末,记作ALPN-x(x代表投料COOH/NH2摩尔比)。在此过程中,可通过调节加入物的-COOH/-NH2比例,以调控海藻酸中羧基酰基化反应,从而实现接枝聚合物的亲/疏水性调变。
1.3.3 大黄素/ALPN-x微囊的制备及缓释
取30mg ALPN-x粉末于10mL纯水中,不断搅拌直至完全溶解。另取配制好的大黄素溶液10mL(浓度约0.5mg/mL)加入上述ALPN-x水溶液中,超声5min得到混合溶液,搅拌1.5h以保证大黄素在载体上的充分吸附。最后用医用五号针将10mL 3wt%的氯化钙溶液缓缓注入混合溶液中,继续搅拌5min,于离心机中4000rpm离心20min分离上清液,并用蒸馏水洗涤3次,得到负载大黄素的ALPN-x体系,记为Rhe/ALPN-x,离心过程中的上清液液均保存并准确记载体积。作为对照,海藻酸钠微囊的制备同上,所得到的样品记为Rhe/AL。大黄素的负载量可通过间接法计算:即加入大黄素的质量减去离心后上清液中所含有的大黄素质量[8]。
将制备的Rhe/AL或Rhe/ALPN-x用透析袋密封,于100mL锥形瓶中加入50mL 5wt% NaOH溶液,置于38℃恒温振荡箱中振荡,0.5、1、1.5、2、3、4、5、6、7、8、9、10、11、13、14、16、25、27、29、31、33、35、36h后分别取3mL溶液,测量大黄素的浓度。每次取出释放液后补加3mL 5wt% NaOH空白溶液。
2 结 果
2.1 大黄素溶液浓度线性关系考察
在7~20μg/mL范围内,配制具有一定浓度梯度的系列大黄素5wt% NaOH溶液,于紫外(检测波长257nm)下测定不同浓度大黄素溶液的吸光度。以吸光度(A)作横坐标,浓度(C)为纵坐标拟合曲线见图4。从拟合的曲线可以看出在7~20μg/mL,大黄素浓度与吸光度具有很好的线性关系。
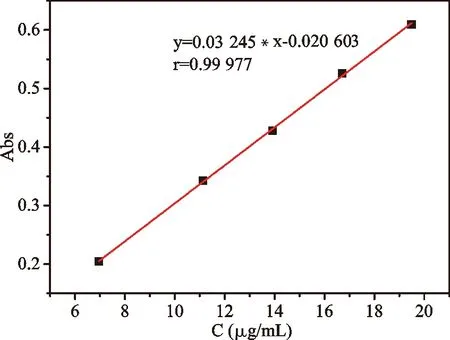
图4 大黄素标准曲线
2.2 红外表征
单纯的海藻酸钠(图5b)在3 426、1 613、1 416、1 088和1 033cm-1有较强的吸收,其中3 426cm-1归属于羧基吸收峰,1 613和1 416cm-1归属于羰基中C=O双键的伸缩振动,1 088cm-1和1 033cm-1归属于海藻酸钠中六元糖环中骨架C-O的伸缩振动。另外,图5b样品在620cm-1处较弱吸收,归属于亚甲基或是次甲基中的C-H振动。
图5c为合成末端氨基化的聚乳酸粉末PN,在3 515cm-1有较为明显的吸收峰,可能属于聚乳酸中羧基吸收峰,也可能是末端-NH2中的N-H键振动吸收峰。在1 750cm-1附近有强烈的羰基特征吸收峰,说明产物中含羰基。在3 008cm-1处有明显归属于甲基和亚甲基的不对称伸缩振动吸收峰,亚甲基的对称伸缩振动则对应于2 954cm-1处吸收峰。在1 090和1 184cm-1处吸收峰对应于C-O伸缩振动,次甲基的C-H弯曲振动吸收对应于1 384cm-1,甲基的C-H弯曲振动吸对应于1 480cm-1。因此,通过PN样品的FT-IR可以初步得出在聚乳酸末端成功封装-NH2。
图5a为ALPN-24的FT-IR谱图,该样品的羰基吸收峰在1 770cm-1处,较羰基在PN样品中的1 750cm-1和AL样品中的1 613cm-1,均向波数蓝移,这可能是由于酰胺键的形成。ALPN-24样品表现出明显的与PN相同的甲基和亚甲基的振动吸收峰(3 008和2 954cm-1)以及AL样品中亚甲基或次甲基的振动(620cm-1),说明利用酰胺化反应成功实现了海藻酸样品中羧基与末端封装氨基的聚乳酸样品的接枝。
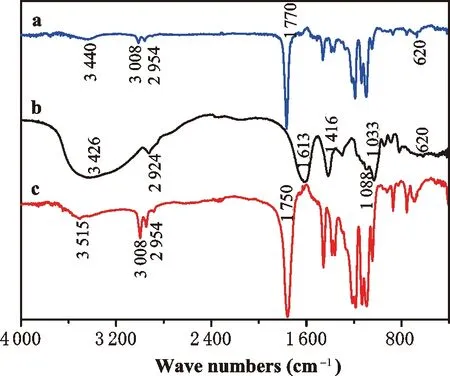
a.ALPN-24;b.AL;c.PN
2.3 热重分析
热重分析通过程序控温,可以测量物质质量随温度的变化情况,每一种物质都有其固定的汽化温度,温度的变化主要受物质结构的影响。因此,通过热重分析技术,可以准确获取物质发生质量变化时对应的温度,为推断物质结构提供一定的参考。本实验中,以氮气作为载气和吹扫气体,升温速率为30℃/min,记录样品失重曲线,如图6所示。
从图6可以看出,所有样品在200℃之前,随着温度的升高,质量会缓慢降低,这可能是水份蒸发或是聚合物中分子量较小的物质汽化所致。在250℃~450℃,样品均有较为急剧的失重,由于升温过程中载气和吹扫气体均使用惰性气体,因此,这一阶段的失重是由于聚合物的碳化失去氢和氧引起。当温度进一步升高时,PN和ALPN-x样品重量基本保持不变,而AL样品还有较为轻微的下降,这可能是由于钠元素的存在,增高温度,在碳化失去氢和氧的同时有无机盐的生成,各样品的失重率见表1。从表1可以看出,PN样品的失重率达到98%,这说明该样品除了碳化失氢和氧外,可能还有部分分子量较小的聚乳酸样品汽化。海藻酸钠样品失重率约66%,低于理论上碳化失去氢和氧的重量,这可能是由于钠元素存在生成了无机盐。ALPN-x样品则随着羧基/氨基比例的提高,失重率有所下降,这一趋势与AL和PN失重趋势保持一致。
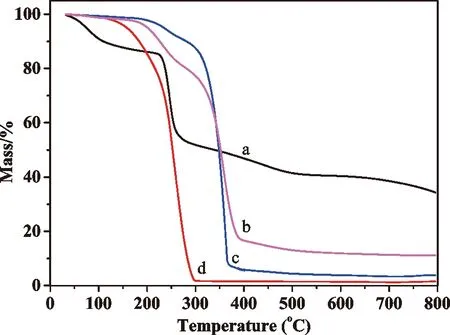
a.AL;b.ALPN-48;c.ALPN-24;d.PN
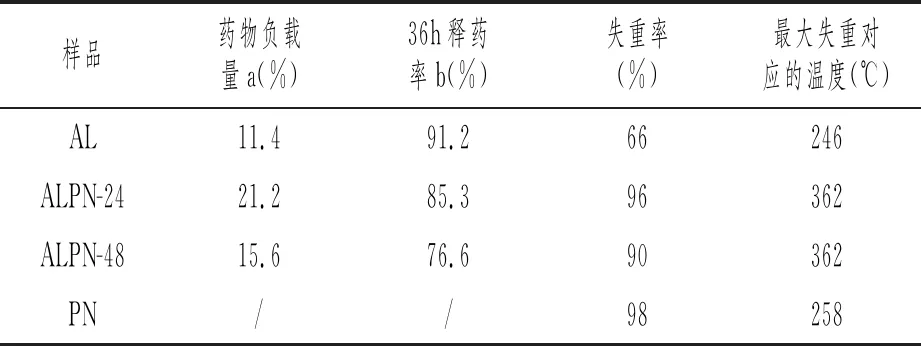
表1 各样品的相关物性及表征参数
通过对热重曲线进行一阶求导,可以准确获得失重信息所对应的温度,相关样品的DTG曲线见图7,对应的最大失重温度见表1。海藻酸钠(图9a)在78℃和246℃有失重,78℃的失重对应于分子失去水分,而246℃的急剧失重说明海藻酸钠盐在246℃时即发生汽化或碳化。PN(图9d)样品在180℃和258℃有明显失重。180℃失重稍高于乳酸的沸点,这可能是由低聚合度的聚乳酸的汽化或碳化,258℃失重对应于高聚合度聚乳酸的汽化或碳化。ALPN-x样品在229℃和362℃有明显失重,温度较PN和AL均有上升,这可能是由于进行酰基化反应后,分子量增大,样品交联度增高,从而提高了样品汽化或是碳化温度。
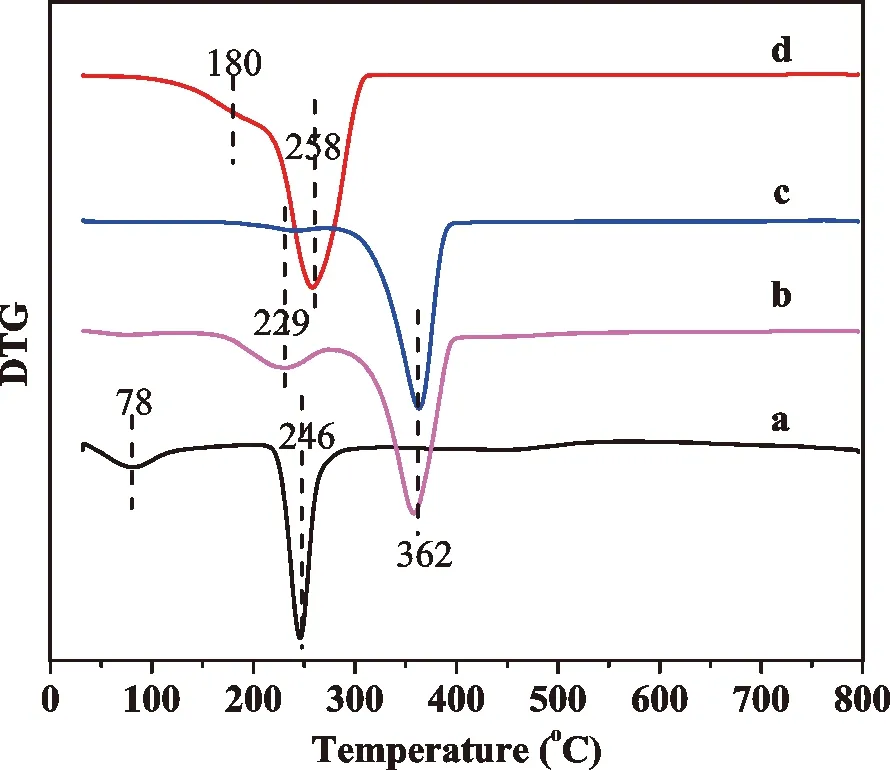
a.AL;b.ALPN-48;c.ALPN-24;d.PN
2.4 缓释性能考察
图8为不同样品在5wt% NaOH溶液中的释放曲线,为了进一步体现不同载体对大黄素释放能力,释放曲线中累积释药量均换算到单位质量载体所累积的释药量。从图中可以看出,通过酰胺化反应改性后的样品,其载药能力明显优于AL,这是由于聚乳酸为疏水性聚合物,而大黄素也具有疏水性。如表1所示,36h后,AL释放率达到91.2%,ALPN-24释放率为85.3%,ALPN-48释放率为76.6%,可见改性后的样品缓释性能也明显优于AL。

a.Rhe/ALPN-24;b.Rhe/ALPN-48;c.Rhe/AL
3 讨 论
PLA作为疏水性材料,受制于表面反应官能力团少缘故,应用受到限制,若将含羟基的单体接枝到PLA上可以提高PLA的亲水性、生物相容性等[9],极大提高其在医药领域的应用[10]。
目前,海藻酸钠疏水改性方法分为羟基反应法和羧基反应法,羟基反应法包括开环氧化法和接枝共聚法,羧基反应包括酯化法和酰胺化法。开环氧化法运用的原理是邻二醇在高碘酸根存在的条件下被氧化成醛,同时碳-碳单键断裂。值得注意的是,氧化的海藻酸钠(OSA)并无疏水性[11],同时,在使用高碘酸钠氧化法制备OSA时,海藻酸钠会出现一定程度的降解[12],而过低分子量的产物不利于制备胶珠[13]。于是,通过羧基反应,实现对海藻酸钠的衍生化修饰。羧基反应法中的酯化法[9]存在较多不足,主要是反应步骤多,产率低,产物需长时间透析除杂,限制了此类方法的实际应用。酰胺化法中通常使用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)与N-羟基琥珀酰亚胺(NHS)组成的催化体系,能够使海藻酸钠的羧基与氨基化合物发生酰胺化反应,该反应的特点是操作简单,只需室温下搅拌反应24~48h[8,14]。
FT-IR和TG表明,成功实现了海藻酸与聚乳酸的接枝,实现海藻酸钠的疏水改性。改性后的ALPN-x样品明显提高了疏水性药物大黄素的装载量,特别是ALPN-24样品,大黄素的负载率由11.4%提高到21.2%,并保持较好的缓释性能,表明进行疏水改性的海藻酸样品在输送疏水性药物具有很好的潜力,但相关缓释机制还需进行更深入的研究。

